连续性静脉-静脉血液透析滤过防治犬多器官功能障碍综合征
连续性静脉-静脉血液透析滤过(CVVHDF)能通过削弱血液循环中炎症介质的峰值浓度,重建机体免疫系统的内稳态,防治多器官功能障碍综合征(MODS)。内毒素是炎症反应的启动物质,是最早发挥作用的前炎症细胞因子,具有广泛的生物学效应[1,2]。CD14是在宿主抗病原微生物免疫应答中起重要作用的内毒素相关受体分子,是内毒素诱导炎症反应的始动环节[3,4]。高迁移率族蛋白1(HMGB 1)是脓毒症晚期致死性的促炎介质,受内毒素等刺激可分泌至细胞外,作为炎症介质参与MODS病理生理过程[5,6]。内毒素通过内毒素结合蛋白(LBP)结合CD14启动Toll样受体4(TLR4)介导的促炎反应,产生更多的细胞因子及炎症介质[7]。HMGB 1具有增强内毒素与LBP的结合效应,维持并延长炎症反应。HMGB 1的促炎功能和动力学特点加剧了器官功能的损伤,共同导致MODS的发生发展[8]。因此,本文观察CVVHDF治疗MODS犬过程中血浆内毒素、CD14、HMGB 1及器官组织CD14、HMGB 1蛋白变化,探讨其免疫调节机制。
方 法
模型制作与分组18只雄性Beagle犬,体重15±2 kg(由新疆医科大学实验动物中心提供)。随机分为正常对照组(n=6)、MODS组(n=6)和CVVHDF组(n=6)。
MODS模型建立:(1)动物称重,固定,消毒,术前1h戊巴比妥钠30 mg/kg静脉麻醉。经口气管插管,管深26 cm,插管成功后接呼吸机辅助呼吸,模式为容量控制通气(CMV),参数:潮气量12 ml/kg、呼吸频率为15次/min、吸氧浓度0.30。行右颈内静脉和左股动脉穿刺术,置入5F Swan-Ganz漂浮导管和20 G动脉留置针,连接心功能监护仪行血流动力学监测。(2)失血性休克和复苏:术后20 min,采用Wiggers法[9]造成失血性休克,维持平均动脉压(MAP)6.0~7.3 kPa 1h。休克终点,经颈静脉快速回输失血和两倍失血量的林格氏液。回输完毕MAP和心排指数(CI)均能恢复至伤前水平的80%以上。(3)复苏12h后由静脉持续12h滴入内毒素(大肠杆菌O111B4内毒素,第二军医大学基础医学部微生物学教研室提供)1.5 mg/kg。
MODS造模成功的标志:动物致伤24h后出现≥2个器官衰竭者诊断为MODS,24h内发生器官衰竭或死亡者,视为复苏失败。呼吸功能障碍标准:PaO2<8 kPa(60 mmHg); 肝功能功能障碍标准:谷丙转氨酶(ALT)>2倍对照值; 肾功能障碍标准:少尿,血清尿素氮>2倍对照值;胃肠道功能障碍标准:黏膜出血、糜烂、应激性溃疡形成。出现2个或2个以上器官功能障碍者即可诊断为MODS[10]。
MODS组未行CVVHDF治疗,CVVHDF组在内毒素注射完毕后(T3)即动物模型建模完成时行CVVHDF治疗24h。两组动物均对症支持治疗:24h补液量:100 ml/kg,总量约1 500 ml/24h。以50%葡萄糖注100 ml~200 ml/24h 补充能量,总热量(kcal)=1.25×30×体重+70。分别于术前(T1)、内毒素注射前(T2)、内毒素注射完毕后0h(T3)、3h(T4)、6h(T5)、9h(T6)、12h(T7)、18h(T8)及24h(T9),留取血标本待测。
CVVHDF方法均采用右侧颈内静脉或股静脉留置单针双腔导管建立血管通路,采用PRISMA-flex型智能化床旁肾脏替代治疗机(瑞典),AN-69型滤器(膜面积0.9 m2),血流量150 ml/min,透析液1 L/h,置换液1L/h,前稀释法输入。治疗时间为24h。肝素首剂1 kU/kg,此后以2 kU/4h静脉泵入。超滤量根据全天治疗量和生理需要量设定。
检测指标内毒素定量测定采用MB-80微生物快速动态检测系统、EKT-5M Set 内毒素检测试剂盒(购自北京金山船科技发展公司)。CD14及HMGB 1测定采用ELISA法,按试剂盒说明进行(购自美国R&D公司)。
Western Blot法检测各脏器组织CD14、HMGB 1蛋白表达处死后(T9)立刻剖腹取肺脏、心脏、肝脏、肾脏及开颅取脑组织,取100 mg组织置于冰皿上,加入200 μl裂解液,Brandforad法测定蛋白浓度。每组各取50 μg样品进行12%的SDS-PAGE凝胶电泳,半干转移至PVDF膜。脱脂奶TBS-T溶液封闭1h,随后加入一抗CD14 1∶1 000 (Thermo scientific,Pierce Biotechnology,MAI-82693),HMGB 1 1∶2 000 (ab12029,Hong Kong),β-actin 1∶1 000 (sc-47778,Santa Cruz Biotechnoogy,USA) 4℃ 孵育过夜,次日洗膜后与HRP标记的二抗孵育2h,洗膜。使用ECL试剂盒显色曝光成像。采用Fuji Image软件分析,目的蛋白/β-actin比值作为目的蛋白相对表达量。
病理学检查处死后(T9)立刻剖腹取肺脏、心脏、肝脏、肾脏及开颅取脑组织,观察脏器大体形态后,切取组织,经体积分数为10%的甲醛固定,常规石蜡制片,HE染色。
统计学分析采用SPSS 12.0软件包进行数据分析,不同指标各时间点两组比较采用成组t检验,如方差不齐则采用两样本的t'检验。治疗前后采用重复测量资料方差分析。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
血浆内毒素、CD14及HMGB 1变化MODS组输入内毒素后血浆内毒素、CD14及HMGB 1水平呈进行性升高并保持在较高水平,分别在T7、T9、T8时间点达高峰约为试验前的12.5、3.3、5.8倍。CVVHDF组,经CVVHDF治疗后内毒素、CD14及HMGB 1水平均逐渐下降,在T6~9时间点显著低于MODS组(P<0.01)(表1,图1~3)。
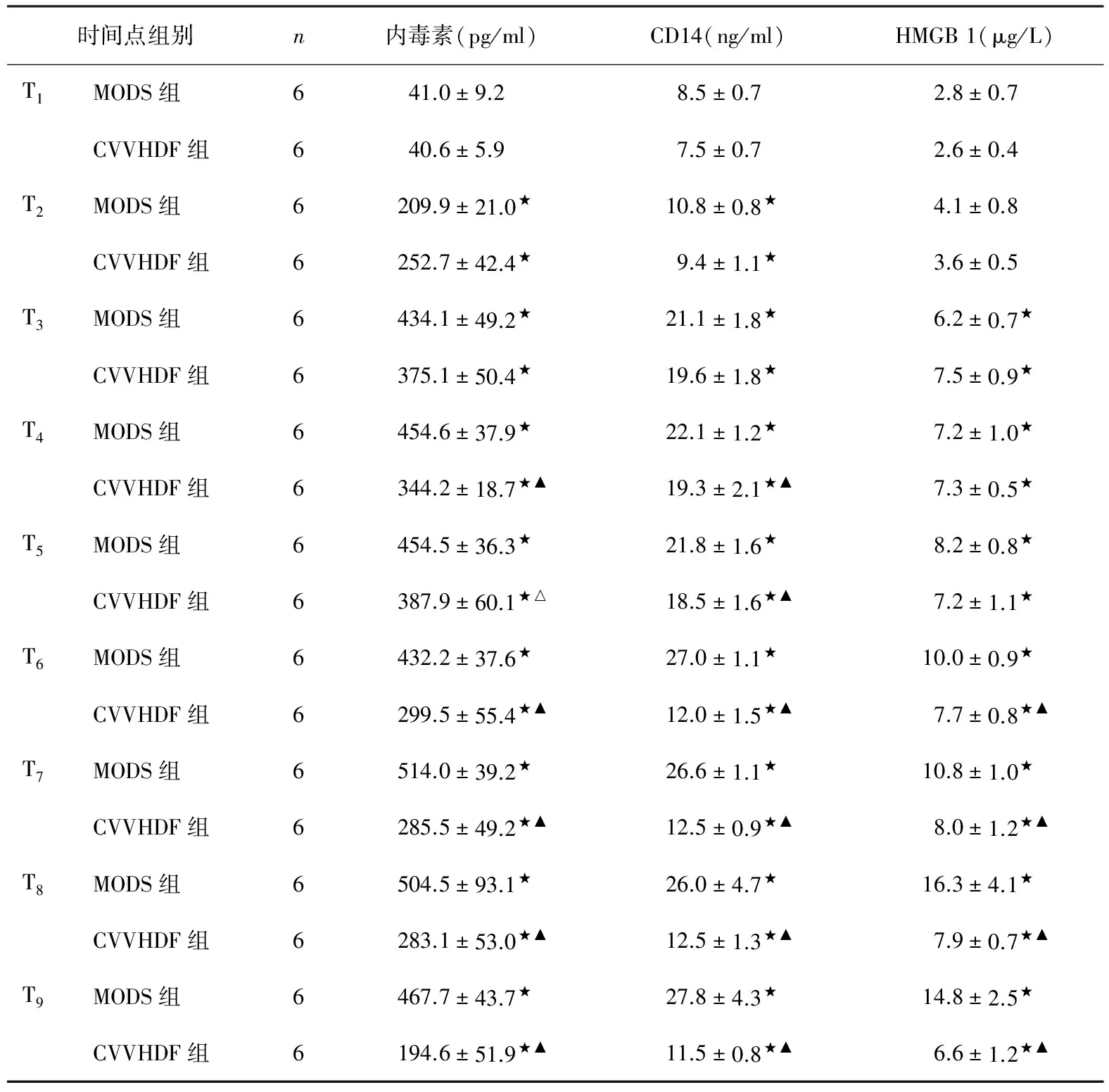
表1 两组血浆内毒素、CD14及HMGB 1变化

图1 CVVHDF 组和MODS组血浆内毒素变化
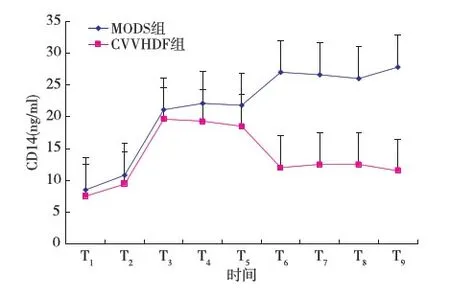
图2 CVVHDF 组和MODS组血浆CD14变化
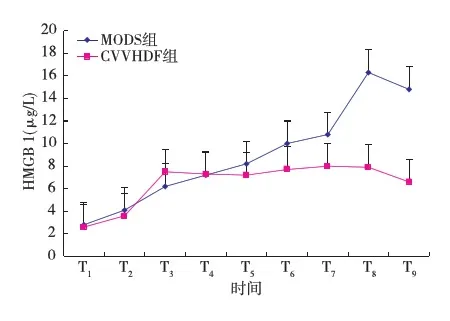
图3 CVVHDF 组和MODS组血浆HMGB 1变化
各脏器组织CD14、HMGB 1蛋白表达变化在正常状态下,肺脏、心脏、肝脏、肾脏及脑组织CD14、HMGB 1蛋白表达水平较低。经两次打击后,MODS组肺脏、心脏、肝脏、肾脏及脑组织CD14、HMGB 1蛋白表达均较正常对照水平明显升高(P<0.01)。经CVVHDF治疗后,CVVHDF组各组织中CD14、HMGB 1蛋白表达均有所降低,其中,CVVHDF组肝脏及脑组织CD14蛋白表达显著低于MODS组(P<0.05),CVVHDF组肺脏、肾脏及脑组织HMGB 1蛋白表达显著低于MODS组(P<0.05)(表2、3)。

表2 三组各脏器组织CD14蛋白表达变化
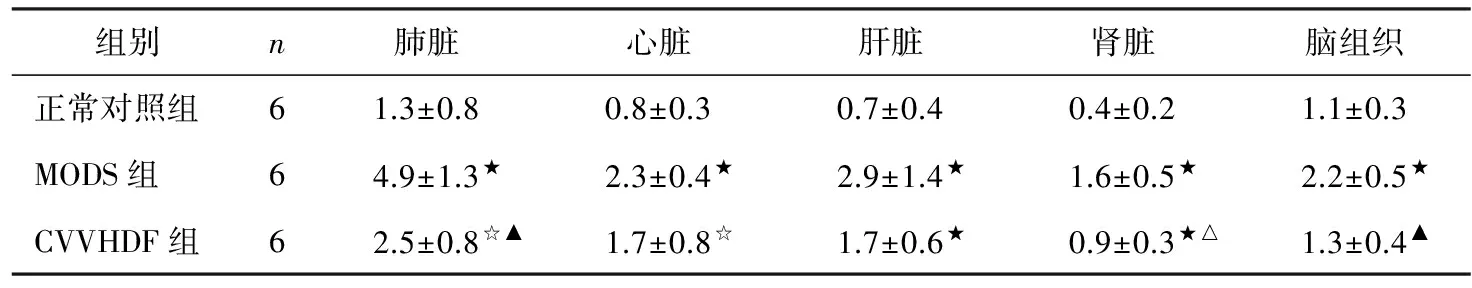
表3 三组各脏器组织HMGB 1蛋白表达变化
各脏器组织病理学改变
肺脏 正常肺组织可见肺泡、肺泡壁、肺泡腔及支气管、血管。MODS组动物肺泡扩张,肺泡间隔变窄并断裂,相邻肺泡融合成较大的囊腔。肺泡上皮脱落,毛细血管扩张充血,肺泡腔出血。CVVHDF组损害减轻,部分肺泡壁断裂,肺泡融合。肺泡腔内出血,并见心衰细胞。
心脏 正常心肌组织心肌细胞及细胞核结构排列规则,间质动静脉分布正常。MODS组心肌结构紊乱,心肌细胞肥大,部分心肌细胞脂肪变性,闰盘减少,血管扩张充血,间质出血。CVVHDF组损害减轻心肌细胞肿胀,细胞密度增高,部分胞质内呈嗜酸性颗粒样变,间质少许炎细胞。
肝脏 正常肝脏组织肝细胞结构规则,少许肝细胞脂肪变性。MODS组正常肝板结构消失,结构紊乱,肝细胞萎缩脂肪变性,点灶状坏死,肝窦扩张淤血出血,汇管区小胆管增生,炎细胞浸润。CVVHDF组损害减轻,中央静脉扩张,肝细胞水肿,胞质疏松淡然,气球样变性,肝小叶与汇管区轻度炎细胞浸润。
肾脏 正常肾脏组织肾小球及肾小管结构排列正常。MODS组肾小球细胞数量增多,部分球囊壁增厚,肾小管肿胀,间质出血,炎细胞浸润。CVVHDF组损害减轻,肾小球及间质毛细血管扩张充血,肾小管细胞胞质淡染,水肿。
脑组织 正常脑组织可见排列正常的少突胶质细胞和星形细胞。MODS组脑组织呈海绵状,细胞内和细胞间质明显水肿肿胀,脑血管扩张充血,脑血管间隙增宽。CVVHDF组损害减轻,脑组织略呈海绵状,神经细胞轻度肿胀。
讨 论
随着对MODS发病机制的深入研究,免疫功能改变、免疫动态平衡失调在MODS发病中的作用逐渐受到重视。连续性血液净化治疗MODS的免疫调节机制[11-14]:(1)有效清除循环中可溶性炎性介质,减轻炎症介质对免疫细胞功能直接抑制; 阻断Th1向Th2的漂移; 减轻淋巴细胞异常凋亡。(2)清除血中除炎症介质以外其他毒性物质及致病因子。(3)抑制炎症系统与凝血系统相互作用,阻断炎症级联。(4)改善组织氧合和心肺功能,重建机体免疫系统内稳状态等。本研究观察CVVHDF治疗MODS犬过程中血浆LPS、CD14、HMGB 1及器官组织CD14、HMGB 1蛋白变化,探讨其免疫调理机制。
本研究采用失血性休克+复苏灌注+内毒素血症建立MODS模型[15],主要依据:(1)临床MODS多为复合因素所致,创伤性休克及感染最为多见;(2)创伤性休克患者常并发感染,且多在伤后数小时发生;(3)细菌感染最终是细菌释放内毒素起作用。故本模型先造成失血性创伤,使机体免疫系统处于激活状态,再注入内毒素,成为二次打击的触发因子,模拟人类脓毒血症时内毒素释放入血的特点。
本模型优点:(1)实验动物常用小鼠、大鼠、家兔等,与人类种属差异较大的小动物实验资料很难解释很多临床现象。哺乳类动物犬在生理上与人类较接近,对休克创伤有更强的耐受力。因此,Beagle犬是建立MODS模型比较理想的动物。(2)造模方法上不同以往MODS动物造模方法,提高内毒素静脉注射剂量,将短时足量注射改为缓慢持续静脉滴注,使动物机体有充分反应时间,造模成功率为80%(其中3只实验动物犬分别因室颤、失血性休克、麻醉意外死亡)。(3)建立了动物ICU,予全程呼吸和循环器官支持及监护,全面真实反映MODS的发病因素、临床特征及发生发展过程。
Ronco等[14]研究证实,CVVHDF治疗MODS犬能明显改善内毒素诱导的低血压,提高动脉血氧分压,有效清除血浆内毒素,改善肾功能。本研究结果显示,在MODS病程中,机体血浆内毒素、CD14及HMGB 1水平呈进行性升高并保持在较高水平,肺脏、心脏、肝脏、肾脏及脑组织CD14、HMGB 1蛋白表达显著升高,肺脏、心脏、肝脏、肾脏及脑组织病理损伤较严重;CVVHDF治疗后,通过有效清除可降低循环中内毒素、CD14及HMGB 1水平,各组织中CD14、HMGB 1蛋白表达均有所降低,其中,CVVHDF组肝脏及脑组织CD14蛋白表达显著低于MODS组(P<0.05),CVVHDF组肺脏、肾脏及脑组织HMGB 1蛋白表达显著低于MODS组(P<0.05)。肺脏、心脏、肝脏、肾脏及脑组织病理损伤明显减轻。Hagiwara等[16]研究发现,血浆内毒素、CD14、HMGB 1及器官组织CD14、HMGB 1蛋白表达水平与脓毒症严重程度及疾病进展密切相关。本试验CVVHDF治疗组,血浆内毒素、CD14、HMGB 1及各组织中CD14、HMGB 1蛋白表达明显低于MODS组,说明CVVHDF治疗通过血液滤过可削弱血循环中大多数炎症介质的峰值浓度,下调各组织中CD14、HMGB 1蛋白表达,重建机体免疫系统的内稳态,在一定程度上改善病情。
综上所述,过度的炎症反应是MODS发生的本质原因之一,CVVHDF能够削弱血循环中内毒素、CD14及HMGB 1等炎症介质的峰值浓度,下调肺脏、心脏、肝脏、肾脏及脑组织中CD14、HMGB 1蛋白表达,有效遏制过度的炎症反应,从而防治MODS。
1 张振宇,艾克拜尔.亚力坤,杨小朋,等.高容量血液滤过对多器官功能障碍犬内毒素及CD14的影响.中华急诊医学杂志,2011,20(9):930-934.
2 Volman TJ,Goris RJ,van der Meer JW,et al.Tissue- and time-dependent upregulation of cytokine mRNA in a murine model for the multiple organ dysfunction syndrome.Ann Surg,2004,240(1):142-150.
3 郭洪志,屈传强,贾建平.急性前脑缺血致多器官功能障碍综合征动物模型的建立及内毒素受体CD14的表达.中国脑血管病杂志,2004,1(2):85-90.
4 Calvano JE,Agnese DM,Um JY,et al.Modulation of the lipopolysaccharide receptor Complex(CD14,TLR4,MD-2) and toll-like receptor 2 in systemic inflammatory response syndrome-positive patients with and without infection:relationship to tolerance.Shock,2003,20(5):415-419.
5 Lotze MT,Tracey KJ.High-mobility group box 1 protein (HMGB 1):nuclear weapon in the immune arsenal.Nat Rev Immunol,2005,5(4):331-342.
6 Liu H,Yao YM,Yu Y,et al.Role of Janus kinase/signal transducer and activator of transcription pathway in regulation of expression and inflammation-promoting activity of high mobility group box protein 1 in rat peritoneal macrophages.Shock,2007,27(1):55-60.
7 Verbon A,Dekkers PE,ten Hove T,et al.IC14,an anti-CD14 antibodies inhibits endotoxin-mediated symptoms and inflammatory response in humans.J Immunol,2001,166(5):3599-3605.
8 康华,姜虹.高迁移率族蛋白B1与脓毒症关系的研究进展.医学综述,2009,15(16):2410-2413.
9 胡森,盛志勇,周宝桐,等.双相迟发多器官功能不全综合症(MODS)动物模型的研究.中华创伤杂志,1996,12(2):102-106.
10 方国恩,华积德,沈炎明,等.一种新的动物多器官衰竭模型的建立.第二军医大学学报,1995,16(1):86-88
11 陶晓根,刘宝,王锦权.连续性血液净化的免疫调节作用与脓毒症.中国急救医学,2007,27(11):1039-1041.
12 Hotchkiss RS,Karl IE.The pathophysiology and treatment of sepsis.N Engl J Med,2003,348(2):138-150.
13 Ronco C,Brendolan A,Lonnemann G,et al.A pilot study of coupled plasma filtration with adsorption in septic shock.Crit Care Med,2002,30(6):1250-1255.
14 Ronco C,Bonello M,Bordoni V,et al.Extracorporeal therapies in non-renal disease:treatment of sepsis and the peak concentration hypothesis.Blood Purif,2004,22(1):164-174.
15 陈继红,张振宇,李玉芳,等.两次打击致犬多器官功能衰竭的实验研究.中华急诊杂志,2010,19(11):1167-1170.
16 Hagiwara S,Iwasaka H,Togo K,et al.A neutrophil elastase inhibitor,sivelestat,reduces lung injury following endotoxin-induced shock in rats by inhibiting HMGB 1.Inflammation,2008,31(4):227-234.

