重链沉积病的临床病理特点
单克隆免疫球蛋白沉积性疾病(MIDD)临床较少见,指单克隆免疫球蛋白分子沉积在基膜上,包括轻链沉积病(单克隆轻链沉积,LCDD),重链沉积病(单克隆重链沉积,HCDD),轻重链沉积病(单克隆轻链和重链沉积,LHCDD)。肾脏是MIDD最常累及的器官之一,肾活检病理是最直接的诊断手段,尤其是免疫病理轻、重链染色和电镜是最终诊断的关键。当轻、重链染色和电镜缺乏时易出现临床漏诊和误诊。MIDD以轻链沉积病最常见,HCDD最近亦有陆续报道。HCDD主要特点是单一重链在肾小球基膜和肾小管基膜上沉积,无轻链沉积,其中以γ型重链最常见。国外文献报道HCDD临床主要表现蛋白尿、高血压和肾功能不全。国内报道少,对其认识也不足,我们回顾分析本研究所11例诊断为HCDD患者的临床病理特点,以加强对这一疾病的认识,提高诊治水平。
对象和方法
研究对象回顾分析南京军区南京总医院全军肾脏病研究所1990年1月至2012年10月行自体肾活检的患者44 652例。入选诊断标准:(1)免疫荧光染色单一免疫球蛋白重链沿肾小球基膜、肾小管基膜线样沉积,无轻链沉积;(2)电镜下观察到细沙状电子致密物沿肾小球基膜内侧缘和肾小管基膜外侧缘沉积;(3)刚果红染色阴性。
临床指标记录患者的性别、年龄、病程、临床表现及实验室检查资料。包括血常规,血清肌酐(SCr)、血清白蛋白(Alb)、血脂,血清免疫固定电泳,血游离轻链,骨髓穿刺及活检结果。尿液检查包括尿蛋白定量(采用双缩脲法),尿沉渣红细胞计数按本实验室方法(即取晨尿浓缩20倍后在血球计数仪下计数,以每毫升红细胞数表示,尿游离轻链,本-周氏蛋白)。肾小管功能损伤指标:尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG),尿视黄醇结合蛋白(RBP)。
定义 高血压:舒张压>90 mmHg,收缩压>140 mmHg。贫血:男性Hb<120 g/L,女性<110 g/L。肾功能不全:SCr>109.62 μmol/L。血游离轻链κ/λ比值异常定义<0.26或>1.65。24h尿蛋白定量正常值<0.4 g/d,尿沉渣红细胞计数>10 万/ml为镜下血尿,尿NAG酶正常<16.5 U/(g·cr),尿RBP正常<0.5 mg/L。
肾脏病理所有患者均在B超引导下行经皮斜角进针负压吸取法肾穿刺活检术。所取肾组织分送光镜、免疫病理及电镜检查。光镜组织常规行HE、PAS、PASM-Masson及Masson三色染色,免疫病理采用免疫荧光直接法观察肾组织IgG、IgA、IgM、C3、C1q的沉积强度及部位。穿刺标本光镜检查所需肾小球数均≥8个。电镜观察所取肾组织以3.75%的冷戊二醛固定,1 %四氧化锇后固定,超薄切片厚70~90 nm,醋酸铀、柠檬酸铅双染色。置于Hitachi 7500透射电子显微镜下观察。
肾组织免疫荧光染色 IgG亚型染色过程:冰冻切片3 μm,干燥;小牛血清封闭10 min,滴加一抗IgG1(1∶200,鼠抗人,8c/6-39,sigma), IgG2 (1∶200,鼠抗人,HP-6014,sigma),IgG3(1∶200,鼠抗人,HP-6050,sigma),IgG4(1∶200,鼠抗人,HP-6025,sigma),室温孵育1h;PBS洗三次,滴加FITC标记的兔抗鼠二抗,室温孵育30min;水洗,吹干,甘油封片,荧光显微镜下观察。肾组织κ、λ轻链染色:冰冻切片3 μm,干燥;小牛血清封闭10 min,滴加一抗λ轻链(1∶100,兔抗人,A0100,Dako),λ轻链(1∶100,兔抗人,A0101,Dako)室温孵育1h;PBS洗三次,滴加FITC标记的猪抗兔二抗,室温孵育30 min。水洗,吹干,甘油封片,荧光显微镜下观察。
统计学方法采用SPSS 13.0统计软件进行数据分析,计量资料用均数±标准差表示。
结 果
临床表现及实验室检查特点选取HCDD患者11例,占所有肾活检患者的0.02%,低于同期LCDD(58例)的发生率(0.13%)。11例HCDD患者中男性4例,女性7例,平均年龄48.2±9.9岁,中位年龄45岁。平均病程9.7±13.2月,中位病程8月。8例患者存在高血压,6例患者SCr升高,10例患者伴贫血,9例表现为肾病范围蛋白尿,9例患者存在镜下血尿,无1例肉眼血尿。11例患者的Alb 27.2±5.1 g/L,SCr 185.64±150.28 μmol/L,Hb 91±21 g/L,尿蛋白定量为4.15±2.06 g/d,尿NAG 75.5±38.2 U/(g·cr),RBP 10.5±10.7 mg/L(表1)。2例患者尿κ/λ比值<1,3例患者尿κ/λ比值>10。9例患者检测尿本-周蛋白均阴性。骨髓活检浆细胞均在正常范围(表2),7例接受血清免疫固定电泳检测的患者中4例存在λ型IgG单克隆免疫球蛋白条带。血κ轻链265.0±336.4 mg/L,λ轻链67.0±49.0 mg/L,血游离轻链κ/λ比值异常升高者5例(>1.65),均为κ值明显升高,其中升高明显者2例(>8),无一例κ/λ比值<0.26。9例患者存在低补体C3血症,7例存在低补体C4血症。6例患者检测血冷球蛋白水平,4例略高于正常。
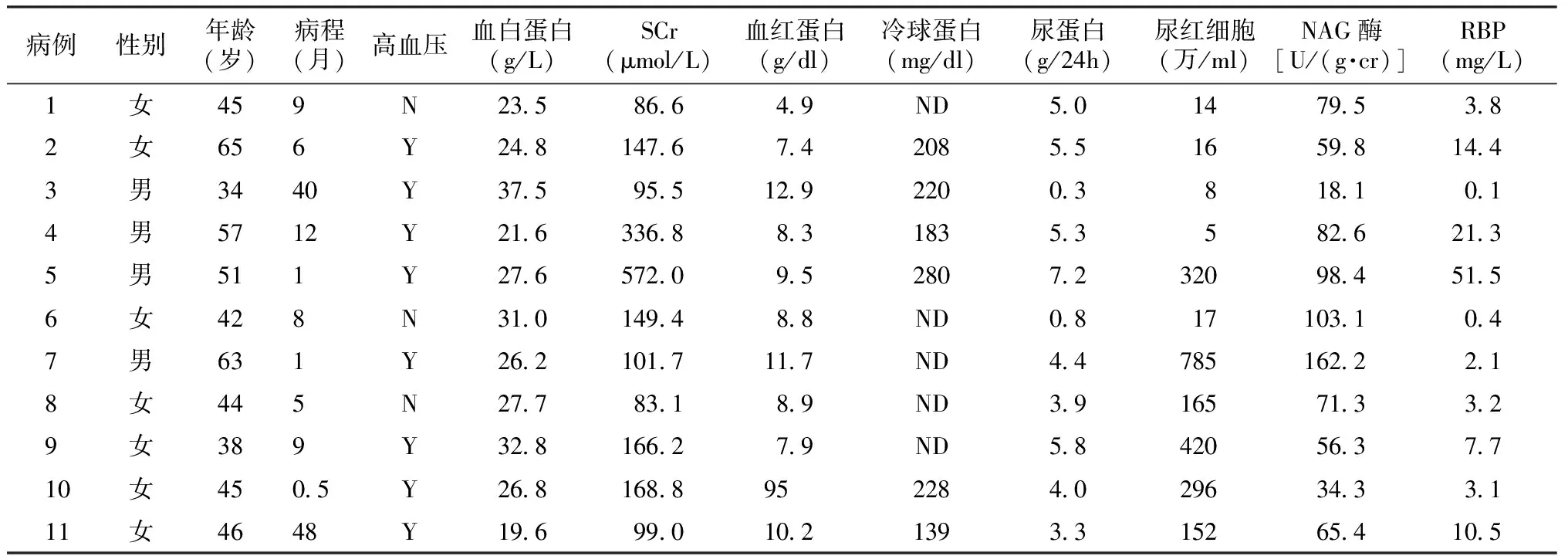
表1 11例重链沉积病患者的临床资料及实验室检查

表2 重链沉积病患者骨髓活检及血免疫学检查
肾脏病理
光镜 取材肾小球数平均28±8个(15~40个)。所有患者肾小球均出现结节性病变,其中6例患者肾小球结节呈弥漫性分布(图1A),且肾小球面积显著增大,余5例患者肾小球仅表现节段性小结节形成,其肾小球面积亦较正常略增大,但小于弥漫结节者(表3)。例2、例6和例8患者各出现2处肾小球系膜区结构消失,系膜溶解,HE、PAS染色下见系膜区变淡。肾小球结节形成处见邻近袢融合,部分切面结节周围袢完全融合,呈环状包绕结节,其中5例患者肾小球节段袢融合处见纤维素样渗出。弥漫结节形成者结节大小形态较均一,结节中心少细胞或无细胞增生,部分结节周边见环状排列的细胞,PASM-Masson染色下结节中心不嗜银,或嗜银性减弱(图1B),5例患者在Masson三色下结节区见嗜复红物沉积。5例(45.5%)患者伴球性硬化,1例患者伴节段硬化(2.9%),5例(45.5%)患者见新月体形成,均为细胞纤维性新月体。11例患者均见血管病变,主要为动脉透明变性,动脉内膜弹力层增厚、分层。本组患者肾小管间质病变以急性病变较多见,7例患者肾小管急性病变≥10%,2例患者肾小管萎缩、间质纤维化达10%,其他均<5%。
免疫荧光 本组11例患者均为IgG(重链γ)沉积,未见IgA(α)和IgM(μ)重链沉积者。4例患者仅单纯有IgG沉积,1例患者同时伴C1q沉积,6例同时伴C3、C1q沉积。IgG沉积部位具有特征性,IgG在肾小球系膜区和结节区弥漫沉积,外周袢呈线样沉积,同时IgG呈线样广泛沉积于肾小管基膜(图1C、D)。8例患者尚见IgG在动脉血管壁上沉积。IgG亚型染色显示单纯IgG1沉积者6例,单纯IgG2沉积者1例,单纯IgG3沉积者2例,IgG1沉积为主伴节段IgG4同时沉积者1例,IgG2、IgG4同时沉积者1例。所有患者肾组织轻链染色肾小球和肾小管基膜均阴性。5例患者肾小球纤维蛋白染色阳性,主要位于光镜下节段袢融合,纤维素样渗出处(表4)。

图1 A:肾小球体积增大,呈结节状,见细胞纤维性新月体(PAS,×400);B:肾小球结节区嗜银性减弱或不嗜银(PASM-Masson,×400);C、D:IgG染色肾小球系膜区呈团块状、外周袢和肾小管基膜类线样沉积,肾间质动脉亦阳性(↑)(IF,×400)
表311例患者肾活检组织学特点

病例肾小球面积(μm2)球性硬化(%)节段硬化(%)新月体/%肾小球病变血管病变143619 79±3171 34009 7(细胞纤维性)弥漫结节动脉弹力层增厚、分层255650 39±9824 61007 5(细胞纤维性)弥漫结节伴系膜溶解动脉节段透明变性,内膜增厚329384 95±634 56004 0(细胞纤维性)节段小结节动脉节段透明变性,内膜增厚453376 99±3396 6022 709 1(细胞纤维性)弥漫结节动脉节段透明变性,内膜增厚533721 42±808 143 100弥漫结节动脉管壁增厚639109 07±3462 555 900节段小结节伴系膜溶解小动脉节段透明变性726829 99±2486 50000节段小结节动脉节段透明变性、节段弹力层增厚、分层828771 27±799 04000节段小结节伴系膜溶解动脉节段透明变性,内膜增厚936981 82±620 940020(细胞纤维性)弥漫结节个别小动脉内膜增厚1027452 12±2814 237 900节段小结节动脉管壁增厚1152116 85±4972 4023 52 90弥漫结节动脉节段透明变性
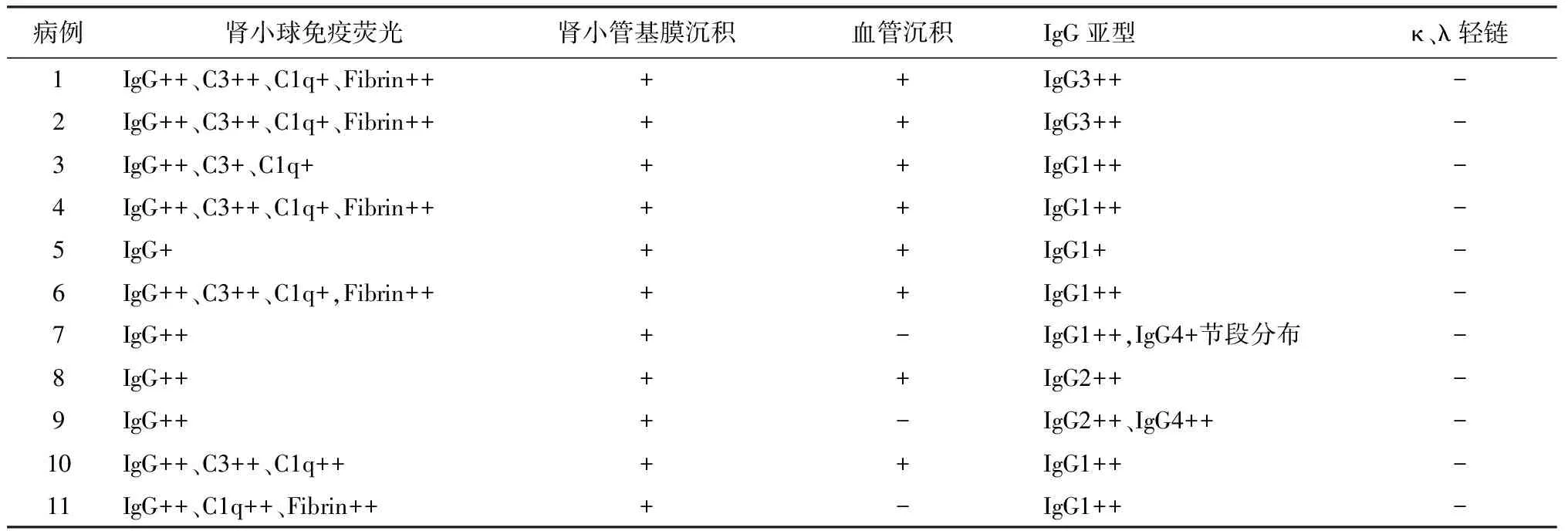
表4 11例患者肾活检免疫病理特点
电镜 11例HCDD患者中有1例电镜取材未见肾小球,仅见肾小管和间质。余10例患者电镜下均见肾小球基膜内侧缘细沙样电子致密物沉积(图2A),8例呈不连续性分布,2例呈弥漫性分布。8例患者系膜区尚见电子致密物沉积,1例系膜区增宽明显,但未见电子致密物,2例患者尚见包囊壁节段电子致密物沉积。9例患者肾小球内皮细胞病变明显,表现为内皮细胞从肾小球基膜剥脱,内皮下区域增宽、疏松,剥脱明显者致袢腔显著狭窄。其中2例见内皮下纤维蛋白分布,部分患者袢内见内皮细胞增生,伴中性粒细胞浸润。11例患者均见部分肾小管基膜外侧细沙样不连续性电子致密物沉积(图2B)。1例患者管周毛细血管壁见电子致密物沉积。

图2 A:肾小球基膜内侧缘见细砂状电子致密物,内皮细胞从肾小球基膜剥脱,足细胞足突融合;B:肾小管基膜外周侧缘见细沙状电子致密物沉积(EM)
随访治疗 11例患者5例失随访,6例患者随访平均时间为15.1±17.3个月,随访中位时间10月(4~50月)。例1患者肾活检后接受雷公藤多苷治疗8月,随后一直用普乐可复1.0~1.5 mg/d治疗42月,SCr 84.86 μmol/L,尿蛋白定量0.9 g/24h,病情缓解。例2随访9月,前8月接受雷公藤多苷治疗无效,改用沙利胺治疗2个疗程,因不良反应明显而停用,最后随访SCr 376 μmol/L,尿蛋白定量7.67 g/24h,病情加重。例3随访问11月,先接受7月雷公藤多苷治疗,后4月改用沙利度胺治疗,随访结束SCr 91.05 μmol/L,尿蛋白定量0.49 g/24h,病情稳定。例9随访12月,接受沙立度胺+地塞米松(TD方案)治疗,随访结束SCr 58.34 μmol/L,尿蛋白定量0.41 g/24h,病情缓解。例10接受硼替佐米+地塞米松(BD方案)治疗5月,SCr 224.54 μmol/L,尿蛋白定量3.33 g/24h,病情加重。例11接受TD方案治疗4月,SCr 127.30 μmol/L,尿蛋白定量2.44 g/24h,病情稳定。随访尿蛋白定量和SCr的变化见图3、4。

图3 6例患者随访中血清肌酐的变化
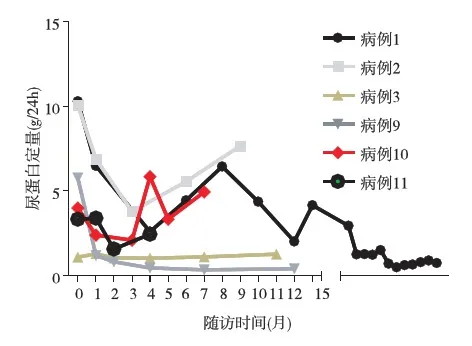
图4 6例患者随访中尿蛋白定量的变化
讨 论
本研究对11例γ型HCDD进行了回顾分析,是目前国内单中心报道HCDD最多的一项研究。我们HCDD占肾活检的比例明显低于LCDD,仅0.02%,低于Nasr等[1]报道HCDD占肾活检比例的0.06%。我国HCDD中年起病多见,平均年龄48岁,低于国外文献报道。Nasr等[1]报道7例HCDD患者平均年龄53岁(29~73岁),Alexander等[2]总结21例γ型HCDD患者,平均年龄54.3岁(35~73岁),5例α型HCDD的平均年龄55岁(29~78岁),1例μ型HCDD的发病年龄为63岁(表5)。本组HCDD患者以女性占多数,Alexander等[2]总结的21例γ型HCDD也以女性发病居多,其中男性8例,女性13例,男∶女为1∶1.63,5例α型HCDD中男性3例,女性2例,男∶女为1.5∶1,而Nasr等[1]报道的7例患者则以男性多见(5例),女性2例,男∶女为2.5∶1。结合本研究及以上提到的包括三种类型的HCDD男女发病比例为20∶25,比值1∶1.25,女性多于男性。

表5 11例患者与文献报道比较
本组HCDD患者临床以肾病范围蛋白尿,高血压、肾功能不全为著,血清补体减低也是其主要特点之一,补体C3减低发生率高于补体C4减低,本组补体C3减低的发生率达81.8%,明显高于国外文献报道的57.8%[2]。文献报道的5例α型和1例μ型HCDD患者中无一例出现低补体血症[2]。本研究还发现本组HCDD患者NAG和RBP均明显升高,这在国外报道的文献中并未提及。
HCDD 患者血液系统损伤明显,贫血发生率高,血清出现异常单克隆条带,部分患者可出现骨髓瘤。本组患者均行骨髓活检,57.1%的患者存在血清免疫球蛋白单克隆条带(均为λ型IgG),但未发现骨髓瘤。Nasr等[1]报道显示86%的患者存在血清免疫球蛋白单克隆条带(3例IgG,1例IgA),7例患者中有2例存在骨髓瘤[1]。Alexander等[2]报道的21例γ型HCDD患者中,66.7%见血清单克隆条带,4例伴骨髓瘤(19.0%),而5例α型HCDD患者均见血清单克隆条带及骨髓瘤。Moulin等[3]报道的4例γ型HCDD患者也均存在单克隆λ型IgG条带,2例骨髓活检证实为骨髓瘤。Herzenberg等[4]报道2例γ型HCDD患者血清未发现单克隆条带,也无骨髓瘤。Soma等[5]报道的1例γ型HCDD患者无血清单克隆免疫球蛋白条带,骨髓活检不支持骨髓瘤。Kambham等[6]报道的1例γ型HCDD也存在单克隆λ型IgG条带,无骨髓瘤。
Nasr等[1]观察4例γ型HCDD患者均存在血κ/λ轻链比值异常,其中3例为比值明显异常,但未列出具体异常值。本研究11例患者中5例存在血κ/λ轻链比值升高,其中明显升高2例,且均为κ值升高。Nasr等[1]的研究还观察到LCDD患者(43例)和LHCDD患者(4例)均存在血κ/λ比值异常[1]。Hassoun等[7]和Kastritis等[8]报道的MIDD患者中均存在血κ/λ比值异常,而在轻链型淀粉样变性的患者发生率仅76%[9],这表明血轻链比值异常是临床提示MIDD的指标之一。血游离轻链升高的亚型常与血清异常单克隆条带的亚型相一致,但也有不少患者并未检测血游离轻链。本组1例患者血清游离轻链κ值明显升高,血清中见λ型IgG单克隆条带。本研究中血轻链检测的是未与重链结合的游离轻链,推测在浆细胞异常产生单克隆免疫球蛋白条带的同时,异常轻链产生也增多,而这种异常增多的轻链不能与免疫球蛋白结合,从而有可能出现血游离轻链κ值与血清中见λ型IgG单克隆条带的不一致现象,其具体机制尚不清楚。
HCDD光镜下结节样病变为著,多数患者肾小球结节呈弥漫性分布,造成肾小球体积增大。本组患者均存在结节病变,只是部分患者肾小球为节段小结节形成。Nasr等[1]报道的患者中87.5%见肾小球病变表现为结节性病变,Alexander等[2]总结的21例γ型HCDD患者中90%的存在结节性病变,5例α型HCDD患者中80%出现结节性病变,1例μ型HCDD也表现为结节性病变。HCDD患者尚见新月体形成,本组患者的发生率为45.6%,Nasr等[1]报道的发生率为14.3%,Alexander等[2]报道21例γ型HCDD患者中发生率14.3%。此外本研究发现多数患者肾小球结节形成后,部分周围袢融合,造成内皮细胞损伤,见内皮细胞从基膜剥脱,至局部见纤维素性渗出。
目前报道的HCDD以γ型为主,少数为α型HCDD,仅见1例μ型HCDD[2]。本研究均为γ型HCDD,IgG沿肾小球基膜和肾小管基膜线样沉积,肾小球系膜区颗粒样沉积,节段沉积于包囊壁。肾组织IgG亚型染色显示多数为单克隆性质,以IgG1最常见(54.5%),其次为IgG3(27.3%),本研究尚见1例IgG1沉积为主同时伴节段IgG4沉积者,IgG2、IgG4同时沉积者1例(经重复染色确认),均呈线样沉积于肾小球基膜和肾小管基膜,电镜下亦见肾小球基膜内侧缘和肾小管基膜外侧缘细沙样颗粒沉积,因此仍考虑HCDD。1993年,Aucouturier等[10]亦报道1例γ型HCDD患者伴IgG1、IgG2及IgG3同时沉积[10]。既往文献报道检测IgG亚型的HCDD共19例,其中7例IgG1(36.8%),2例IgG2(10.5%),4例IgG3(21.1%),6例IgG4(31.6%)[11,12]。 综合文献和本研究,HCDD患者肾组织亚型以IgG1最常见,其次为IgG4。而单克隆IgG沉积的弥漫增生性肾小球肾炎则以IgG3沉积最常见[12-16]。
已有多篇文献报道HCDD患者肾组织CH1染色缺失[3,6,10,17-19]。正常重链转录后在内质网内与重链结合蛋白结合,随后轻链再与之结合,转运至高尔基体,再分泌。如果重链缺乏CH1位点时,不能与重链结合蛋白结合,导致未成熟的重链分泌进入循环中,而CH2、CH3位点缺失,不影响重链与重链结合蛋白的结合。
除光镜下肾小球结节样病变外,电镜下肾小球基膜内侧缘和肾小管基膜外侧缘细沙样电子致密物是诊断HCDD突出且必需的特点。本组10例电镜观察到肾小球的患者均出现系膜区肾小球基膜沉积,Nasr等[2]报道的7例患者也均见系膜区沉积。除上述特点外,本组HCDD患者存在明显的肾小球内皮细胞病变,内皮细胞从肾小球基膜剥脱,内皮下区域增宽、疏松,类似于血栓性微血管病变(TMA)样的内皮细胞损伤,但间质动脉未见TMA样病变。
综上所述,HCDD临床较少见,多见于中年女性,临床表现为蛋白尿、高血压、肾功能不全及低补体血症,常伴血清异常的单克隆条带,肾脏病理主要见肾小球结节性病变,以γ型、IgG1亚型沉积最常见。因此,光镜下结节性病变突出的患者应通过免疫病理轻链、重链染色和电镜检查排除HCDD。诊断后及随访过程中须监测血、尿轻链和免疫固定电泳,必要时行骨髓活检,以明确是否出现骨髓瘤。
1 Nasr SH,Valeri AM,Cornell LD,et al.Renal monoclonal immunoglobulin deposition disease:a report of 64 patients from a single institution.Clin J Am Soc Nephrol,2012,7(2):231-239.
2 Alexander MP,Nasr SH,Watson DC,et al.Renal crescentic alpha heavy chain deposition disease:a report of 3 cases and review of the literature.Am J Kidney Dis,2011,58(4):621-625.
3 Moulin B,Deret S,Mariette X,et al.Nodular glomerulosclerosis with deposition of monoclonal immunoglobulin heavy chains lacking C(H)1.J Am Soc Nephrol,1999,10(3):519-528.
4 Herzenberg AM,Kiaii M,Magil AB.Heavy chain deposition disease:recurrence in a renal transplant and report of IgG(2) subtype.Am J Kidney Dis,2000,35(5):E25.
5 Soma J,Sato K,Sakuma T,et al.Immunoglobulin gamma3-heavy-chain deposition disease:report of a case and relationship with hypocomplementemia.Am J Kidney Dis,2004,43(1):E10-16.
6 Kambham N,Markowitz GS,Appel GB,et al.Heavy chain deposition disease:the disease spectrum.Am J Kidney Dis,1999,33(5):954-962.
7 Hassoun H,Flombaum C,D'Agati VD,et al.High-dose melphalan and auto-SCT in patients with monoclonal Ig deposition disease.Bone Marrow Transplant,2008,42(6):405-412.
8 Kastritis E,Migkou M,Gavriatopoulou M,et al.Treatment of light chain deposition disease with bortezomib and dexamethasone.Haematologica,2009,94(2):300-302.
9 Palladini G,Russo P,Bosoni T,et al.Identification of amyloidogenic light chains requires the combination of serum-free light chain assay with immunofixation of serum and urine.Clin Chem,2009,55(3):499-504.
10 Aucouturier P,Khamlichi AA,Touchard G,et al.Brief report:heavy-chain deposition disease.N Engl J Med,1993,329(19):1389-1393.
11 Oe Y,Nakaya I,Yahata M,et al.A case of gamma1-heavy chain deposition disease successfully treated with melphalan and prednisolone therapy.Intern Med,2010,49(14):1411-1415.
12 曾彩虹,陈浩,范芸,等.单克隆IgG沉积的增生性肾小球肾炎.肾脏病与透析肾移植杂志,2012,21(5):401-407.
13 Nasr SH,Satoskar A,Markowitz GS,et al.Proliferative glomerulonephritis with monoclonal IgG deposits.J Am Soc Nephrol,2009,20(9):2055-2064.
14 Masai R,Wakui H,Komatsuda A,et al.Characteristics of proliferative glomerulo-nephritis with monoclonal IgG deposits associated with membranoproliferative features.Clin Nephrol,2009,72(1):46-54.
15 Albawardi A,Satoskar A,Von Visger J,et al.Proliferative glomerulonephritis with monoclonal IgG deposits recurs or may develop de novo in kidney allografts.Am J Kidney Dis,2011,58(2):276-281.
16 Guiard E,Karras A,Plaisier E,et al.Patterns of noncryoglobulinemic glomerulonephritis with monoclonal Ig deposits:correlation with IgG subclass and response to rituximab.Clin J Am Soc Nephrol,2011,6(7):1609-1616.
17 Hendershot L,Bole D,Köhler G,et al.Assembly and secretion of heavy chains that do not associate posttranslationally with immunoglobulin heavy chain-binding protein.J Cell Biol,1987,104(3):761-767.
18 Lin J,Markowitz GS,Valeri AM,et al.Renal monoclonal immunoglobulin deposition disease:the disease spectrum.J Am Soc Nephrol,2001,12(7):1482-1492.
19 Yasuda T,Fujita K,Imai H,et al.Gamma-heavy chain deposition disease showing nodular glomerulosclerosis.Clin Nephrol,1995,44(6):394-399.