评估血液透析患者容量状态方法的进展
迄今为止,心血管并发症仍是维持性血液透析(MHD)患者主要的死亡原因[1]。除吸烟、原发性高血压、糖尿病、高血脂等传统心血管疾病危险因素外,尿毒症相关危险因素(如容量超负荷继发的高血压、贫血、慢性炎症状态、营养不良及钙磷代谢异常导致的血管钙化等)亦是MHD患者高死亡率的原因[2]。因此,准确地评估血液透析(HD)患者的容量状态,将患者的体重控制在目标干体重,对提高透析效果、防止并发症至关重要。本文就目前国内外评估HD患者容量状态的方法作一综述。
干体重的定义
干体重的定义随着时间推移不断变化。1967年,Thomson等[3]率先把干体重定义为超滤过程中在无其他因素干扰下血压降至低血压水平(即平均动脉压较透析前下降30 mmHg以上,或收缩压降至90 mmHg以下)。1980年,Henderson把干体重定义为规律透析的患者低于该体重并出现休克症状[4]。1996年,Charra等[5]把干体重定义为透析后在不服降压药的情况下血压维持正常水平。2009年,Sinha和Aagarwal[6]提出要结合主观症状和客观指标来评估干体重,因此将干体重定义为无低容量或高容量相关症状时患者最低能耐受的体重。
干体重及容量状态的评估
HD早期,人们通常依靠临床观察凭经验估计患者干体重,如观察有无肺部湿啰音、肢端及颜面有无水肿及体重变化等。这些方法简便易行,但可靠性差。Agarwal等[7]的病例对照研究发现,腔静脉直径、血容量监测、血浆容量标志物、炎症标志物与水肿无关。踝部水肿与心血管危险因素(如年龄、肥胖、左心室容积)相关,但这些均非反应HD患者容量的标志。目前用于评估容量状态的方法见表 1。
示踪剂法放射性同位素氘和氚稀释法最早用于总体水容积(TBW)的测量,溴化物、菊糖、亚铁氰化物、氯化物及蔗糖稀释法用于测量细胞外液量(ECV)[8]。此方法的原理是示踪剂在一个腔室内均匀分布,腔室的容量=示踪剂总量/浓度(实际使用时,这个等式需加上校正系数)[9]。稀释法是评估容量状态的金标准,然而不同的示踪剂估计的ECV却不同[10]。如以蔗糖在体内分布为标准,则其他示踪剂的相对量如溴化物为1.19倍,钠为1.41倍,氯化物为1.36倍[8]。如以菊糖为标准测量ECV,则其他示踪剂的相对量如氯化物为1.51倍、亚铁氰化物为1.28倍、溴化物为1.57倍。溴化物、钠、氯化物和亚铁氰化物分布容积相似,但高于菊糖及蔗糖的分布容积[11],原因可能是溴化物、钠、氯化物等能进入细胞内[12],可能增加估算的ECV量,而菊糖及蔗糖可通过肾脏快速从细胞外液清除[13]。因此,尚没有一种示踪剂能精确的评估细胞外液量。由于口服溴化物后能快速(2h内)在体液内达浓度平衡,且给药方便,目前此法广泛应用于临床。然而,需注意示踪剂法虽能精确评估液体总量,但不能评估容量状态。
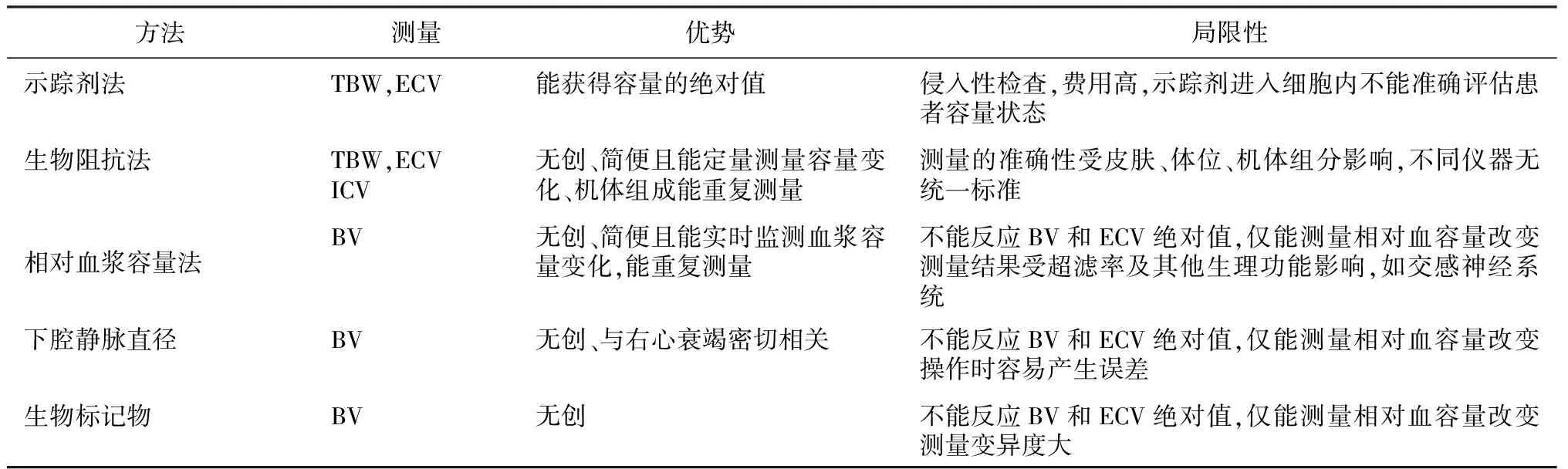
表1 评估容量状态的方法
生物阻抗法Thomasset[14]最早提出用生物电阻抗法评估TBW。生物体内低频(≤5 kHz)电流仅能通过细胞外液,而高频电流能通过细胞外液及细胞内液。理想状态下,假设机体是一个圆柱体且电传导性相等,电阻(R)与体长(L)成正比、与横截面积(A)成反比,则R=ρ*L/A、容量V=A*L=ρL2/R。1970年以来多使用单频生物阻抗法建立模型,1990年后开始采用多频生物阻抗建立更复杂的模型,称为多频生物电阻抗分析法[15]。
单频生物阻抗分析法 单频生物电阻抗分析法是最常使用的测量人体成分的方法,它利用500 μA~800 μA 的电流,50 kHz的频率来测量身体内的电阻抗程度。1990年以前,单频生物电阻抗法(如50 kHz或100 kHz)只是用来测量脂肪重量和瘦体重,所谓瘦体重是指除脂肪外身体其他成分的重量(瘦体重=体重-脂肪重量)[16]。随后,单频生物电阻抗法用来评价儿童、老年人、不同疾病状态患者的TBW,同位素稀释法的研究也证明这种方法准确且有效。
值得注意的是,环境和受试者自身因素可能会影响这种测量方法的可信度和精确度。影响因素包括电极放置的位置、皮肤温度、皮肤血管的血流速度、身体的姿势、近期摄入的液体量、摄入液体的组成、运动、血浆渗透压或血浆中钠浓度的改变[17]。
近年来,常用50kHz的单频生物电阻抗评估HD患者的容量状态,生物电阻抗的改变与HD患者的超滤率成正比,帮助患者达到目标干体重从而改善预后[18]。
多频生物阻抗分析法 19世纪90年代,理论提高和技术改进可以在不同频率下连续快速地全身扫描,得到阻抗值。多频生物电阻抗分析法是一种在一定频率范围内,利用高频(100~800 kHz)和低频(1~5 kHz)交流电测得阻抗值来推算出TBW和ECW的统计方法。确定TBW 和ECW 的数值之后,ICV也可通过计算得出。在体液测量的研究中,这种方法逐渐替代单频生物电阻抗分析法,因为多频生物电阻抗分析法可以分别测量出TBW、ECW、ICW。多频生物电阻抗分析法已经使用同位素稀释技术作为参考标准,证明其是有效而准确的[16,19]。
与单频生物电阻抗分析法一样,如果测量的方法不准确,则可能影响多频生物电阻抗分析法的可靠性和准确性[14]。研究表明改变姿势(如把手从臀部举起到头顶)、脱水、摄取不同渗透压的液体会影响多频生物电阻抗分析法测量的准确性[14]。控制上述因素后, 一个70 kg重的成人的TBW 测量误差的范围是3.5%~6.9%[16]。尽管这些变化可能使多频生物电阻抗分析法不能测量出饮食摄入或流汗时TBW、ECW和ICW 的微小变化。但去除上述影响因素,多频生物电阻抗分析法是测量身体水分的一种有效的临床研究工具。
使用这一方法评估HD患者的容量状态能较好的控制血压(收缩压下降25 mmHg),透析间期不良反应下降73%[20]。然而,由于机体各部分电阻率并不一致,多频生物电阻抗分析法测量不精确。整体阻抗改变与容量变化并不成比例[21],机体容量过多或体重过大的患者差异则更大[22]。
相对血容量监测法相对血容量(RPV)监测是通过光学感受器无创测量HD过程中患者红细胞压积或总蛋白含量的变化,对不同血压水平的HD患者进行无创、实时的RPV监测,以了解患者RBV的变化规律,并根据其变化规律进行适当临床干预。容量较多的患者HD过程中血浆再充盈很快,因此RPV曲线平直;相反,容量少的患者RPV曲线较陡、更接近干体重。
Sinha等[23]应用RPV监测透析高血压患者减少干体重的研究(DRIP)发现,RPV斜率对容量超负荷有提示意义:(1)体重下降时曲线斜率也下降;(2)曲线的基线水平较平直的体重下降较多;(3)RPV斜率改变与体重下降密切相关;(4)RPV能预测患者透析间期收缩压,RPV平直者血压下降较多。因此,RPV监测评估高血压透析患者的干体重是有意义的,能帮助患者获得最佳容量状态同时减少透析相关死亡率[24]。
Wabel等[25]在欧洲8个透析中心通过阻抗分析和透析前收缩压评估500例患者机体组分容量状态。其中1/3的患者血压和容量状态正常,15%的患者存在高血压和容量超负荷,13%的患者血压升高但无容量超负荷,血压正常的容量负荷过多者占10%。研究将高血压分为容量依赖性和非容量依耐性,为个体化治疗提供依据。
下腔静脉直径血管内容量增加可导致静脉充盈增加、下腔静脉直径扩大。因此,可以利用超声测量下腔静脉直径评估容量状态[26]。Tetsuka等[27]研究发现呼气时下腔静脉直径(IVCDe)的改变与循环血容量(CBV)显著相关。Voroneanu等[28]将IVCD测量与全身阻抗测量法比较测量细胞外液容量,发现IVCD测量法阳性率为18%,敏感度67%,假阴性45%。IVCD测量法的局限性为其用超声测量有一定的主观性,受患者并发症(如心功能不全)和状态(如胸积气)影响,因此不适合用于HD患者。
生物标记物-脑钠肽proBNP由心肌细胞产生,分解后产生32个氨基酸的BNP(活性产物)和76个氨基酸的NT-proBNP(非活性产物)[29]。BNP与左心室容量及左心功能障碍密切相关,是评估容量状态的标志物之一,是能较好诊断及判断心力衰竭严重程度的心肌标记物。但是,在HD患者中并不能准确的反应细胞外液状态,因为心脏扩大与细胞外液量相关性不大。在横断面研究中,HD患者BNP和ECV/TBW相关性不大[30],血压下降与BNP没有明显相关性[31]。Van de Pol等[32]发现在HD超滤过程中pro-BNP无明显下降。
小结:干体重状态对终末期肾病患者减轻心脏的压力及容量负荷、阻止心肌细胞重塑,降低心血管不良事件的发生率有益。Kraemer等[33]比较了IVCD、相对血容量改变及生物电阻抗与超滤量的相关性,BIS的误差(0.87±0.64 kg)较其他方法小(IVCD 1.74±1.56 kg,RBV 2.3±1.0 kg)。同位素稀释法需专业技术人员,耗时长,测量成本高,生物标记物及IVCD法均不能直接反应细胞外液量,相对血容量监测虽能反应患者对容量下降的耐受程度,但也不能反应细胞外液状态,这些方法的比较说明生物电阻抗法是目前评估HD患者容量状态的最佳方法,具有成本低、安全无创、快速、准确等特点。联合应用BIS、RBV及BNP监测可以帮助HD患者达到干体重且能减少透析中低血压的发生率。
1 Locatelli F,Marcelli D,Conte F,et al.Cardiovascular disease in chronic renal failure: the challenge continues.Registro Lombardo Dialisi e Trapianto.Nephrol Dial Transplant,2000,15(Suppl 5):69-80.
2 Longenecker JC,Coresh J,Powe NR,et al.Traditional cardiovascular disease risk factors in dialysis patients compared with the general population: the CHOICE Study.J Am Soc Nephrol,2002,13(7):1918-1927.
3 Thomson GE,Waterhouse K,McDonald HP Jr,et al.Hemodialysis for chronic renal failure.Clinical observations.Arch Intern Med,1967,120(2):153-167.
4 Henderson LW.Symptomatic hypotension during hemodialysis.Kidney Int,1980,17(5):571-576.
5 Charra B,Laurent G,Chazot C,et al.Clinical assessment of dry weight.Nephrol Dial Transplant,1996,11(Suppl 2):16-19.
6 Sinha AD,Agarwal R.Can chronic volume overload be recognized and prevented in hemodialysis patients?The pitfalls of the clinical examination in assessing volume status.Semin Dial,2009,22(5):480-482.
7 Agarwal R,Andersen MJ,Pratt JH.On the importance of pedal edema in hemodialysis patients.Clin J Am Soc Nephrol,2008,3(1):153-158.
8 Gamble JL Jr,Robertson JS,Hannigan CA,et al.Chloride,bromide,sodium,and sucrose spaces in man.J Clin Invest,1953,32(6):483-489.
9 Ellis KJ.Human body composition: in vivo methods.Physiol Rev,2000,80(2):649-680.
10 Epstein FH,Kleeman CR,Rubini ME,et al.Effect of changes in extracellular fluid volume upon the volumes of distribution of ferrocyanide and inulin.Am J Physiol,1955,182(3):553-556.
11 Deane N,Schreiner GE,Robertson JS.The velocity of distribution of sucrose between plasma and interstitial fluid,with reference to the use of sucrose for the measurement or extracellular fluid in man.J Clin Invest,1951,30(12:2):1463-1468.
12 Cousins C,Skehan SJ,Rolph SM,et al.Comparative microvascular exchange kinetics of [(77)Br]bromide and (99m)Tc-DTPA in humans.Eur J Nucl Med Mol Imaging,2002,29(5):655-662.
13 Lavietes PH,Bourdillon J,Klinghoffer KA.The volume of the extracellular fluids of the body.J Clin Invest,1936,15(3):261-268.
14 Thomasset A.Bio-electric properties of tissues.Estimation by measurement of impedance of extracellular ionic strength and intracellular ionic strength in the clinic.Lyon Med,1963,209:1325-1350.
15 De Lorenzo A,Andreoli A,Matthie J,et al.Predicting body cell mass with bioimpedance by using theoretical methods: a technological review.J Appl Physiol,1997,82(5):1542-1558.
16 Hannan WJ,Cowen SJ,Fearon KC,et al.Evaluation of multi-frequency bio-impedance analysis for the assessment of extracellular and total body water in surgical patients.Clin Sci (Lond),1994,86(4):479-485.
17 Zhu F,Kuhlmann MK,Kaysen GA,et al.Segment-specific resistivity improves body fluid volume estimates from bioimpedance spectroscopy in hemodialysis patients.J Appl Physiol,2006,100(2):717-724.
18 Dou Y,Cheng X,Liu L,et al.Development and validation of a new dry weight estimation method using single frequency bioimpedance in hemodialysis patients.Blood Purif,2011,32(4):278-285.
19 Cornish BH,Ward LC,Thomas BJ,et al.Evaluation of multiple frequency bioelectrical impedance and Cole-Cole analysis for the assessment of body water volumes in healthy humans.Eur J Clin Nutr,1996,50(3):159-164.
20 Machek P,Jirka T,Moissl U,et al.Guided optimization of fluid status in haemodialysis patients.Nephrol Dial Transplant,2010,25(2):538-544.
21 Zhu F,Schneditz D,Wang E,et al.Dynamics of segmental extracellular volumes during changes in body position by bioimpedance analysis.J Appl Physiol,1998,85(2):497-504.
22 Carter M,Morris AT,Zhu F,et al.Effect of body mass index (BMI) on estimation of extracellular volume (ECV) in hemodialysis (HD) patients using segmental and whole body bioimpedance analysis.Physiol Meas,2005,26(2):S93-S99.
23 Sinha AD,Light RP,Agarwal R.Relative plasma volume monitoring during hemodialysis AIDS the assessment of dry weight.Hypertension,2010,55(2):305-311.
24 Rodriguez HJ,Domenici R,Diroll A,et al.Assessment of dry weight by monitoring changes in blood volume during hemodialysis using Crit-Line.Kidney Int,2005,68(2):854-861.
25 Wabel P,Moissl U,Chamney P,et al.Towards improved cardiovascular management: the necessity of combining blood pressure and fluid overload.Nephrol Dial Transplant,2008,23(9):2965-2971.
26 Mandelbaum A,Ritz E.Vena cava diameter measurement for estimation of dry weight in haemodialysis patients.Nephrol Dial Transplant,1996,11(Suppl 2):24-27.
27 Tetsuka T,Ando Y,Ono S,et al.Change in inferior vena caval diameter detected by ultrasonography during and after hemodialysis.ASAIO J,1995,41(1):105-110.
28 Voroneanu L,Cusai C,Hogas S,et al.The relationship between chronic volume overload and elevated blood pressure in hemodialysis patients: use of bioimpedance provides a different perspective from echocardiography and biomarker methodologies.Int Urol Nephrol,2010,42(3):789-797.
29 Hall C.Essential biochemistry and physiology of (NT-pro)BNP.Eur J Heart Fail,2004,6(3):257-260.
30 Lee SW,Song JH,Kim GA,et al.Plasma brain natriuretic peptide concentration on assessment of hydration status in hemodialysis patient.Am J Kidney Dis,2003.41(6):1257-1266.
31 Matayoshi T,Kato T,Nakahama H,et al.Brain natriuretic peptide in hemodialysis patients: predictive value for hemodynamic change during hemodialysis and cardiac function.Am J Nephrol,2008,28(1):122-127.
32 van de Pol AC,Frenken LA,Moret K,et al.An evaluation of blood volume changes during ultrafiltration pulses and natriuretic peptides in the assessment of dry weight in hemodialysis patients.Hemodial Int,2007,11(1):51-61.
33 Kraemer M,Rode C,Wizemann V.Detection limit of methods to assess fluid status changes in dialysis patients.Kidney Int,2006,69(9):1609-1620.