肾移植患者个体化免疫诱导治疗方案的临床评价
肾移植受者的免疫耐受状态和移植肾长期存活是移植领域长期追求的目标。抗体免疫诱导已有30余年的历史[1],其临床应用已远远超出抗排斥反应治疗的研制初衷。随着生物学技术的不断发展、成熟及对急性排斥反应与移植物长期存活关系的深入研究,近年来抗体免疫诱导治疗越来越广泛,临床上取得了较好的效果,但不同抗体类生物制剂的使用时机、方法、剂量、不良反应及效果评价等还存在争议。本研究对照观察了应用兔抗人T淋巴细胞免疫球蛋白(ATG-F)、巴利昔单抗(Basiliximab)免疫诱导及未用抗体免疫诱导的肾移植受者,并评估不同治疗方案的疗效及安全性,旨在为个体化应用抗体类生物制剂进行肾移植免疫诱导治疗提供依据。
对象和方法
对象与分组纳入2006年1月至2011年12月期间河南中医学院第一附属医院肾移植科的肾移植受者381例,根据免疫诱导情况分为3组,其中ATG-F组179例,Basiliximab组124例,78例未接受免疫诱导治疗者为对照组。
ATG-F组诱导纳入标准 (1)存在高免疫学危险因素的受者,包括群体反应性抗体(PRA)阳性(>10%)、白细胞抗原(HLA)错配率高、免疫系统疾病导致的肾衰竭、再次或多次移植;(2)接受边缘供肾者,如高龄、冷缺血和热缺血时间长的供肾者;(3)接受心脏死亡器官捐献(DCD)供肾者;(4)无其他严重疾病。
Basiliximab组诱导纳入标准 (1)受者有伴随症时,如肝脏疾病、糖尿病等,需要减少常规免疫抑制剂剂量;(2)发生排斥反应耐受性差的特殊受者群体,如儿童、高龄受者;(3)各种原因需要降低常规免疫抑制剂剂量及准备采用早期撤除激素方案者;(4)术前曾发生过呼吸道、泌尿系感染且已治愈者。
未免疫诱导纳入标准 (1)供受者间无血缘关系,但HLA错配3个位点以下,且PRA<10%、淋巴细胞毒(CDC)<5%;(2)直系亲属活体间肾移植;虎家庭经济拮据,拒绝行免疫诱导治疗;(3)体质不能耐受抗体类生物制剂者。
所有受者及家属对治疗方案均完全知情同意,在充分了解本治疗方案的前提下签署知情同意书;治疗方案得到医院器官移植伦理委员会批准。
一般资料381例肾移植受者中,男227例,女154例,平均年龄41.58±10.14岁(14~72岁);尸体供肾移植239例,亲属活体肾移植142例;二次肾移植20例,余均为首次肾移植;PRA>10%者15例;CDC均<5%;术后随访时间3.6±2.2年。所有受者资料均来自河南中医学院第一附属医院肾移植随访登记系统。
方法
免疫诱导方案 (1) ATG-F组:根据受者的年龄、体重、体质状况及免疫状态,术中及术后静脉滴注ATG-F 0.75~1.5 mg/(kg·d),连用3~10d;(2)Basiliximab组:术前及术后第4天分别静脉滴注Basiliximab 20 mg;(3)对照组:不用任何生物制剂。
免疫诱导及免疫抑制治疗方案 所有肾移植受者术后均联合环孢素A(CsA)/他克莫司(FK506)+吗替麦考酚酯(MMF)/麦考酚钠肠溶片(EC-MPS)+激素(Pred)三联免疫抑制方案,其中CsA起始剂量为5~6 mg/(kg·d),FK506起始剂量为0.1~0.15 mg/(kg·d),以后根据血浓度调整CsA或FK506用量;维持MMF 1.5 g/d或EC-MPS 1080 mg/d;术中和术后3天应用甲泼尼龙6~8 mg/(kg·d),第4天起改口服Pred 15~20 mg/d,术后6月减至5 mg/d维持。
生化指标测定 所有受者检测血常规、肝功能、肾功能、血脂、血糖、电解质、供受者HLA、PRA、CDC及CsA或FK506血药浓度等。
观察内容 不同时间点肾功能变化与移植肾功能延迟恢复(DGF)、移植肾功能缓慢恢复(SGF)、急性排斥反应(AR)的发生率,移植人/肾存活率及术后并发症情况等。
判断标准 肾功能恢复正常的标准为血清肌酐(SCr)<140 μmol/L,尿量 1 500~3 000 ml/d;DGF定义为肾移植术后1周内SCr>400 μmol/L,至少行1次血液透析治疗,并排除超急性排斥、尿路梗阻、尿瘘、肾动静脉血管阻塞及急性CsA/FK506中毒等因素;SGF是指肾移植术后1周内SCr缓慢下降,但未达正常水平;AR的诊断依据临床表现、超声影像学检查及Banff 97病理学诊断标准[2];移植肾存活是指除移植肾功能丧失外肾功能良好且受者存活;移植肾功能丧失定义为回归透析治疗或移植肾切除。
统计学分析采用SPSS 19.0统计软件进行统计分析。定量结果以均数±标准差表示,计数资料的比较采用两样本均数的t检验。P<0.05为差异有统计学意义。
结 果
三组受者一般情况比较本研究共纳入381例受者,均随访1年以上,最长达7年,无中途退出者,全部进入结果分析。三组受者在性别、年龄、CDC、供肾冷缺血时间等方面均无统计学差异意义;ATG-F组在供肾热缺血时间、HLA错配数、PRA等方面均高于其他组,差异均有显著性意义(表1)。

表1 三组患者一般情况比较
免疫诱导与SCr的关系对照组受者在随访的每个时间点上SCr水平均高于免疫诱导组,多因素多组数值变量比较,差异均具有统计学意义;免疫诱导受者组间比较,无统计学差异(表2)。

表2 受者的免疫诱导时间与血清肌酐
术后发生DGF、SGF及AR的比较结果应用ATG-F诱导治疗的受者术后DGF、SGF及6月内AR的发生率略低于Basiliximab组,但差异均无统计学意义;而对照组与ATG-F组、Basiliximab组相比,均具有显著的统计学差异(表3)。
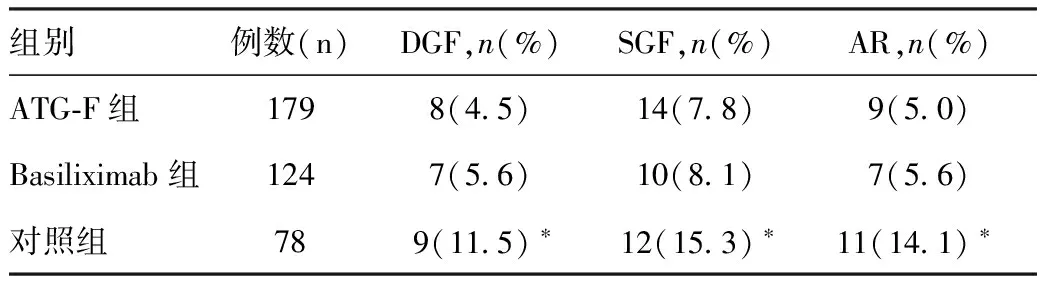
表3 三组受者术后DGF、SGF及AR的发生情况
肾移植术后12月移植人/肾存活情况ATG-F组有1例二次肾移植且PRA阳性的受者在术中开放血流后即发生超急性排斥反应,摘除移植肾,余380例肾移植手术均获成功。随访期间,对照组受者术后12月移植人/肾存活率均显著低于免疫诱导治疗组(P<0.05);ATG-F组与Basiliximab组比较,差异均无统计学意义(表4)。
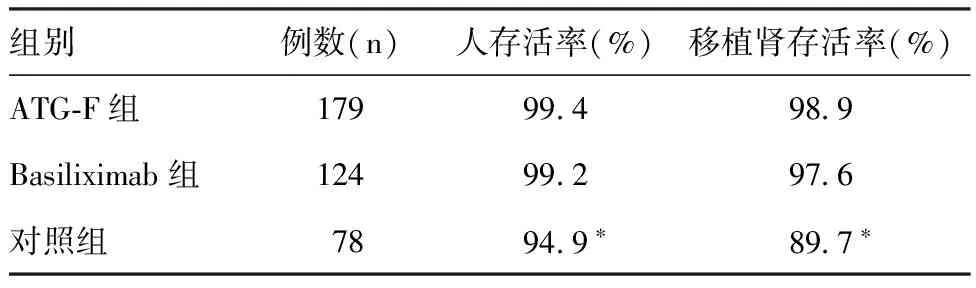
表4 三组术后12月移植人/肾存活率比较
术后并发症ATG-F组与Basiliximab组受者的肺部感染发生率稍高于对照组,但三组间比较差异无统计学意义,经积极治疗,所有肺部感染受者均临床治愈;术后1~3月白细胞降低、血小板减少的受者,组间比较无显著差异(P>0.05),分别皮下注射重组人粒细胞刺激因子(150~200 U/次)、重组人血小板生成素(15 000 U/次)2~3次后恢复;消化道反应(腹胀、腹泻、胃肠反流等)的受者,亦无显著的统计学差异,经对症处理均好转或治愈;除ATG-F组有1例出现发热(体温38.5℃)、皮疹,经及时抗过敏治疗后症状消失,未中断治疗,余均无过敏反应发生(表5)。

表5 三组受者术后发生并发症的比较
讨 论
目前,影响器官移植发展的因素除供体来源严重短缺这个全球性难题外,移植免疫排斥仍是移植受者的主要威胁。器官移植的免疫抑制治疗包括诱导治疗、维持治疗及挽救性治疗。诱导治疗是移植术前或术后应用强效抗体类生物性免疫抑制剂在抗原递呈阶段清除或调节T淋巴细胞反应,以期达到阻断或减轻排斥反应并减少免疫抑制剂用量的目的。当前心脏移植、肝移植、胰腺移植中接受诱导治疗的比例分别达72%、61%和77%[3]。改善全球肾脏病预后组织(KDIGO)指南推荐将诱导治疗纳入肾移植后的初始免疫治疗方案[4]。20世纪60年代末多克隆抗体和80年代单克隆抗体问世以来,经过数十年的研究,目前多克隆抗体、单克隆抗体免疫诱导剂已被广泛应用于临床。理想的免疫抑制剂应具备免疫抑制的高效性、高选择性和高可靠性[5],如何合理应用抗体类生物制剂进行免疫诱导治疗已成为当今移植领域的研究热点之一。
既往研究结果表明,多克隆抗体ATG-F有以下作用:(1)延迟首次急性排斥反应,或使排斥反应减轻,病理变化较易逆转;(2)增加有功能移植肾的存活,尤其对HLA错配率高的受者有益;(3)可减少钙调神经蛋白抑制剂(CNI)及糖皮质激素的剂量,从而减少药物的肾毒性[6-11]。本研究结果显示,ATG-F显著降低了肾移植术后6月AR的发生,同时DGF、SGF的发生率明显低于未接受抗体诱导者,提示在器官匮乏的情况下,应用ATG-F进行免疫诱导治疗对提高肾移植的成功率是十分必要的,尤其是存在超敏状态和多次移植的受者,应用ATG-F比单克隆抗体更具优越性,这与文献报道一致[12]。而对身体状况一般的受者,选择小剂量ATG-F[0.75 mg/(kg·d)]进行诱导治疗,疗程3~5d;对于多次移植及高免疫学危险因素的受者,应用中等剂量ATG-F[1 mg/(kg·d)]治疗5~7d;对移植后存在亚临床排斥反应和被DGF掩盖的AR受者,则予较大剂量ATG-F[1.5 mg/(kg·d)]维持7~10d。对于清除性抗体ATG-F的应用,既不能排斥,又不能盲目采用,应根据受者的个体差异,有区别地选择使用时机、剂量及疗程,既发挥强有力的防治排斥作用,又要最大限度的避免其不良反应,尤其对高危受者利多弊少,是一种有效可行的免疫诱导措施。
单克隆抗体的代表药物Basiliximab直接针对淋巴细胞表面白细胞介素2受体(IL-2R)分子链,除了可以更加准确和特异地发挥其药理作用外,还使其毒副作用也相应的更小。近来有临床试验显示,Basiliximab对预防肾移植术后急性排斥反应具有明显效果[13,14]。因此,器官移植指南中将Basiliximab推荐为诱导治疗的首选制剂[15]。本研究表明,Basiliximab组DGF、SGF、AR的发生率及术后12月内SCr变化、移植人/肾的存活率等显著优于对照组,而与ATG-F组相当,不仅进一步证实该方案可有效防治肾移植术后早期排斥反应,使移植肾维持在良好的功能状态,而且还提示Basiliximab因效应的高度特异性而更具更优越的免疫抑制功效,并明显减少了临床并发症,具有很好的安全性和耐受性,为肾移植提供了一条比较理想的治疗途径,尤其是体质弱、耐受力较差、高龄及移植前发生过感染受者的首选。
个体化的肾移植免疫诱导,首先要考虑移植受者的一般情况、免疫状态及经济状况等诸多因素,权衡不同的抗体类生物制剂的量效关系,制定合理的免疫诱导方案;同时还要根据不同的诱导治疗情况,个体化的选择免疫抑制药物及剂量,如应用ATG-F或Basiliximab诱导者,可维持相对较低的CNI血药浓度,并酌情减少使用激素的时间和剂量,不仅能有效地控制急性排斥事件的发生,提供早期的免疫抑制覆盖治疗,而且能减少具有肾毒性的CNI的用量及激素的不良反应,有利于促进移植肾的功能早期恢复和长期稳定[16]。
免疫诱导降低了肾移植受者免疫敏感性,同时本研究观察到ATG-F和Basiliximab诱导治疗无论早期还是晚期感染均与对照组相近,显示了个体化的诱导治疗方案具有良好的安全性,这可能与术后早期使用抗病毒药物有关。Brennan等[17]的研究也证实,对应用ATG-F或Basiliximab诱导治疗的肾移植受者,采用抗病毒感染的预防治疗后,感染的发生率无明显升高。然而本研究中仍有少数移植受者出现感染及血液系统、消化系统等并发症,虽经治疗均好转或痊愈,但提示免疫诱导仍有一定风险,且剂量过大会导致上述不良反应的增加,这提醒我们在术前选择药物时,要严格遵守适应证和禁忌证。尤其对既往使用同类制剂发生过严重的并发症及存在严重感染的受者要谨慎,尽可能减少抗体类生物制剂可能带来的不良反应。
小结:免疫诱导是“双刃剑”,其优势在于显著减少AR发生率,提高移植人/肾的存活率,安全、有效的抗体类生物制剂使肾移植受者受益,但免疫抑制过度易诱发感染等并发症。因此,在进行免疫诱导治疗时,要根据供肾情况及受者年龄、体质和免疫状态,综合评价不同抗体类生物制剂的疗效和安全性,避免和预防相关并发症,提倡个体化选择免疫诱导制剂,合理制定免疫抑制方案,以期发挥最佳临床效果。虽然我们的研究提示个体化的应用ATG-F或Basiliximab诱导治疗具有优越性,但仍有待于进一步研究免疫诱导对移植人/肾远期存活的影响,开展大规模的前瞻性、对照研究。
1 Golshayan D, Pascual M. Tolerance-inducing immunosuppressive strategies in clinical transplantation: an overview. Drugs, 2008, 68(15):2113-2130.
2 Racusen LC, Solez K, Colvin RB, et al. The Banff 97 working classification of renal allograft pathology. Kidney Int, 1999, 55(2): 713-723.
3 Cai J, Terasaki PI. Induction immunosuppression improves long-term graft and patients outcome in organ transplantation: A analysis of United Network for Organ sharing Registry Data. Transplantation,2010,90(12):1511-1515.
4 Kidney Disease:Improving Global Outcomes(KDIGO) Transplant Work Group. KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Transplant,2009,9 (Suppl 3):S1-S155.
5 Delves PJ, Roitt IM. The immune system. Second of two Parts. N Engl J Med,2000,343(2):108-117.
6 Nikolov ski M, Kotsev Iu, Dimitrov S, et al. The role of polyclonal anti-T-lymphocyte antibodies (ATG) in the kidney transplantation. Khirurgiia (Sofiia),2004, 60(4-5):42-45.
7 Kaihara S, Okamoto M, Akioka K, et al. Improved graft survival in ABO-incompatible living donor kidney transplantation. Transplant Proc,2005,37(4):1804-1805.
8 Kuypers DR, Malaise J, Claes K, et al. Secondary effects of immunosuppressive drugs after simultaneous pancreas-kidney transplantation. Nephrol Dial Transplant,2005,20(Suppl2): ii33-39,ii62.
9 Koga A, Moreso F J, Seron D, et al. Beneficial effect of concomitant induction with antilymphoblast globulin, cyclosporine, and steroids on long-term renal allograft outcome. Transplant Proc, 2004, 36 (5):1305-1307.
10 González Molina M,Molina M,Cabello M, et al. Effectof the immuno suppressive treatment on long-term renal graft survival. Nephrol Dial Transplant,2004,19(Suppl 3):iii52-56.
11 Mourad G, Rostaing L, Legendre C, et al. Sequential protocols using basiliximab versus antithymocyte globulins in renal-transplant patients receiving my cophenolate mofetil and steroids.Transplantation,2004,78(4):584-590.
12 Gill J, Sampaio M, Gill JS, et al. Induction immunosuppressive therapy in the elderly kidney transplant recipient in the United States. Clin J Am Soc Nephrol,2011,6 (5): 1168-1178.
13 Brennan DC. Long-term trends in allograft survival. Adv Chronic Kidney Dis,2006,13(1):11-17.
14 Liu Y, Zhou P,Han M, et al. Basiliximab or antithymocyte Globulin for Induction Therapy in Kidney Transplantation: A Meta-analysis. Transplant Proc,2010,42(5):1667-1670.
15 Webster AC. Caring for Australians with Renal Impairment(CARI).The CAR1 Guidelines. Calcineurin inhibitors in renal transplantation:the addition of anti-CD25 antibody induction to standard immunosuppressive therapy for kidney transplant recipients. Nephrolngy(Cadtoa),2007,12(Suppl 1):S75-S84.
16 Nashan B. Antibody induction therapy in renal transplant patients receiving calcineurin-inhibitor immunosuppressive regimens: a comparative review. BioDrugs,2005,19(1): 39-46.
17 Breanan DC, Daller JA, Lake KD, et al. Rabbit antithymocyte globulin versus basiliximab in renal transplantation. N Engl J Med,2006,355(19):1967-1977.

