新型抗炎介质消退素与肾脏疾病
消退素是一种具有抗炎作用的长链多不饱和脂肪酸衍生物家族[1,2],可分为来源于ω3-20碳5烯酸(EPA)的消退素E(RvE)、来源于ω3-22碳6烯酸(DHA)的消退素D(RvD)及阿司匹林触发型消退素D(AT-RvD)等[3]。据报道,消退素有抑制中性粒细胞募集[1,4]、调节趋化因子和细胞因子产生、减少炎细胞浸润、抑制非自主疼痛及高血压[5]、促进瘢痕修复等作用[6]。在腹膜炎、炎性肠病、关节炎、哮喘及脓毒症等动物模型中,消退素表现出良好的抗炎效果。近年发现消退素对于缺血再灌注肾损伤、梗阻性肾病、内毒素血症相关肾损伤及肾移植排斥反应等具有保护作用[7]。本文就消退素在肾脏疾病领域的研究现状作一综述。
消退素的合成与受体
消退素合成的前体是EPA和DHA两种人体必须脂肪酸,分别通过阿司匹林化环氧酶2(Aspirin-COX2)和脂氧酶(LO)的催化。目前已发现2种E类消退素(RvE1、 RvE2)、4种D类消退素(RvD1~ RvD4)、4种阿司匹林触发型消退素D(AT-RvD1~AT-RvD4),共10种消退素。消退素的合成及分类如图1所示。高表达Aspirin-COX2的血管内皮细胞、高表达LO的多形核细胞(PMN)均能够产生相应种类的消退素。多种动物组织或器官(如血液、脂肪、大脑、视网膜、呼吸道、腹膜、肾脏)可检出消退素的天然表达[8]。有研究显示,白色念珠菌可通过细胞色素P450单氧化酶途径产生RevE1[9]。
目前,RvE1和RvD1的受体已经得到分离确认。RvE1受体包括趋化样因子受体1(CMKLR1,又称ChemR23)和白三烯B4受体1(BLT1),而RvD1则由G蛋白偶联脂氧素A4受体(ALX/FPR2) 和G蛋白偶联受体32(GPR32)所介导[10]。ChemR23和ALX/FPR2在免疫反应中发挥重要作用,可表达于单核细胞、树突状细胞、巨噬细胞、中性粒细胞及T细胞等多种免疫细胞表面。研究发现ChemR23还见于人血管平滑肌细胞、脂肪细胞、神经胶质细胞等表面[11]。ALX和GPR32在呼吸道上皮、多形核细胞、脂肪细胞、血管平滑肌、巨噬细胞表面分布较广泛[12],而其他种类的消退素的受体尚未得到确认。消退素受体在肾组织中除分布在非固有的免疫细胞表面外,还被证实分布于肾间质成纤维细胞,消退素主要作用于免疫细胞、肾间质纤维细胞等对肾脏起间接保护作用[13]。目前消退素受体在肾小球内皮、肾小管上皮等细胞表面的分布情况尚不十分清楚,亦有研究发现RvD并不直接保护体外培养的猪肾小管上皮细胞[3]。消退素对肾脏损伤是否有直接作用尚需要进一步阐明。
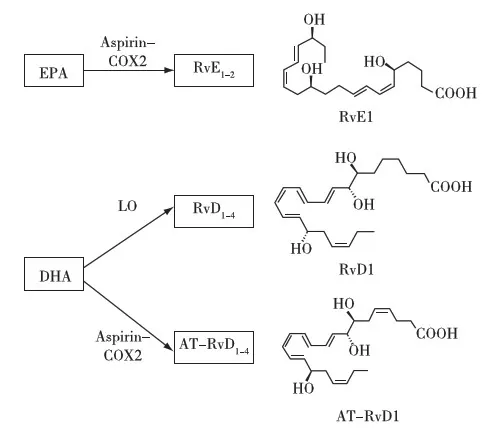
图1 消退素的合成及分类
EPA:ω3-20碳5烯酸;DHA:ω3-22碳6烯酸;LO:脂氧酶;Aspirin-COX2:阿司匹林化环氧酶2;RvE:E类消退素;RvD:D类消退素;AT-RvD:阿司匹林触发消退素
消退素对缺血再灌注肾损伤的保护作用
缺血再灌注损伤是组织或器官一段时间缺血或缺氧后恢复供血引起的组织损伤,其损伤机制与炎症反应部分相关[14]。Keyes等[15]曾报道,RvE1可直接作用于心肌细胞,通过抑制心肌凋亡,对抗大鼠心脏缺血再灌注损伤。缺血再灌注肾损伤可能是很多进展性肾脏疾病的中心环节[16,17]。缺血再灌注损伤时,RvD可抑制小鼠肾组织中白细胞聚集和白细胞浸润、降低白细胞活性,并可阻断Toll样受体介导的巨噬细胞激活[3]。在肾缺血再灌注小鼠模型中,RvD前体DHA内源性合成增多,RvD1和RvD3的血浆浓度也轻度增加。缺血肾损伤后外源性补充DHA,血浆中RvD1、RvD2、RvD3水平明显浓度上升[3],提示在缺血再灌注肾损伤时,机体不仅能内源性分泌消退素及前体,外源性补充DHA也能促进各种RvD的合成。研究还发现,肾脏缺血再灌注前和损伤后注射RvD均可发挥保护作用。在夹闭肾动脉前对小鼠进行尾静脉注射RvD,可减少功能性和器质性肾脏损伤;即使在夹闭肾动脉10 min后进行RvD干预,48h时小鼠的血浆肌酐已恢复正常,而对照组中肌酐仍显著升高。此外,PAS染色发现,RvD可提高肾小管上皮细胞生存率、降低炎症反应、减少毛细血管阻塞。因此,外源性补充消退素可以保护缺血再灌注引起的肾脏损伤,其机制可能与减少炎性细胞浸润、抑制肾间质纤维化[3]、防止微血栓形成[18]等有关。
消退素对梗阻性肾病的保护作用
纤维化是器官或组织中代偿性或反应性纤维结缔组织增生,为急性和慢性炎症反应结局之一[19]。2006年,Duffield等[3]发现治疗小鼠肾脏缺血再灌注损伤时,RvD能显著减少胶原沉积,对肾脏纤维化起保护作用。Qu等[13]在单侧输尿管结扎(UUO)模型中发现,RvE1可抑制造模2d、4d、6d小鼠肾脏肌成纤维细胞增生及平滑肌肌动蛋白和Ⅳ型胶原沉积,起早期对抗纤维化的作用。血小板源性生长因子B(PDGF-BB)在肾间质成纤维细胞增生中起重要作用[20,21];Qu等[13]体外实验发现,RvE1可抑制细胞外调节蛋白激酶(ERK)、蛋白激酶B(AKT)信号通路的持续性活化、对抗PDGF-BB诱导的小鼠肾纤维母细胞增生;对ChemR23进行敲除后,RvE1的抗纤维化作用被部分逆转,提示ChemR23可能介导RvE1的抗纤维化作用。纤维化可继发于炎症,消退素的抗纤维化作用也可能继发于抗炎作用。但UUO模型的炎性反应较轻,巨噬细胞等免疫细胞浸润不明显。因此,消退素可能拥有直接抗纤维化的效果,在梗阻性肾病等领域有一定应用前景。
消退素对内毒素血症相关肾损伤的保护作用
消退素已经在腹膜炎、结肠炎、脓毒症等多种感染性疾病小鼠模型中显示出较好的抗炎作用[8],其抗炎机制可能涉及减少炎性细胞浸润、抑制炎症因子分泌、促使炎性细胞凋亡、加速炎性细胞回流及MicroRNA反馈调节等[22]。在脂多糖(LPS)诱导小鼠急性肺损伤模型中,提前30 min经腹腔或尾静脉注射RvD1可显著降低动物死亡率、改善小鼠急性肺损伤症状,其机制可能与丝裂原原活化蛋白激酶(MAPKs)和核因子κB(NF-κB)通路的抑制有关[23,24]。体外实验发现,LPS可刺激巨噬细胞分泌肿瘤坏死因子α(TNF-α),而加入DHA或RvD1则能显著减少TNF-α的表达,但DHA只在高浓度下才具有抑制细胞因子分泌的作用,而RvD1在低浓度下即具有抗炎效果,所需浓度仅为其前体DHA的1/100。研究认为RvD并不能直接保护猪肾小管上皮细胞,但可通过抑制巨噬细胞活性、减少细胞因子分泌等作用实现对LPS等所致肾损伤起保护作用[3]。消退素对内毒素血症时肾功能、肾实质细胞的保护作用,仍有待研究进一步加以阐述。
消退素在肾移植抗排斥反应中的应用
排斥反应是肾移植术后常见的并发症,涉及体液免疫和细胞免疫中各种抗体、T细胞、B细胞、趋化因子、细胞因子等的交互作用[25]。肾小管上皮细胞是产生细胞因子和趋化因子的主要部位之一;浸润性白细胞和上皮细胞共同决定间质炎症反应和局部组织损伤的程度。研究证实RvE1等消退素可加强小鼠、人的巨噬细胞对凋亡白细胞、趋化因子、细胞因子和微生物产物的清扫,是多形核白细胞活化趋化、浸润的抑制剂[26,27]。Levy等[28]在肾移植前向小鼠静脉注射RvE1发现,RvE1可通过下调固有免疫而延迟排异反应发生的时间。白细胞介素17等是异体移植排斥反应的重要介质[29],消退素能够下调这些细胞因子的表达[30],也是消退素抑制移植排斥反应的可能机制之一。白三烯1受体在移植炎性反应白三烯4介导的传导途径中发挥重要作用,因此,RvE1在异体肾移植后发挥器官保护作用也可能通过其受体水平与白三烯1的拮抗[28,31]。此外,移植排斥反应时,肾脏组织易因免疫反应引发缺血再灌注损伤[32];如前文所述,消退素可保护小鼠缺血再灌注肾损伤,其减轻肾移植排斥反应的作用或与此有关。
小结:消退素是人体内EPA或DHA的衍生物,是生物效能强大的炎症自限因子,可通过阻止炎性细胞浸润、抑制炎症因子生成等发挥作用。Hellmann等[33]研究发现消退素具有缓解疼痛、抗纤维化、改善胰岛素抵抗等多种生物效应,NF-κB、MAPK、AKT等通路可能在其中发挥了关键作用。消退素是目前肾脏疾病研究中较新的领域,已有的报道提示消退素对小鼠缺血再灌注损伤肾损伤、梗阻性肾病、内毒素血症相关肾损伤及肾移植排斥反应等疾病动物模型具有保护作用,为相关疾病的药物研发提供了新思路,但仍需进一步明确消退素对各种肾脏疾病模型及肾固有细胞的保护作用,并深入阐述相关作用机制,为临床应用提供证据。
1 Serhan CN,Clish CB,Brannon J,et al.Novel functional sets of lipid-derived mediators with antiinflammatory actions generated from omega-3 fatty acids via cyclooxygenase 2-nonsteroidal antiinflammatory drugs and transcellular processing.J Exp Med,2000,192(8):1197-1204.
2 Serhan CN,Hong S,Gronert K,et al.Resolvins A Family of Bioactive Products of Omega-3 Fatty Acid Transformation Circuits Initiated by Aspirin Treatment that Counter Proinflammation Signals.J Exp Med,2002,196(8):1025-1037.
3 Duffield JS,Hong S,Vaidya VS,et al.Resolvin D series and protectin D1 mitigate acute kidney injury.J Immunol,2006,177(9):5902-5911.
4 Fredman G,Serhan CN.Specialized proresolving mediator targets for RvE1 and RvD1 in peripheral blood and mechanisms of resolution.Biochem J,2011,437(2):185-197.
5 Levy BD,Kohli P,Gotlinger K,et al.Protectin D1 is generated in asthma and dampens airway inflammation and hyperresponsiveness.J Immunol,2007,178(1):496-502.
6 Hasturk H,Kantarci A,Goguet-Surmenian E,et al.Resolvin E1 regulates inflammation at the cellular and tissue level and restores tissue homeostasis in vivo.J Immunol,2007,179(10):7021-7029.
7 Hong S,Lu Y.Omega-3 fatty acid-derived resolvins and protectins in inflammation resolution and leukocyte functions: targeting novel lipid mediator pathways in mitigation of acute kidney injury.Front Immunol,2013,4:413.
8 Weylandt KH,Chiu CY,Gomolka B,et al.Omega-3 fatty acids and their lipid mediators: towards an understanding of resolvin and protectin formation.Prostaglandins Other Lipid Mediat,2012,97(3-4):73-82.
9 Haas-Stapleton EJ,Lu Y,Hong S,et al.Candida albicans modulates host defense by biosynthesizing the pro-resolving mediator resolvin E1.PLoS One,2007,2(12):e1316.
10 Ramon S,Gao F,Serhan CN,et al.Specialized proresolving mediators enhance human B cell differentiation to antibody-secreting cells.J Immunol,2012,189(2):1036-1042.
11 Ho KJ,Spite M,Owens CD,et al.Aspirin-triggered lipoxin and resolvin E1 modulate vascular smooth muscle phenotype and correlate with peripheral atherosclerosis.Am J Pathol,2010,177(4):2116-2123.
12 袁红梅,万敬员,张力.促炎症消退新介质:消退素与保护素.生命科学,2012,24(1):54-57.
13 Qu X,Zhang X,Yao J,et al.Resolvins E1 and D1 inhibit interstitial fibrosis in the obstructed kidney via inhibition of local fibroblast proliferation.J Pathol,2012.
14 Polderman KH.Application of therapeutic hypothermia in the intensive care unit.Opportunities and pitfalls of a promising treatment modality--Part 2: Practical aspects and side effects.Intensive Care Med,2004,30(5):757-769.
15 Keyes KT,Ye Y,Lin Y,et al.Resolvin E1 protects the rat heart against reperfusion injury.Am J Physiol Heart Circ Physiol,2010,299(1):H153-H164.
16 Mazzali M,Jefferson JA,Ni Z,et al.Microvascular and tubulointerstitial injury associated with chronic hypoxia-induced hypertension.Kidney Int,2003,63(6):2088-2093.
17 Eddy AA.Experimental insights into the tubulointerstitial disease accompanying primary glomerular lesions.J Am Soc Nephrol,1994,5(6):1273-1287.
18 Norling LV,Dalli J,Flower RJ,et al.Resolvin D1 limits polymorphonuclear leukocyte recruitment to inflammatory loci: receptor-dependent actions.Arterioscler Thromb Vasc Biol,2012,32(8):1970-1978.
19 Rivera JA,O'Hare AM,Harper GM.Update on the management of chronic kidney disease.Am Fam Physician,2012,86(8):749-754.
20 Chen YT,Chang FC,Wu CF,et al.Platelet-derived growth factor receptor signaling activates pericyte-myofibroblast transition in obstructive and post-ischemic kidney fibrosis.Kidney Int,2011,80(11):1170-1181.
21 Floege J,Eitner F,Alpers CE.A new look at platelet-derived growth factor in renal disease.J Am Soc Nephrol,2008,19(1):12-23.
22 Fredman G,Li Y,Dalli J,et al.Self-limited versus delayed resolution of acute inflammation: temporal regulation of pro-resolving mediators and microRNA.Sci Rep,2012,2:639.
23 de Paiva CS,Schwartz CE,Gjorrstrup P,et al.Resolvin E1 (RX-10001) reduces corneal epithelial barrier disruption and protects against goblet cell loss in a murine model of dry eye.Cornea,2012,31(11):1299-1303.
24 Wang B,Gong X,Wan JY,et al.Resolvin D1 protects mice from LPS-induced acute lung injury.Pulm Pharmacol Ther,2011,24(4):434-441.
25 Davis CL,Delmonico FL.Living-donor kidney transplantation: a review of the current practices for the live donor.J Am Soc Nephrol,2005,16(7):2098-2110.
26 Arita M,Ohira T,Sun YP,et al.Resolvin E1 selectively interacts with leukotriene B4 receptor BLT1 and ChemR23 to regulate inflammation.J Immunol,2007,178(6):3912-3917.
27 Levy BD,Clish CB,Schmidt B,et al.Lipid mediator class switching during acute inflammation: signals in resolution.Nat Immunol,2001,2(7):612-619.
28 Levy BD,Zhang QY,Bonnans C,et al.The endogenous pro-resolving mediators lipoxin A4 and resolvin E1 preserve organ function in allograft rejection.Prostaglandins Leukot Essent Fatty Acids,2011,84(1):43-50.
29 Yuan X,Paez-Cortez J,Schmitt-Knosalla I,et al.A novel role of CD4 Th17 cells in mediating cardiac allograft rejection and vasculopathy.J Exp Med,2008,205(13):3133-3144.
30 Haworth O,Cernadas M,Yang R,et al.Resolvin E1 regulates interleukin 23,interferon-γ and lipoxin A4 to promote the resolution of allergic airway inflammation.Nat Immunol,2008,9(8):873-879.
31 Medoff BD,Seung E,Wain JC,et al.BLT1-mediated T cell trafficking is critical for rejection and obliterative bronchiolitis after lung transplantation.J Exp Med,2005,202(1):97-110.
32 Murray JE.Human organ transplantation: background and consequences.Science,1992,256(5062):1411-1416.
33 Hellmann J,Tang Y,Kosuri M,et al.Resolvin D1 decreases adipose tissus macrophage accumulation and improves insulin sensitivity in obese-diabetic mice.FASEB J,2011,25(7):2399-2407.

