β-arrestin在血管紧张素Ⅱ信号通路中的作用
G蛋白偶联受体(GPCR)是一类高度保守的膜整合蛋白的超家族,目前已经报道了近2 000种不同的GPCR,它广泛存在于包括真菌到哺乳动物在内的有机体中,大量的细胞外信号(如光线、气味、激素、神经递质等),正是通过这类受体而传入细胞内。G蛋白偶联的跨膜受体的结构特征是具有7个跨膜α螺旋。这是所有GPCR唯一共有的结构特征,也是GPCR的识别特征。此外,根据同源性可把GPCR分为三类:A受体家族包括视紫质/β肾上腺素受体,B受体家族包括降钙素受体、血管紧张素Ⅱ(Ang Ⅱ) 1型受体(AT1R),C受体家族包括γ-氨基丁酸受体、钙离子和谷氨酸盐受体。GPCR是人类基因组中最大的膜蛋白家族,约包含800~1 000个成员,在视觉、嗅觉、味觉及神经传递等人体各项生理代谢活动过程中发挥重要的作用,因此成为药物研究与开发的热点靶标。AngⅡ是肾素-血管紧张素系统(RAS)中最具生物活性的由8个氨基酸组成的小分子肽,它主要通过与AT1R结合发挥作用,AT1R属于B类GPCR。近年对AT1R下游信号通路的研究有了重要进展。
AT1R的G蛋白信号通路与β-arrestin信号通路
传统概念中,AT1R被AngⅡ激活后,其偶联的G蛋白α亚基与β、γ亚基解离而活化,活化的G蛋白亚基调节腺苷酸环化酶、磷脂酶和离子通道等,信号逐级放大,调节细胞功能,即G蛋白信号通路。
后来研究发现,同其他GPCR一样,在AT1R的C端存在β-arrestin特异性结合域[1]。 β-arrestin是细胞内重要的调控蛋白(主要包括β-arrestin 1和β-arrestin 2),对绝大部分GPCR介导的信号转导具有调节作用。当AT1R被激活后,募集β-arrestin到其特异性结合域。这一过程中,β-arrestin被认为是G蛋白信号通路的抑制剂,促使AT1R与G 蛋白解偶联,并结合网格蛋白参与AT1R内吞、脱敏及降解[2,3]。
Ahn等[4]研究认为,β-arrestin作用远远超过了过去认识到的GPCR“解偶联剂”、诱导GPCR内吞等,而是作为接头蛋白,与下游信号分子形成复合物,以非G蛋白方式激活下游信号分子,即β-arrestin依赖的信号通路。β-arrestin与其特异性结合域的结合介导了其对AT1R的三方面作用:(1)促进AT1R与 G蛋白解偶联,中止 G蛋白信号转导;(2)作为支架蛋白,募集胞吞蛋白,诱导AT1R内吞;(3)作为接头蛋白,与下游信号分子形成复合物,以β-arrestin依赖的信号通路方式激活信号转导分子,如促分裂原活化蛋白激酶(MAPK)、Src蛋白酪氨酸激酶和Akt等。
因此,AT1R的下游是两条信号通路:一条通路是G蛋白信号途径[5]。另一通路则是β-arrestin细胞信号通路[5,6](图1)。
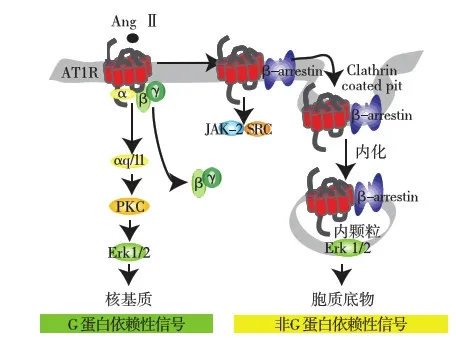
图1 AT1R的G蛋白通路与β-arrestin通路
β-arrestin介导信号通路不同于G蛋白依赖性信号通路,它依赖于GPCR和β-arrestins相互作用的亲和力,该亲和力又依赖于由GPCR激酶(GRKs)引起的GPCR磷酸化的程度。AT1R,B类GPCR有多个磷酸化位点,和β-arrestin1/2都有高的亲和力,在浆膜和胞内体膜持续较长时间[7]。
Tohgo等[8]还发现,这两条信号通路的下游信号均有细胞外信号调节蛋白激酶(ERK)参与,但ERK的去向不同,即G蛋白信号下游ERK转入细胞核内,β-arrestin下游ERK则留在胞质中。两者所引起的生物学效应也不同,如G蛋白依赖性ERK信号促进心肌细胞肥大,而β-arrestin依赖性ERK信号促进心肌细胞增生[9]。且β-arrestin1和 β-arrestin2对 AT1R活化的ERK信号存在明显差异,β-arrestin 1以负调控的方式对抗β-arrestin2对ERK的活化。研究表明在血管紧张素系统里,β-arrestin1 siRNA 刺激可增强由β-arrestin2 依赖性机制引起的 ERK 活性,表明在生理水平,β-arrestin1 可能作为抑制剂引起β-arrestin2依赖性 ERK活化的减弱[10]。
G蛋白依赖ERK具有明确的核功能,但β-arrestin依赖ERK并无典型的核功能(因为留在胞质中),其具体的下游靶点还未知,有研究报道转录信号转导子与激活子3 (STAT3)可能是β-arrestin-ERK的具有核功能的下游因子[11]。
AngⅡ与SII-AngⅡ /TRV120027
配体刺激G蛋白和(或)β-arrestin信号的差异,最终决定了GPCR的配体特异性细胞生物学效应。能激活β-arrestin信号的配体称为β-arrestin偏爱性配体。β-arrestin偏爱性配体使我们能够独立研究β-arrestin通路准确的生物学作用。
AngⅡ含8个氨基酸,是无偏向性的全覆盖的双通路激活剂。AngⅡ的第4位酪氨酸(Tyr4)和第8位苯丙氨酸(Phe8)是AT1R-G蛋白依赖信号所必需的。如果将第4位或第8位氨基酸改变,则特异性激活AT1R-β-arrestin依赖信号通路。 SII-AngⅡ是AngⅡ的修饰多肽,使AngⅡ第4位酪氨酸及第8位苯丙氨酸均变为异亮氨酸,SII-AngⅡ是AT1R的β-arrestin偏爱性配体[12],它可在缺乏G蛋白激动剂的情况下引发β-arrestin的信号,如激活ERK[13,14]。体外实验也发现,SII-AngⅡ作用于G蛋白位点突变的AT1R也能引发β-arrestin的募集和信号转导[13],而用RNA干扰技术沉默β-arrestin2基因会消除SII- AngⅡ介导的β-arrestin信号[14]。这些研究结果证实SII- AngⅡ引发的β-arrestin信号不依赖于G蛋白。Christensen等[15]报道,SII-AngⅡ和AngⅡ导致的AT1R磷酸化中有36%磷酸化位点重叠,有部分位点(58/1183)只通过SII调控,而不通过AngⅡ。Kendall等[16]使用gel-based 磷酸化蛋白质组学分析AngⅡ和SII诱导的信号,共检测到34个磷酸化蛋白,其中有16个为SII所特异,8个为AngⅡ所特异,提示β-arrestin通路在AT1R信号中可能起着重要作用。Rajagopal等[17]在离体心肌细胞上观察到,SII-AngⅡ激动的β-arrestin信号可改善心肌正性收缩力。Zhai等[18]应用基因转染技术,在小鼠心脏内过量表达不结合G蛋白的突变型AT1R后,心肌细胞纤维化和凋亡均减少,证明SII-AngⅡ产生的心肌保护作用的确是由β-arrestin介导的。
TRV120027(Sar-Arg-Val-Tyr-Ile-His-Pro-D-Ala-OH)是AngⅡ衍生多肽, 也是AT1R的β-arrestin选择性激动剂[13,19],SII-AngⅡ与TRV120027都可降低血压,增强心肌细胞收缩性,增加心肌细胞绩效,降低心脏纤维化[13,20]。TRV120027还能改善心功能[19],是第一个用来治疗急性心力衰竭的选择性激动剂。
β-arrestin信号通路与肾脏纤维化
β-arrestin信号通路是否参与肾脏纤维化,目前尚无报道。我们自己的研究显示,在AngⅡ刺激后,用siRNA下调β-arrestin1和(或)β-arrestin2表达能使肾脏成纤维细胞的Ⅰ/Ⅲ型胶原蛋白和纤维连接蛋白表达下降,提示β-arrestin参与肾脏纤维化(未发表资料)。进一步,我们对于β-arrestin信号下游也进行了部分研究,AngⅡ能诱导ERK和 STAT3活化,ERK活化出现在STAT3活化之前,下调β-arrestin则抑制ERK和 STAT3活化,β-arrestin和STAT3结合,形成免疫共沉淀复合物,提示STAT3可能是ERK的下游核转录因子(未发表资料)。Lovgren等[21]对肺纤维化的研究结果也与我们的研究结果相似,在博来霉素诱导的鼠肺纤维化模型中,敲除β-arrestin1或β-arrestin2可减少死亡率,抑制肺基质沉积,提示β-arrestin信号参与肺纤维化。这与SII-AngⅡ及TRV120027在心脏的研究结果完全不同,究其原因,可能有这样几种可能:(1)β-arrestin通路具有器官特异性,造成心脏、肺、肾脏研究结果的不同;(2)在用基因敲除或siRNA沉默技术干扰β-arrestin信号的同时,会延长G蛋白的活性,上述肺纤维化结果及我们的肾纤维化研究结果可能是β-arrestin信号衰减引发的,也可能是G蛋白信号延长引发的;(3)我们的研究中使用的是Ang Ⅱ作为刺激物,而不是SII-AngⅡ及TRV120027,所得出结果可能是G蛋白通路和β-arrestin信号通路相互平衡后的最后结果,而非β-arrestin信号通路的真实情况。我们会在后续的研究中,利用β-arrestin信号通路偏爱性配体、β-arrestin基因沉默及β-arrestin-/-细胞和小鼠进行研究,以期获得准确结论。
总结与期望
Ang Ⅱ主要通过与AT1R 结合发挥作用,AT1R下游信号通路除了已认识的G蛋白信号途径,还有另一重要通路,即β-arrestin细胞信号通路。以往未对两信号通路区别研究,而AT1R-β-arrestin信号通路的作用尚不清楚。β-arrestins在各器官病变中的机制研究还很欠缺,且其是否参与肾脏纤维化尚无报道,需要我们更深入的研究,如β-arrestins依赖性信号通路和G蛋白依赖性信号通路的不同效应,β-arrestin1和β-arrestin2的不同作用,β-arrestins在各器官中的不同调控,其中涉及到多种信号分子转导通路间的差别等研究。现已明确β-arrestins代表细胞内复杂信号网络的一重要交叉点,使其成为实验和治疗的诱人的靶点,β-arrestins选择性激动剂是后续研究的最有希望的策略。β-arrestin偏向性配体的临床应用取决于其引发的β-arrestin信号参与的治疗作用,这将是优化设计各种GPCR偏向性配体药物的方向,即利用配体的偏向性,“扬长避短”,激动可产生或提高疗效的信号,抑制产生不良反应的信号,以期开发出高疗效、低毒性的药物。
1 Oakley RH,Laporte SA,Holt JA,et al.Molecular determinants underlying the formation of stable in tracellular G protein-coupled receptor-beta-arrestin complexes after receptor endocytosis.J Biol Chem,2001,276(22):19452-19460.
2 Thomas WG.Regulation of angiotensin Ⅱ type 1 (AT1) receptor function.Regul Pept,1999,79(1):9-23.
3 Hunyady L,Catt KJ,Clark AJ,et al.Mechanisms and functions of AT(1) angiotensin receptor internalization.Regul Pept,2000,91(1-3):29-44.
4 DeWire SM,Ahn S,Lefkowitz RJ,et al.Beta-arrestins and cell signaling.Annu Rev Physiol,2007,69:483-510.
5 Hunyady L,Catt KJ.Pleiotropic AT1 receptor signaling pathways mediating physiological and pathogenic actions of angiotensin Ⅱ.Mol Endocrinol,2006,20(5):953-970.
6 Kim J,Ahn S,Ren XR,et al.Functional antagonism of different G protein-coupled receptor kinases for beta-arrestin-mediated angiotensin Ⅱ receptor signaling.Proc Natl Acad Sci U S A,2005,102(5):1442-1447.
7 Simaan M,Bédard-Goulet S,Fessart D,et al.Dissociation of beta-arrestin from internalized bradykinin B2 receptor is necessary for receptor recycling and resensitization.Cell Signal,2005,17(9):1074-1083.
8 Tohgo A,Choy EW,Gesty-Palmer D,et al.The stability of the G protein-coupled receptor-beta-arrestin interaction determines the mechanism and functional consequence of ERK activation.J Biol Chem,2003,278(8):6258-6267.
9 Aplin M,Christensen GL,Schneider M,et al.Differential extracellular signal-regulated kinases 1 and 2 activation by the angiotensin type 1 receptor supports distinct phenotypes of cardiac myocytes.Basic Clin Pharmacol Toxicol,2007,100(5):296-301.
10 Ahn S,Wei H,Garrison TR,et al.Reciprocal regulation of angiotensin receptor-activated extracellular signal-regulated kinases by beta-arrestins 1 and 2.Biol Chem,2004,279(9):7807-7811.
11 Lo RK,Cheung H,Wong YH.Constitutively active Galpha16 stimulates STAT3 via a c-Src/JAK- and ERK-dependent mechanism.J Biol Chem,2003,278(52):52154-52165.
12 Whalen EJ,Rajagopal S,Lefkowitz RJ.Therapeutic potential of β-arrestin- and G protein-biased agonists.Trends Mol Med,2011,17(3):126-139.
13 Wei H,Ahn S,Shenoy SK,et al.Independent beta-arrestin 2 and G protein-mediated pathways for angiotensin Ⅱ activation of extracellular signal-regulated kinases 1 and 2.Proc Natl Acad Sci U S A,2003,100(19):10782-10787.
14 Ahn S,Shenoy SK,Wei H,et al.Differential kinetic and spatial patterns of beta-arrestin and G protein-mediated ERK activation by the angiotensin Ⅱ receptor.J Biol Chem,2004,279(34):35518-35525.
15 Christensen GL,Kelstrup CD,Lyngsø C,et al.Quantitative phosphoproteomics dissection of seven-transmembrane receptor signaling using full and biased agonists.Mol Cell Proteomics,2010,9(7):1540-1553.
16 Kendall RT,Strungs EG,Rachidi SM,et al.The beta-arrestin pathway-selective type 1A angiotensin receptor (AT1A) agonist [Sar1,Ile4,Ile8]angiotensin Ⅱ regulates a robust G protein-independent signaling network.J Biol Chem,2011,286(22):19880-19891.
17 Rajagopal K,Whalen EJ,Violin JD,et al.Beta-arrestin2-mediated inotropic effects of the angiotensin Ⅱ type 1A receptor in isolated cardiac myocytes.Proc Natl Acad Sci U S A,2006,103(44):16284-16289.
18 Zhai P,Yamamoto M,Galeotti J,et al.Cardiac-specific overexpression of AT1 receptor mutant lacking G alpha q/G alpha i coupling causes hypertrophy and bradycardia in transgenic mice.J Clin Invest,2005,115(11):3045-3056.
19 Boerrigter G,Soergel DG,Violin JD,et al.TRV120027,a novel β-arrestin biased ligand at the angiotensin Ⅱ type Ⅰ receptor,unloads the heart and maintains renal function when added to furosemide in experimental heart failure.Circ Heart Fail,2012,5(5):627-634.
20 Violin JD,DeWire SM,Yamashita D,et al.Selectively engaging β-arrestins at the angiotensin Ⅱ type 1 receptor reduces blood pressure and increases cardiac performance.J Pharmacol Exp Ther,2010,335(3):572-579.
21 Lovgren AK,Kovacs JJ,Xie T,et al.β-arrestin deficiency protects against pulmonary fibrosis in mice and prevents fibroblast invasion of extracellular matrix.Sci Transl Med,2011,3(74):74ra23.

