大蒜素对兔心房肌细胞超速激活延迟整流钾电流的作用
陈 晨, 王 禹, 张德贤, 傅义程, 陈 曦, 徐 斌, 杨 洁, 尹 彤, 朱庆磊,李 泱
大蒜素对兔心房肌细胞超速激活延迟整流钾电流的作用
陈 晨, 王 禹, 张德贤, 傅义程, 陈 曦, 徐 斌, 杨 洁, 尹 彤, 朱庆磊,李 泱*
(解放军总医院老年心血管病研究所, 北京 100853)
研究大蒜素对兔单个心房肌细胞超速激活的延迟整流钾电流(KUr)的作用,探讨其抗房性心律失常的机制。采用双酶法分离兔单个心房肌细胞,应用细胞外局部灌流法给药,采用全细胞膜片钳技术记录电流,以观察大蒜素对KUr的作用。大蒜素200μmol/L对正常兔心房肌细胞KUr有显著的抑制效应,使KUr峰值由(14.5±3.2)pA/pF降至(7.9±1.2)pA/pF (<0.01,=15)。大蒜素可使KUr的电流-电压曲线降低,且随着除极化电位的增加,作用更加明显,提示其作用具有电压依赖性。同时,发现大蒜素对KUr的抑制效应存在浓度依赖性,半数抑制浓度(IC50)为149.6μmol/L。门控动力学机制研究发现,大蒜素可以使通道激活曲线右移,延迟激活;使通道稳态失活左移,加速失活;使通道失活后恢复时间延长,减缓通道失活后的再次激活。从不同环节减少KUr通道的开放,降低电流密度。大蒜素抑制心房肌细胞膜上KUr,这可能是其治疗房性心律失常的细胞电生理基础。
大蒜素; 心房肌细胞; 超速激活延迟整流钾电流; 膜片钳技术
房性心律失常,特别是心房颤动(atrial fibrillation,AF),已成为最常见的心律失常之一。可引起脑卒中、肺栓塞、心力衰竭、心肌梗死等诸多并发症,有着很高的病死率和致残率[1]。尽管目前有很多药物正应用于AF的治疗,但是人们仍希望得到一种更为安全而有效的抗心律失常药物[2]。理想的治疗AF的药物应具有高度的心房肌细胞选择性,可以选择性地终止或延缓AF的发生,而不引起室性心律失常。超速激活的延迟整流钾电流(the ultra rapid delayed rectifier potassium current,KUr)只存在于心房肌细胞膜上,而在心室肌无分布,故是构成心房肌细胞复极化电流的主要成分之一,也是治疗房性心律失常的电位靶点[3]。
大蒜素(allitridum,All)是一种从百合科植物大蒜鳞茎中分离出的具有多种生物学活性的化合物,其化学名为二烯丙基三硫化物。近年来,All在防治心血管疾病领域的研究受到重视,已证实其有减慢窦率、抑制心肌收缩、抗心律失常等作用,能拮抗多种模型动物的实验性心律失常。资料显示,All具有明显的抗房性心律失常的效应,但作用机制尚不明确[4]。本研究选择兔心房肌细胞,用全细胞膜片钳技术观察All对兔心房肌细胞KUr的影响,以阐明All的抗AF等房性心律失常作用的细胞电生理基础。
1 材料与方法
1.1 溶液与试剂
胶原酶Ⅱ、胰蛋白酶、牛血清白蛋白、天冬氨酸钾、丙酮酸钠、MgATP、HEPES、CaCl2、CdCl2、BaCl2、4-氨基吡啶(4-aminopyridine,4-AP)、dofeilite均为Sigma公司产品;EGTA购自Fluka Biochemika;其他试剂均为分析纯。Tyrode液的组成成分(mmol/L):NaCl 135,KCl 5.4,CaCl21.8,MgCl21.0,NaH2PO40.33,HEPES 10,glucose 10,pH值用NaOH调至7.3;无钙Tyrode液和0.2mmol/L Ca2+Tyrode液,分别为Tyrode液中不加CaCl2和加0.2 mmol/LCaCl2。细胞保护液(KB液,mmol/L):KOH 110,taurine 10,oxalic acid 10,glutamic acid 70,KCl 25,KH2PO410,EGTA 5,Hepe 5,glucose 10,以KOH调pH值至7.4。细胞外液(mmol/L):N-methyl-D-glucamine(NMG)149,MgCl25,CaCl20.65,HEPES 5,以HCl调pH值至7.4。细胞内液(mmol/L):KCl 45,K-aspartate 85,Na-pytuvate 5,MgATP 5.0,EGTA 10,HEPES 10,glucose 11,用KOH调pH值至7.4。
1.2 兔单个心房肌细胞分离
成年新西兰兔(1.0~1.5kg),雌雄兼有。购自解放军总医院实验动物中心,动物实验方法符合动物伦理学要求。依据文献[5]采用酶解法制备心房肌单细胞并进行了改进。实验兔经腹腔20%水合氯醛(2ml/kg)麻醉,迅速取心脏,在37℃和通氧条件下行Langendorff 灌流。用无Ca2+Tyrode¢s液灌流3~5min,用含Ⅱ型胶原酶70mg、胰蛋白酶12mg无Ca2+Tyrode¢s液灌流(50ml)25~30min以消化心房肌。沿房室间沟取心房肌,剪碎后加入KB液中并吹打使细胞脱落,并于-4℃保存,1h后进行实验。取保存液加于1ml灌流槽中,待细胞贴壁后,于倒置显微镜下选择边缘整齐、表面无颗粒、横纹清晰、无收缩的细胞,在37℃下进行实验。
1.3 药物及应用
All(化学结构式见图1)购于上海禾风制药有限公司,纯品是无色或淡黄色油状物,相对分子质量为162。临用时采用细胞外液新鲜配制成结果中所示终浓度。采用局部灌流装置于细胞外恒流灌流方式给药,为确保药物效应的一致性,待平衡5min后方可记录电流。
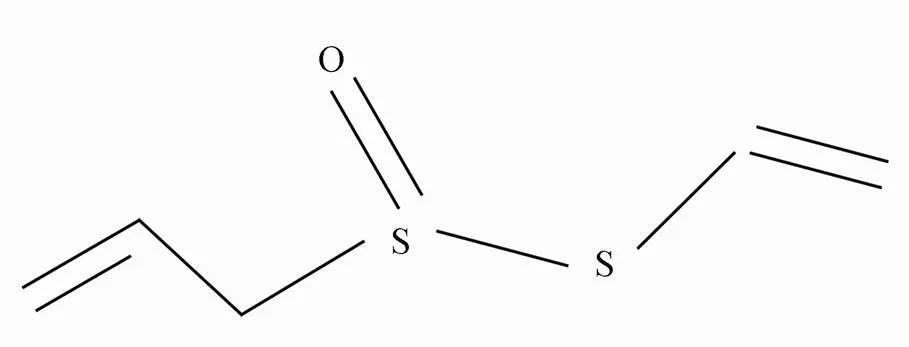
图1 All的化学结构式
Figure 1 Chemical structural formula of allitridum
1.4 干扰电流的排除
向细胞外液加入BaCl2200µmol/L阻断K1,加入dofeilite 5nmol/L阻断Kr,CdCl2100µmol/L阻断Ca,L,TTX 100µmol/L阻断Na。参照文献[6]采用电流减除法消除to干扰。
1.5 全细胞膜片钳记录
采用全细胞膜片钳记录方法,在电流钳模式下记录动作电位;在电压钳制下记录电流。膜片钳放大器(AXON-700B,USA)同计算机连接。刺激信号及电压输入信号的采集通过Digidata1440A数模转换器由软件(pCLAMP)控制。玻璃毛坯(GG-17)经微电极拉制仪(Narishige,pp-83)拉制成电阻为2.5~5.5MΩ的电极。调节三维操纵器进行封接,使封接电阻达1GΩ以上,吸破细胞膜形成全细胞记录模式。细胞膜电容记录:施以0.4V/s的斜坡刺激,记录电流并按方程Cm=/(dV/dt)计算细胞膜电容Cm,其中为电流值,dV/dt即电压斜率。为消除细胞间误差,电流值以电流密度(pA/pF)表示。慢电容及串联电流补偿为85%~90%。信号经截止频率为1kHz的四阶贝塞尔低通滤波器滤波,采样率为5kHz。
1.6 参数的设定
KUr的电流:保持电位-80mV,施予-40mV,20ms的预刺激失活钠通道,随即给予+50mV,2000ms的脉冲,记录KUr。
KUr电流-电压曲线:保持电位-80mV,施予-40mV,20ms的预刺激失活钠通道,随即给予-40mV~+70mV,2000ms的脉冲,记录KUr。以电流密度与测试电压作图,得到KUr的电流-电压曲线。
KUr稳态激活曲线:保持电位-80mV,施予-40mV,20ms的预刺激失活钠通道,随即给予-40mV~+70mV,4000ms的脉冲,记录KUr。标准化各电流幅值,以相对电流对各膜电位作图得到稳态激活曲线,并用Boltzmann方程“/max={1+exp[(1/2,act-m)/act]}-1”进行曲线拟合,其中1/2为半激活电压,为激活曲线斜率。
KUr稳态失活曲线:采用典型的双刺激模式,保持电位-80mV,施予-40mV,20ms的预刺激失活钠通道,紧接着给予+60mV,5000ms的条件刺激,紧接着给予-40~+50mV,阶跃5mV的系列测试刺激,记录残存KUr。标准化各电流幅值,以相对电流对各膜电位作图得稳态失活曲线。用Boltzmann方程“/max={1+exp[-(1/2,inact-m)/]}-1”进行曲线拟合求出半失活电压(1/2)和曲线斜率(inact)。
KUr失活后恢复曲线:采用典型的双刺激模式,保持电位-80mV,施予-40mV,20ms的预刺激失活钠通道,紧接着给予+60mV,2000ms的条件刺激,间隔100,200,300,400,500,600,700,800ms,给予+60mV,2000ms的测试刺激,记录KUr。标准化各电流幅值,以相对电流对间隔时间作图,得失活后恢复曲线。
1.7 统计学处理
2 结 果
2.1 All对心房肌IKUr峰值电流密度的作用
正常的急性分离的兔心房肌细胞KUr电流密度为(14.5±2.2)pA/pF,该电流对4-AP敏感,100μmol/L的4-AP几乎可以将其阻断。应用200μmol/L的All后可使其电流密度明显降至(9.9±1.2)pA/pF(<0.01,=15)。给予50,100,200,400μmol/L的All后发现药物的抑制效应随着浓度增加而增强,呈现出浓度依赖性特征,半数抑制浓度(IC50)为149μmol/L,Hill系数为0.71(图2)。
2.2 All对心房肌IKUr电流-电压曲线的作用
随着电压向除极化方向增加,电流密度增大,且呈一定的外整流特征。当细胞暴露于All 200µmol/L时,KUr在正于+10mV的各电压下电流密度明显降低,随着电压向除极化的方向移动,这种效应更加明显。电流的外向整流特征也相对降低,用药后的KUr电流-电压曲线近乎直线(图3)。
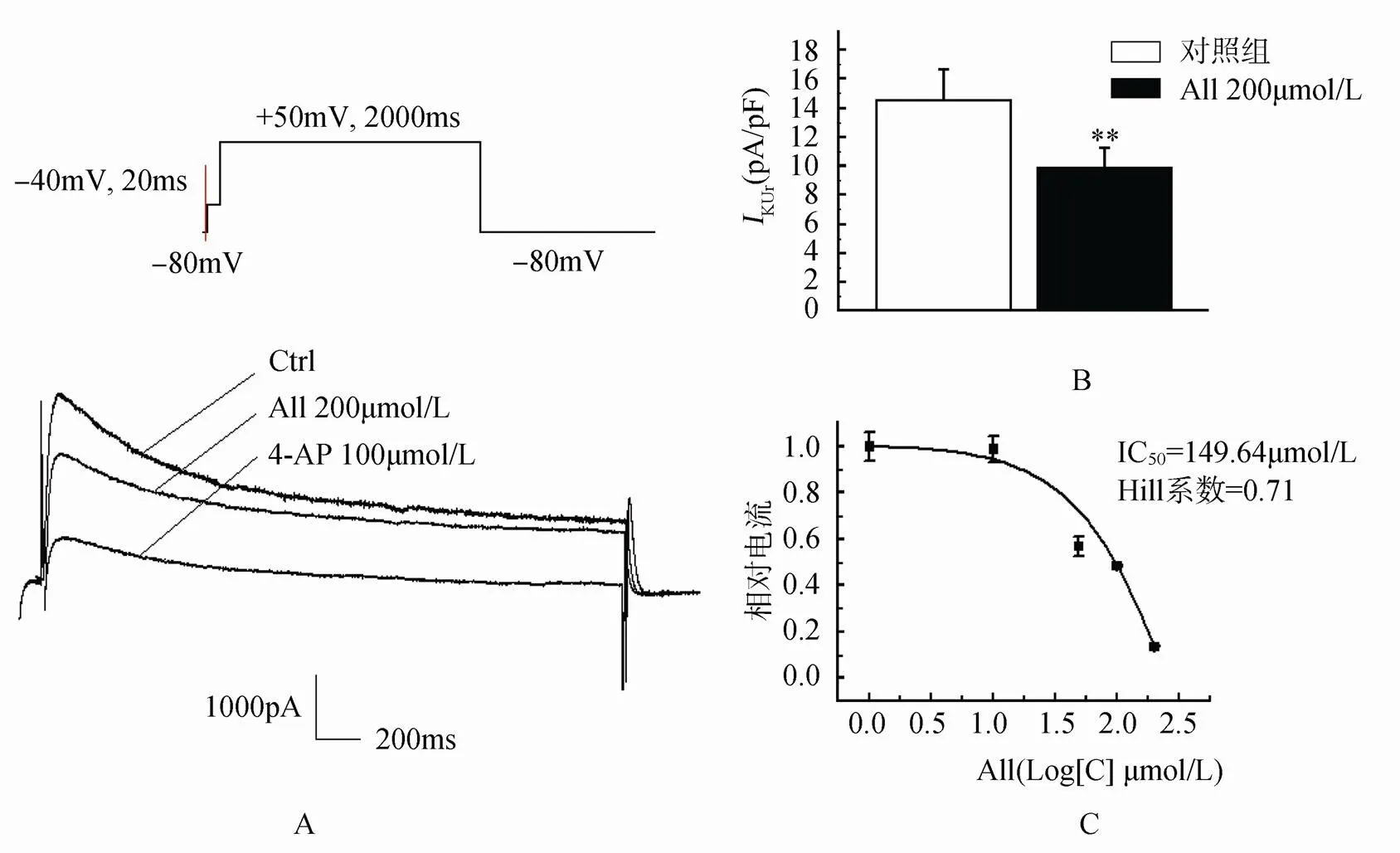
图2 All对心房肌细胞IKUr电流的浓度依赖性作用
Figure 2 Concentration-dependent effect of allitridum on atrial myocytesKUrcurrent
A: 对KUr作用原始电流图(+50mV); B: 对KUr峰值的作用; C: 对KUr作用的浓度依赖性。与对照组比较,P<0.01
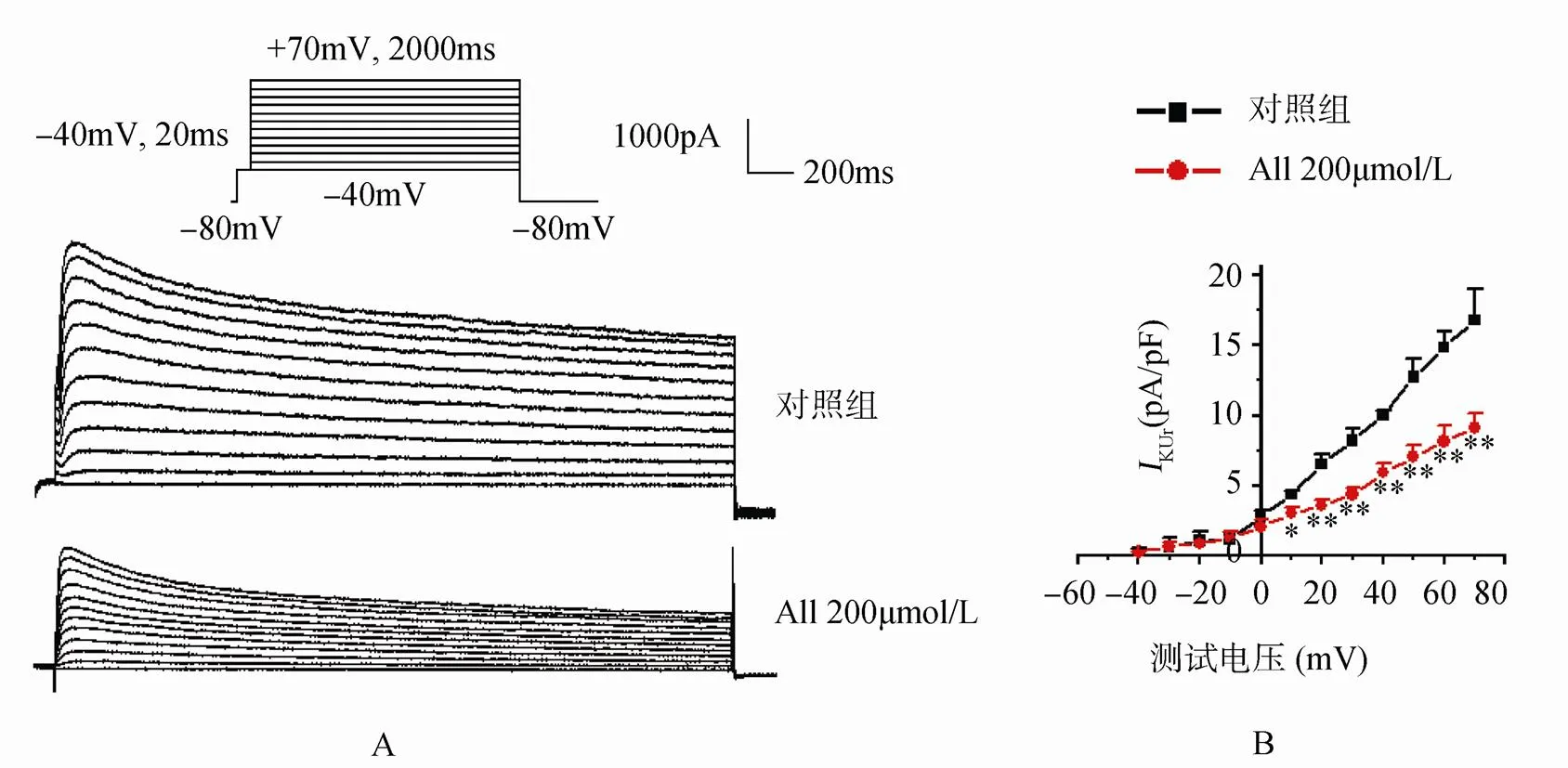
图3 All对心房肌细胞IKUr电流-电压曲线的作用
Figure 3 Effect of allitridum on atrial myocytesKUrcurrent-voltage curve
A: 对KUr作用原始电流图; B: I-曲线。与对照组比较,P<0.05,P<0.01
2.3 All对心房肌细胞IKUr激活曲线的作用
与对照细胞的电流比较,应用All 200µmol/L后,KUr的稳态激活曲线右移,即向除极化方向移动,1/2,act从对照的(-13.67±1.24)mV正移到(-2.38±0.11)mV(=14,<0.01),且激活曲线斜率act也有降低,在用药前后分别为(10.32±0.94)mV和(6.21±0.57)mV(=14,<0.01;图4)。
2.4 All对心房肌细胞IKUr失活曲线的作用
如图5所示,应用All 200µmol/L后,KUr的失活曲线左移,即向超极化方向移动,1/2,inact从对照的(-6.32±0.46)mV移到(-12.67±1.11)mV(=14,<0.01),但药物对稳态失活曲线斜率inact影响不大。
2.5 All对心房肌IKUr失活后恢复动力学的作用
标准化各电流幅值,以相对电流对间隔时间作图,得到失活后恢复曲线,由图6可见,All 200µmol/L可使恢复曲线明显减慢,此现象在恢复的前400ms表现尤甚,恢复时间常数τ从对照的(134.6±13.9)ms移到(215.8±13.6)ms(=14,<0.01)。提示,在同一时间间隔下,通道恢复速率降低,电流幅值减少。
3 讨 论
KUr是一种仅在心房肌细胞特异表达的离子通道电流,主要是心房肌细胞复极Ⅱ期的外向离子流,可促进动作电位3期复极,是有效不应期和动作电位时限的决定因素之一[7]。同时KUr对信号传递、心肌细胞兴奋性、不应性、传导性稳态的维持有重要作用。KUr出现异常是AF时心房肌电重构的重要特征,因此也成为研究AF发生机制的关键指标和治疗房性心律失常的电位靶点[8,9]。目前,一系列的KUr阻滞剂治疗AF的疗效正在评估中[10]。
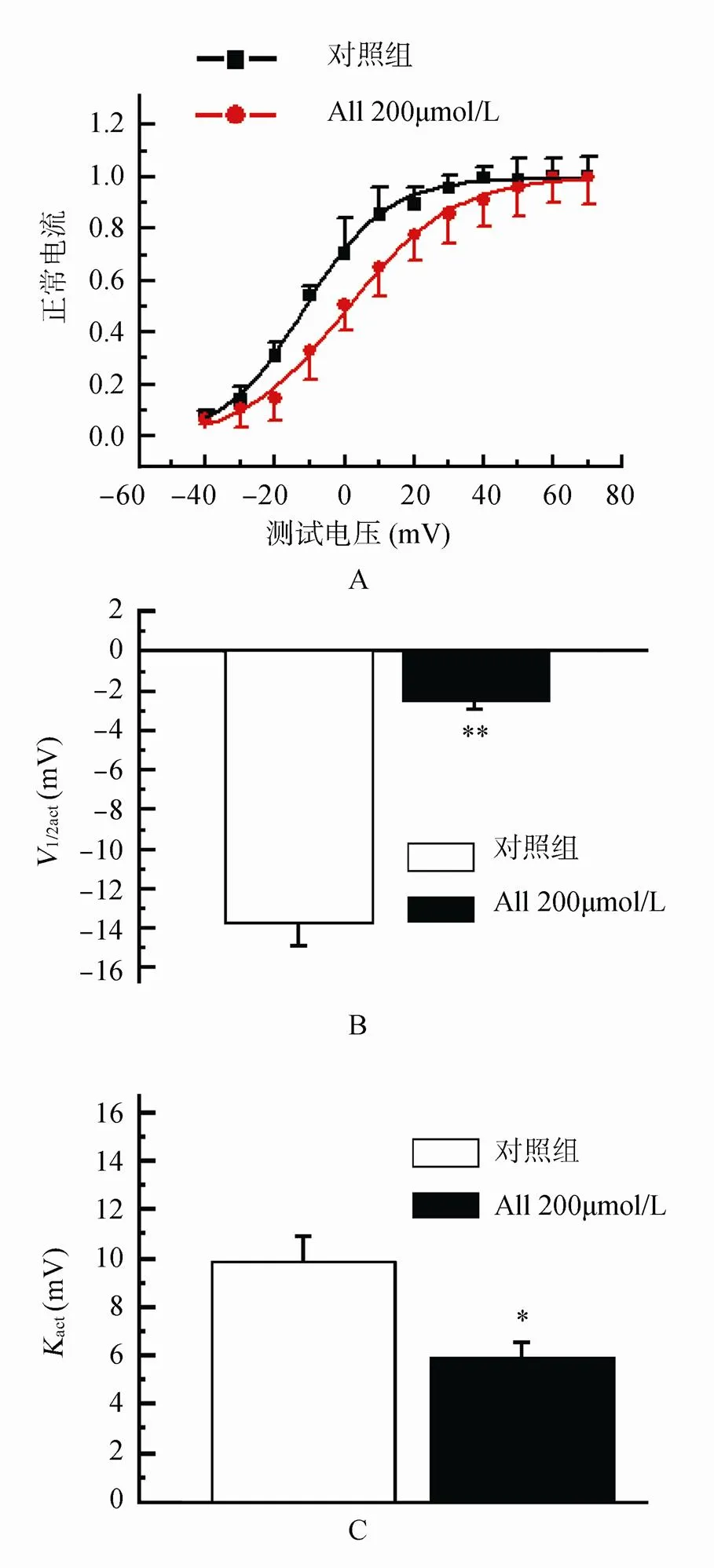
图4 All对H2O2致兔心房肌细胞IKUr激活曲线改变的作用
Figure 4 Effect of allitridum on H2O2-induced change of rabbit atrial myocytesKUractivation curve
A: 对KUr稳态激活曲线的作用; B: 对KUr半激活电压的作用; C: 对KUr激活曲线斜率的作用。与对照组比较,P<0.05,P<0.01
本研究通过All对兔单个心房肌细胞KUr的效应观察,发现All可直接抑制KUr,使其峰值显著降低。而且,此抑制作用存在电压依赖性,即随着除极化电位的增加,作用更加明显。同时发现All对KUr的抑制效应存在浓度依赖性。进一步的门控动力学机制研究发现,All可以使通道激活曲线右移,延迟激活;使通道稳态失活左移,加速失活;使通道失活后恢复时间延长,减缓通道失活后的再次激活。从不同环节减少通道的开放,这可能是其降低KUr电流密度的主要机制。之前学者已证实All具有拮抗多种模型动物的实验性心律失常的效应,并发现其可降低心房自律性、兴奋性,延长有效不应期及收缩性,减慢房室传导。本研究的结果至少可以从细胞水平部分地揭示All抗房性快速心律失常或AF的电生理机制。
然而,研究心肌细胞KUr通道阻滞剂的效应性较为复杂。首先,KUr与其他电流特别是瞬时外向钾电流(to)有潜在的重叠,如何区分则显得十分重要,本研究采用了电流减除法消除to干扰,以求结果反映真实客观情况。其次,尚无选择性的特异工具药可供选择,但其对4-AP较其他钾电流敏感得多,已有不少实验应用4-AP作为鉴定该电流的工具药。最后,还有各种疾病可引起KUr的电重塑[11],故本研究虽然发现All对正常心房肌细胞KUr具有电压依赖性和浓度依赖性阻滞效应以及可能的门控机制,但是否与对AF时KUr的作用一致还有待进一步的实验加以证实。
在过去的十年中,对KUr阻滞剂的研究迅速开展。诸多KUr的阻滞药已被证实在AF动物模型中有很好的疗效[12-14]。Ford等[15]发现XEN-D0101通过对心房肌细胞KUr等电流的抑制发挥治疗慢性AF作用。对新的KUr阻滞剂治疗AF的评价显示,单纯的阻断KUr通道不足以抑制AF。多数药物在作用于KUr的同时还作用于其他通道[16]。文献报道All还有抑制Na、Ca,L和其他钾通道电流的作用。因此,我们认为All通过抑制KUr及联合其他通道的多重效应而发挥其抗房性心律失常的作用。
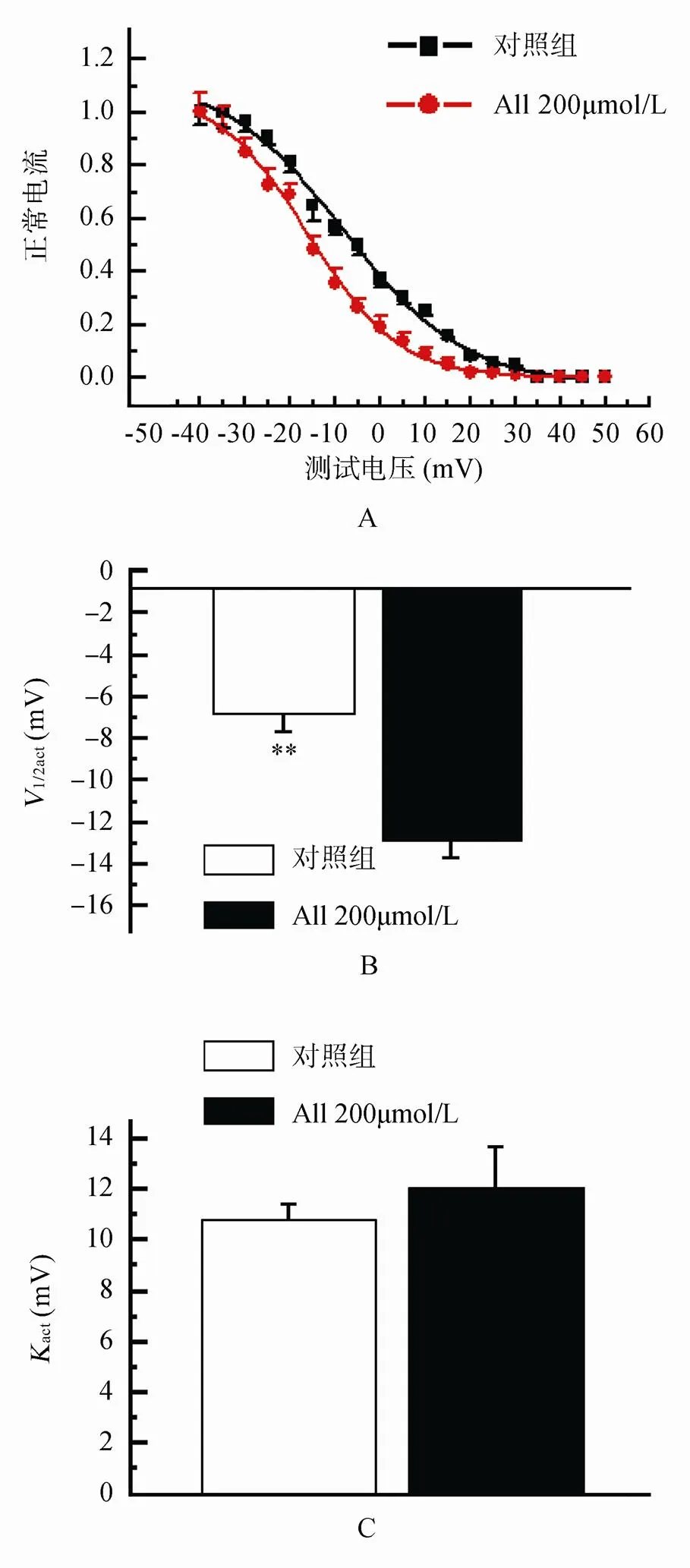
图5 All对兔心房肌细胞IKUr失活曲线的作用
Figure 5 Effect of allitridum on rabbit atrial myocytesKUrinactivation curve
A: 对KUr稳态失活曲线的作用; B: 对KUr半失活电压的作用; C: 对KUr失活曲线斜率的作用。与对照组比较,P<0.01
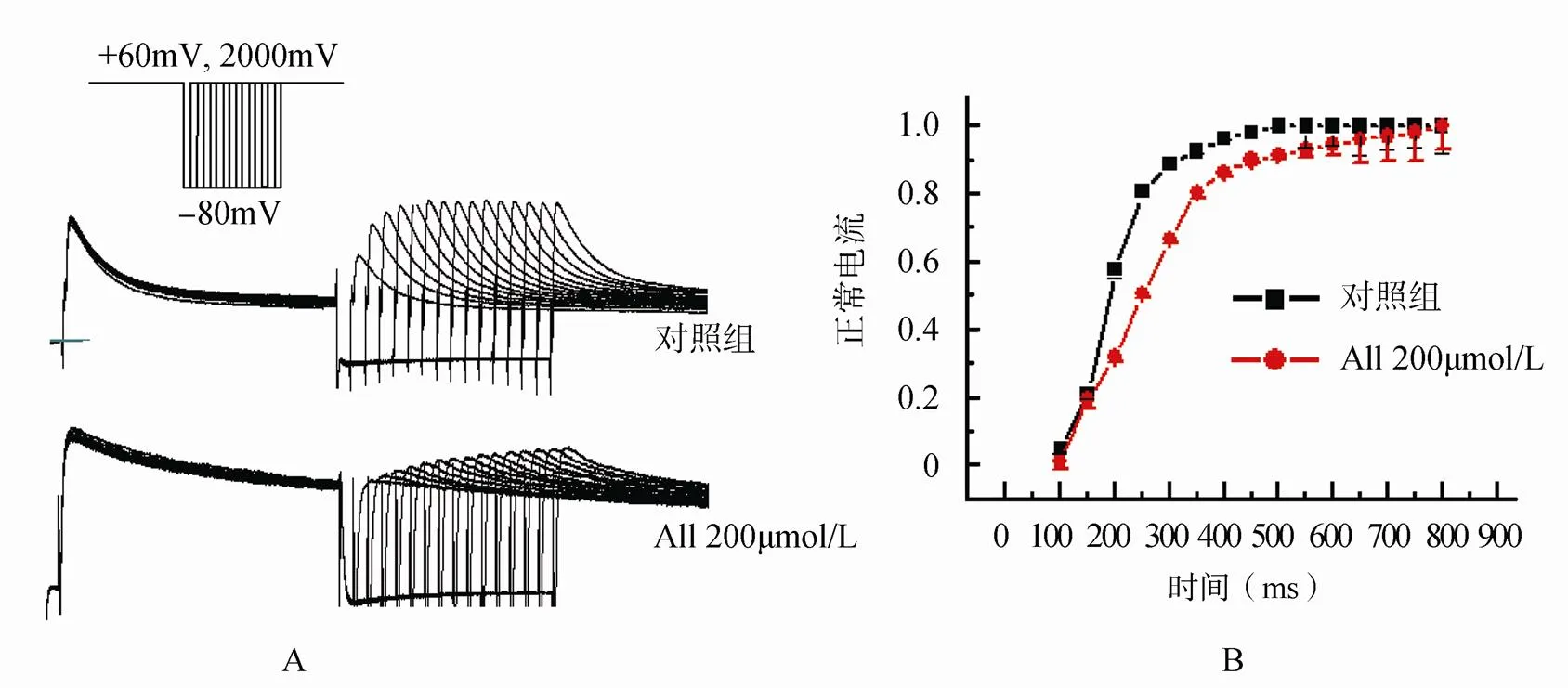
图6 All对兔心房肌细胞IKUr失活恢复动力学的影响
Figure 6 Effect of allitridum on rabbit atrial myocytesKUrrecovery from inactivation
A: 对KUr失活后恢复作用的原始记录; B: 对KUr恢复动力学曲线的作用
[1] Mcmanus DD, Rienstra M, Benjamin EJ. An update on the prognosis of patients with atrial fibrillation[J]. Circulation, 2012, 126(10): e143-e146.
[2] Nattel S, Carlsson L. Innovative approaches to anti-arrhythmic drug therapy[J]. Nat Rev Drug Discov, 2006, 5(12): 1034-1049.
[3] Ehrlich JR, Nattel S, Hohnloser SH. Novel anti-arrhythmic drugs for atrial fibrillation management[J]. Curr Vasc Pharmacol, 2007, 5(3): 185-195.
[4] 程 伟, 喻荣辉, 屈松柏. 大蒜素对豚鼠心房肌电生理的作用[J]. 中国中医基础医学杂志, 2002, 7(8): 35-37.
[5] 程 伟, 喻荣辉, 屈松柏. 大蒜素对豚鼠在体心电图、离体右房自律性及收缩性的影响[J]. 湖北中医杂志, 1997, 19(5): 46-47.
[6] Brouillette J, Clark RB, Giles WR,. Functional properties of k+currents in adult mouse ventricular myocytes[J]. J Physiol, 2004, 559(Pt 3): 777-798.
[7] Li GR, Feng J, Yue L,. Evidence for two components of delayed rectifier k+current in human ventricular myocytes[J]. Circ Res, 1996, 78(4): 689-696.
[8] Ehrlich JR, Bilicaki P, Hohnloder SH,. Atrial-selective approaches for the treatment of atrial fibrillation[J]. J Am Coll Cardiol, 2008, 51(8): 787-792.
[9] Ford JW, Milnes JT. New drugs targeting the cardiac ultra-rapid delayed-rectifier current (I Kur): rationale, pharmacology and evidence for potential therapeutic value[J]. J Cardiovasc Pharmacol, 2008, 52(2): 105-120.
[10] Islam MA. Pharmacological modulations of cardiac ultra-rapid and slowly activating delayed rectifier currents: potential antiarrhythmic approaches[J]. Recent Pat Cardiovasc Drug Discov, 2010, 5(1): 33-46.
[11] Ravens U, Wettwer E. Ultra-rapid delayed rectifier channels: molecular basis and therapeutic implications[J]. Cardiovasc Res, 2011, 89(4): 776-785.
[12] Blaauw Y, Gogelein H, Tieleman RG,. "Early" class Ⅲ drugs for the treatment of atrial fibrillation: efficacy and atrial selectivity of AVE0118 in remodeled atria of the goat[J]. Circulation, 2004, 110(13): 1717-1724.
[13] Regan CP, Stump GL, Wallace AA,.cardiac electrophysiologic and antiarrhythmic effects of an isoquinoline IKur blocker, ISQ-1, in rat, dog, and nonhuman primate[J]. J Cardiovasc Pharmacol, 2007, 49(4): 236-245.
[14] Regan CP, Wallace AA, Cresswell HK,.cardiac electrophysiologic effects of a novel diphenylphosphine oxide IKur blocker, (2-isopropyl-5-methylcyclohexyl) diphenylphosphine oxide, in rat and nonhuman primate[J]. J Pharmacol Exp Ther, 2006, 316(2): 727-732.
[15] Ford J, Milnes J, Wettwer E,. Human electrophysiological and pharmacological properties of XEN-D0101: A novel atrial selective Kv1.5/IKur inhibitor[J]. J Cardiovasc Pharmacol, 2013.
[16] Ravens U. Antiarrhythmic therapy in atrial fibrillation[J]. Pharmacol Ther, 2010, 128(1): 129-145.
(编辑: 王雪萍)
Effects of allitridum on ultra rapid delayed rectifier potassium current in rabbit atrial cardiomyocytes
CHEN Chen, WANG Yu, ZHANG De-Xian, FU Yi-Cheng, CHEN Xi, XU Bin, YANG Jie, YIN Tong, ZHU Qing-Lei, LI Yang*
(Institute of Geriatric Cardiology, Chinese PLA General Hospital, Beijing 100853, China)
To determine the effect of allitridum on the ultra rapid delayed rectifier potassium current (KUr) in single rabbit atrial cardiomyocyte, and investigate the mechanism of its anti-atrial arrhythmia.The dual enzymatic method was used to separate single rabbit atrial cardiomyocyte. The drug was appliedextracellular supserfusion, and current was evoked and recorded using Axon MultiClamp 700B amplifier.Allitridum at 200μmol/L exerted obvious inhibitory effect onKUrin normal rabbit atrial cardiomyocyte, and decreased the peak value from (14.5±3.2) to (7.9±1.2)pA/pF (<0.01,=15). Allitridum also resulted in a decrease in current-voltage curve, and the effect became more significant with the increase of depolarization potential, in a voltage-dependent manner. Allitridum also showed the inhibitory effect onKUrin a dose-dependent manner, with its IC50value of 149.6μmol/L. Allitridum caused a significant positive shift of the steady-state activation curve ofKUr, and then delayed the activation, while a markedly negative shift of the steady-state inactivation ofKUr, and so accelerated the inactivation. Furthermore, the drug markedly lengthened the time constants forKUrrecovery from inactivation, and decelerated the re-inactivation after inactivation. It decreased the channel open at many links, and reduced current density.Allitridum derived from Chinese herb, garlic bulb, potently blocksKUr, which might be the underlying cellular electrophysiological mechanism of its therapeutic effect on atrial arrhythmia.
allitridum; atrial cardiomyocytes; ultra rapid delayed rectifier potassium current; patch clamp technique
(No.30772886).
R285.5
A
10.3724/SP.J.1264.2013.00095
2013-03-18;
2013-04-03
国家自然科学基金(No. 30772886)
李 泱, Tel: 010-66936762, E-mail: liyangbsh@163.com

