不同性别骨密度和动脉硬化评估指标随增龄的变化
梁冬科, 白小涓
不同性别骨密度和动脉硬化评估指标随增龄的变化
梁冬科1, 白小涓2*
(1中国医科大学附属第一医院老年病科, 沈阳 110001;2中国医科大学附属盛京医院老年病干诊科, 沈阳 110004)
观察骨密度(BMD)和动脉硬化评估指标随增龄的变化。2011年对400名研究对象进行了BMD、踝臂指数(ABI)、脉搏波速度(PWV)和颈动脉内膜中层厚度(CIMT)测定。根据年龄分为<50岁、50~59岁、60~69岁和≥70岁4组;其中女性根据月经史分为未绝经、绝经1~10年、绝经11~20年和绝经>20年4组。髋部BMD女性各年龄组和绝经前后各组差异有统计学意义(<0.01),男性70岁以前各年龄组差异无统计学意义(>0.05);腰椎BMD女性70岁以前各年龄组和绝经20年以前各组差异有统计学意义(<0.01),男性各年龄组差异无统计学意义(>0.05)。ABI女性70岁以前各年龄组和绝经20年以前各组差异无统计学意义(>0.05),男性各年龄组差异无统计学意义(>0.05);PWV女性各年龄组和绝经前后各组差异有统计学意义(<0.01),男性≥70岁年龄组显著大于其他年龄组(<0.01);CIMT女性和男性各年龄组差异有统计学意义(<0.01,<0.05)。除男性腰椎BMD和ABI外,各指标均与年龄相关。女性和男性BMD和动脉硬化评估指标随增龄的变化特点不同。
骨密度; 骨质疏松; 动脉硬化; 踝臂指数; 脉搏波速度; 颈动脉内膜中层厚度
随着社会人口老龄化日益严重,衰老成为当今研究的热点。骨质疏松症和动脉硬化性疾病都属于衰老相关性疾病,二者不但严重影响人们的健康和生活质量,还加重了社会医疗负担。本研究应用三个指标评估动脉硬化,其中踝臂指数(ankle-brachial index,ABI)用于评估下肢的血流情况,脉搏波速度(pulse wave velocity,PWV)用于评估动脉僵硬度,颈动脉内膜中层厚度(carotid intima-media thickness,CIMT)用于评估动脉结构的改变。通过观察沈阳地区人群骨密度(bone mineral density,BMD)和动脉硬化评估指标随增龄的变化,为骨质疏松症和动脉硬化性疾病的早期预防和发现提供重要的理论依据。
1 对象与方法
1.1 对象
2007年9月至2008年6月对沈阳各社区的1500名自我评价健康的对象进行筛选,其中831名对象因既往病史或体格检查异常而被排除,其余669名对象于同一家医院进一步行血、尿常规、血糖、甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、血肌酐、血尿素氮、血尿酸、心电图和胸片检查,排除检查结果异常的164名对象,最终505名对象被视为健康人群。
2011年共有400名对象参加了随访,年龄37~87岁,男性171人,女性229人,研究对象均签署知情同意书。根据年龄分为<50岁、50~59岁、60~69岁和≥70岁共4组;女性根据月经史分为未绝经、绝经1~10年、绝经11~20年和绝经>20年共4组。
1.2 方法
1.2.1 BMD测定 采用双能X线吸收测定法测定BMD(法国Medilink公司生产,Osteocore 2型)。测量部位包括腰椎(L2-L4)和髋部(包括股骨颈、大转子和转子间区),单位为g/cm2,变异系数分别为0.98%和0.77%。
1.2.2 PWV和ABI测定 采用全自动动脉硬化测量仪(日本科林公司生产VP-1000,PWV/ABI型)测定臂踝PWV,双侧肱动脉和胫前动脉血压采样点之间的距离根据研究对象身高(H,单位cm)自动计算所得,从胸骨上切迹到肘部的路径长度(△Da)用下列公式计算:△Da=0.2195×H-2.0734;从胸骨上切迹到脚踝的路径长度(△Db)用下列公式计算:△Db=0.8129×H+12.328。两个不同部位的压力波形被同时测量,以确定肱动脉和胫前动脉波形的上升段起始点之间的时间间隔(Ta),用下列公式计算PWV:PWV=(△Db-△Da)/Ta。ABI=胫前动脉收缩压/肱动脉收缩压,以上计算由仪器自动完成。研究对象至少休息10min后测量。组内变异系数为2.36%,组间变异系数为4.99%。
1.2.3 CIMT测定 采用飞利浦iE33彩色多普勒超声仪测量颈总动脉长轴第一条线状较高回声的前缘到第二条线状较高回声的前缘的垂直距离作为CIMT。变异系数为2.92%。
1.3 统计学处理
以SPSS18.0统计软件包进行统计分析,应用Kolmogorov-Smimov方法进行正态性检验,计量资料以均数±标准差表示,组间差异显著性检验采用单因素方差分析和协方差分析,组间两两比较采用LSD法;采用Pearson相关分析评价BMD、ABI、PWV和CIMT与年龄之间的相关性。
2 结 果
2.1 BMD、ABI、PWV和CIMT各个年龄组之间的比较
BMD,ABI,PWV和CIMT各个年龄组之间的比较见表1。女性髋部BMD各个年龄组之间差异有统计学意义(<0.01),而腰椎BMD 60~69岁和≥70岁年龄组之间差异无统计学意义(>0.05);男性髋部BMD<50岁、50~59岁和60~69岁年龄组之间差异无统计学意义(>0.05),≥70岁年龄组髋部BMD显著低于<50岁和50~59岁年龄组(<0.05),但与60~69岁年龄组之间差异无统计学意义(>0.05)。
女性ABI<50岁、50~59岁和60~69岁年龄组之间差异无统计学意义(>0.05),≥70岁年龄组ABI显著低于其他年龄组(<0.01),PWV和CIMT各个年龄组之间差异有统计学意义(<0.01);男性ABI各个年龄组之间差异无统计学意义(>0.05),PWV60~69岁年龄组显著大于<50岁年龄组(<0.01),≥70岁年龄组PWV显著大于其他年龄组(<0.01),CIMT各个年龄组之间差异有统计学意义(<0.05)。
2.2 BMD,ABI,PWV和CIMT与年龄的相关性
BMD、ABI、PWV和CIMT与年龄的相关性见表2。女性BMD、ABI、PWV和CIMT与年龄显著相关,男性髋部BMD、PWV和CIMT与年龄显著相关。
2.3 女性BMD,ABI,PWV和CIMT绝经前后的比较
女性BMD、ABI、PWV和CIMT绝经前后的比较见表3。女性髋部BMD在各组之间差异有统计学意义(<0.01),在控制年龄因素后差异仍有统计学意义。腰椎BMD绝经11~20年组和绝经>20年组差异无统计学意义(>0.05)。

表1 BMD、ABI、PWV和CIMT各个年龄组之间的比较
注: BMD: 骨密度; ABI: 踝臂指数; PWV: 脉搏波速度; CIMT: 颈动脉内膜中层厚度。与<50岁年龄组比较,*<0.05,**<0.01; 与50~59岁年龄组比较,#<0.05,##<0.01; 与60~69岁年龄组比较,△△<0.01

表2 BMD、ABI、PWV和CIMT与年龄的相关分析
注: BMD: 骨密度; ABI: 踝臂指数; PWV: 脉搏波速度; CIMT: 颈动脉内膜中层厚度
女性ABI在未绝经组、绝经1~10年组和绝经11~20年组之间差异无统计学意义(>0.05),绝经>20年组较其他三组明显下降(<0.01),在控制年龄因素后差异仍有统计学意义。女性PWV在各组之间差异有统计学意义(<0.01),在控制年龄因素后差异仍有统计学意义。女性CIMT在各组之间差异有统计学意义(<0.05),但是在控制年龄因素后差异无统计学意义(>0.05)。
3 讨 论
本研究发现女性髋部BMD各个年龄组之间差异有统计学意义,与年龄呈负相关,且绝经后比绝经前明显下降,绝经年数越长,BMD下降越多,在控制年龄因素后差异仍有统计学意义。绝经是骨质疏松的危险因素,绝经后骨质疏松症一般发生在女性绝经后5~10年内[1]。国外研究发现绝经后第1年骨吸收显著大于骨形成,BMD明显降低,绝经后第2年最明显,骨丢失可达6%~7%,这种骨丢失以后逐渐减弱直到绝经后第7年停止,骨吸收和骨形成达到平衡,但骨丢失已达到14%~15%[2]。国外另一项研究发现女性绝经后早期快速的骨丢失在绝经后7~9年减弱,绝经后10~12年,骨丢失再次开始,有学者推测这种变化是雌激素依赖性骨丢失向非雌激素依赖性骨丢失的转变[3]。另外,采用双能X线吸收测定法测定BMD属于二维成像,不能很好地反映出椎体的结构,因此腰椎的退行性改变,例如骨赘和终板硬化,可能导致腰椎BMD测量值比实际值高[4],本研究发现女性腰椎BMD≥70岁和60~69岁年龄组差异无统计学意义可能与此有关。
男性髋部BMD<50岁、50~59岁和60~69岁年龄组之间差异无统计学意义,而≥70岁较<50岁和50~59岁年龄组明显下降,说明男性髋部BMD70岁之前相对稳定,70岁以后显著下降,与国外研究结果一致[5]。男性腰椎BMD四个年龄组之间差异无统计学意义,腰椎BMD与年龄无相关性,可能与以下因素有关:(1)男性腰椎BMD70岁之前相对稳定;(2)男性70岁以后腰椎BMD可能显著下降,但因本研究采用双能X线吸收测定法测定BMD,腰椎的退行性改变可能导致腰椎BMD测量值比实际值高[4],未能反映真实情况。
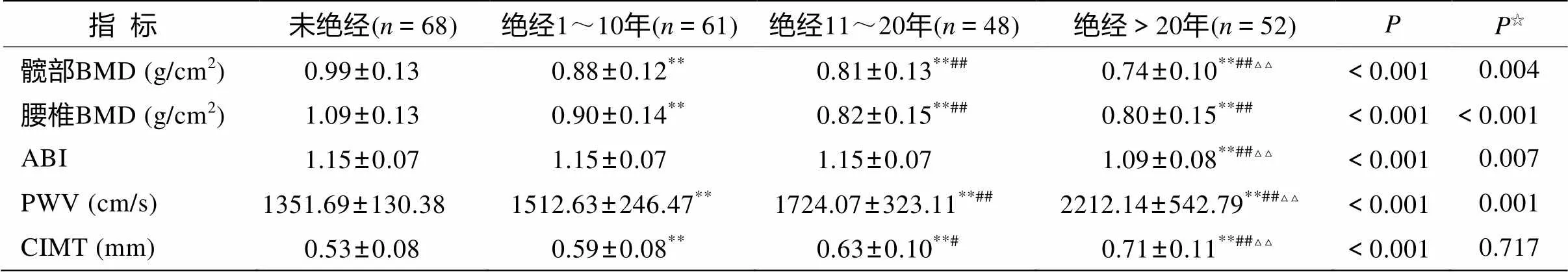
表3 女性BMD、ABI、PWV和CIMT绝经前后的比较
注: BMD: 骨密度; ABI: 踝臂指数; PWV: 脉搏波速度; CIMT: 颈动脉内膜中层厚度。☆以年龄为协变量进行协方差分析。与未绝经组比较,P<0.01; 与绝经1~10年组比较,P<0.05,##<0.01; 与绝经11~20年组比较,△△<0.01
本研究发现女性ABI与年龄呈负相关,<50岁、50~59岁和60~69岁年龄组之间差异无统计学意义,≥70岁年龄组ABI显著低于其他年龄组,而且ABI在未绝经组、绝经1~10年组和绝经11~20年组之间差异无统计学意义,绝经>20年组较其他三组明显下降,在控制年龄因素后差异仍有统计学意义。以上结果说明女性增龄和绝经对动脉硬化的影响,在70岁以后和绝经20年以后才出现ABI的明显下降。动脉硬化可能需要达到一定程度,才能引起血流的减少,表现在ABI的下降。而男性ABI变化与年龄无相关性。
国内外研究已证实PWV与年龄显著相关[6,7]。本研究发现女性PWV各个年龄组之间差异有统计学意义,且与年龄呈显著正相关,PWV在未绝经组、绝经1~10年组、绝经11~20年组和绝经>20年组之间差异有统计学意义,绝经后比绝经前明显加快,绝经年数越长,PWV越快,在控制年龄因素后差异仍有统计学意义。以上结果说明,女性增龄和绝经对动脉硬化的影响明显体现在动脉僵硬度的升高。而男性则不同,男性PWV虽然与年龄呈显著正相关,但是50~59岁与<50岁年龄组差异无统计学意义,60~69岁与50~59岁年龄组差异无统计学意义,70岁以后PWV才显著大于其他年龄组。以上结果说明男性动脉僵硬度在70岁以前相对稳定,70岁以后动脉僵硬度明显升高。
女性CIMT各个年龄组之间差异有统计学意义,且与年龄呈显著正相关,CIMT在未绝经组、绝经1~10年组、绝经11~20年组和绝经>20年组之间差异有统计学意义,绝经后比绝经前明显增厚,绝经年数越长,CIMT越厚,但是在控制年龄因素后差异无统计学意义。以上结果说明女性CIMT主要与增龄有关,绝经对CIMT无影响。本研究发现男性CIMT各个年龄组之间差异有统计学意义,且与年龄呈显著正相关,亦可证明CIMT主要与增龄有关。
本研究发现女性在50岁以后或者绝经后动脉僵硬度即开始升高,当70岁以后或者绝经20年以后,动脉僵硬度已经历长时间的变化,动脉弹性明显下降,因而引起远端血管血流减少,表现为ABI下降。而男性中,动脉僵硬度在70岁以前相对稳定,70岁以后才明显升高,动脉僵硬度变化时间较女性短,因而未引起ABI下降。本研究人群CIMT未达到动脉硬化闭塞的程度,因而不影响血流的减少,即ABI的下降。
骨质疏松和动脉硬化都属于受多因素影响,伴随着衰老的退行性疾病,二者有共同的危险因素和致病途径[8]。雌激素缺乏是公认的骨质疏松和动脉硬化的危险因素。OPG/RANK/RANKL系统对动脉硬化[9]和骨丢失[10]都有影响。骨形成蛋白在血管平滑肌细胞钙化中起作用[11]。炎症反应可以同时导致骨质疏松和动脉钙化[12,13]。通常在动脉硬化病变处发现的氧化的脂质,能够作用于成骨细胞,抑制无机磷酸盐信号和无机磷酸盐诱导的矿化作用[14]。目前,有学者提出了骨血管轴的概念[15],可见骨质疏松和动脉硬化的关系密切。本研究观察了骨密度和动脉硬化评估指标随增龄的变化,关于二者的关系有待进一步研究。
综上所述,女性和男性BMD随增龄的变化特点不同,与女性绝经有关。不同动脉硬化评估指标随增龄的变化特点亦不同。女性PWV和CIMT随增龄变化明显,早于ABI的变化。男性CIMT随增龄变化明显,早于PWV的变化,但是ABI随增龄无变化。因此,女性随着年龄的增长,尤其绝经以后,应定期行BMD、PWV和CIMT的测定,早期预防和发现骨质疏松症和动脉硬化性疾病。男性70岁之前可定期行CIMT测定,70岁以后应定期行BMD和PWV的测定,早期预防和发现骨质疏松症和动脉硬化性疾病。本研究为横断面研究,还需行纵向研究进一步证实。
[1] 中华医学会骨质疏松和骨矿盐疾病分会. 原发性骨质疏松症诊治指南(2011年)[J]. 中华骨质疏松和骨矿盐疾病杂志, 2011, 4(1): 2-17.
[2] Mazzuoli G, Acca M, Pisani D,. Annual skeletal balance and metabolic bone marker changes in healthy early postmenopausal women: results of a prospective study[J]. Bone, 2000, 26(4): 381-386.
[3] Okano H, Mizunuma H, Soda M,. The long-term effect of menopause on postmenopausal bone loss in Japanese women: results from a prospective study[J]. J Bone Miner Res, 1998, 13(2): 303-309.
[4] von der Recke P, Hansen MA, Overgaard K,. The impact of degenerative conditions in the spine on bone mineral density and fracture risk prediction[J]. Osteoporos Int, 1996, 6(1): 43-49.
[5] Indridason OS, Franzson L, Sigurdsson G. Serum osteoprotegerin and its relationship with bone mineral density and markers of bone turnover[J]. Osteoporos Int, 2005, 16(4): 417-423.
[6] Filipovský J, Tichá M, Cífková R,. Large artery stiffness and pulse wave reflection: results of a population-based study[J]. Blood Press, 2005, 14(1): 45-52.
[7] 康秀芬, 张颖莹, 韩际奥, 等. 健康人1562名臂踝脉搏波速度及其影响因素初探[J]. 中国心血管杂志, 2010, 15(2): 110-112.
[8] Anagnostis P, Karagiannis A, Kakafika AI,. Atherosclerosis and osteoporosis: age-dependent degenerative processes or related entities[J]? Osteoporos Int, 2009, 20(2): 197-207.
[9] Ndip A, Williams A, Jude EB,. The RANKL/RANK/OPG signaling pathway mediates medial arterial calcification in diabetic Charcot neuroarthropathy[J]. Diabetes, 2011, 60(8): 2187-2196.
[10] Khosla S. Minireview: the OPG/RANKL/RANK system[J]. Endocrinology, 2001, 142(12): 5050-5055.
[11] Panizo S, Cardus A, Encinas M,. RANKL increases vascular smooth muscle cell calcification through a RANK-BMP4-dependent pathway[J]. Circ Res, 2009, 104(9): 1041-1048.
[12] Hjortnaes J, Butcher J, Figueiredo JL,. Arterial and aortic valve calcification inversely correlates with osteoporotic bone remodelling: a role for inflammation[J]. Eur Heart J, 2010, 31(16): 1975-1984.
[13] New SE, Aikawa E. Molecular imaging insights into early inflammatory stages of arterial and aortic valve calcification[J]. Circ Res, 2011, 108(11): 1381-1391.
[14] Mazière C, Savitsky V, Galmiche A,. Oxidized low density lipoprotein inhibits phosphate signaling and phosphate-induced mineralization in osteoblasts. Involvement of oxidative stress[J]. Biochim Biophys Acta, 2010, 1802(11): 1013-1019.
[15] Fadini GP, Rattazzi M, Matsumoto T,. Emerging role of circulating calcifying cells in the bone-vascular axis[J]. Circulation, 2012, 125(22): 2772-2781.
(编辑: 周宇红)
Alteration of bone mineral density and arteriosclerosis indices with aging in different sex
LIANG Dong-Ke1, BAI Xiao-Juan2*
(1Department of Gerontology and Geriatrics, First Affiliated Hospital, China Medical University, Shenyang 110001, China;2Department of Gerontology and Geriatrics, Shengjing Hospital, China Medical University, Shenyang 110004, China)
To observe the changes of bone mineral density (BMD) and atherosclerosis indexes with the increase of age.A total of 400 healthy participants who were selected through physical examination from 1500 self-estimated healthy individuals from several communities of Shenyang City from September 2007 to June 2008 were followed up in 2011 for their BMD, ankle-brachial index (ABI), pulse wave velocity (PWV), and carotid intima-media thickness (CIMT). They were assigned into four different age groups, <50 years, 50-59 years, 60-69 years, and ≥70 years. The women were divided into another 4 groups, premenopausal, 1-10 years since menopause, 11-20 years since menopause, and>20 years since menopause.There were significant differences in total hip BMD among the women from different age groups and among those with menopause or not(<0.01). But for men, there was no difference in total hip BMD in those younger than 70 years. Significant differences were also found in lumbar spine BMD among women younger than 70 years and among those with menopause shorter than 20 years. No difference was found in lumbar spine BMD among the men in different age groups. No difference was seen in ABI among the women of different age groups younger than 70 years and among the menopause groups shorter than 20 years since menopause. Neither were the men from different age groups. There were significant differences in PWV among women from different age groups and among the groups with menopause or not. In men, PWV was higher in ≥70 years group than in other age groups. The differences of CIMT were significant in both women and men among age groups. In women, the BMD, ABI, PWV, and CIMT were correlated with age. In men, the total hip BMD, PWV, and CIMT were correlated with age.The changes of BMD and atherosclerosis indices with aging are different between women and men.
bone mineral density; osteoporosis; arteriosclerosis; ankle-brachial index; pulse wave velocity; carotid intima-media thickness
(2007CB507405, 2013CB530804),(No.2007225004).
R592; R59; R543.5
A
10.3724/SP.J.1264.2013.00082
2013-04-03;
2013-04-25
国家重点基础研究发展计划基金(2007CB507405; 2013CB530804); 辽宁省科学技术厅课题基金(No.2007225004)
白小涓, Tel: 024-83282770, E-mail: xjuanbai@hotmail.com

