Shc相关磷酸化酪氨酸适配蛋白在大鼠血管衰老中的调控作用
单海燕, 张四杨, 赵 心, 李 婉, 于 凯, 白小涓
Shc相关磷酸化酪氨酸适配蛋白在大鼠血管衰老中的调控作用
单海燕1*, 张四杨2, 赵 心1, 李 婉1, 于 凯1, 白小涓3
(中国医科大学:1附属第一医院老年病科,2实验技术中心三部, 沈阳 110001;3中国医科大学附属盛京医院老年病干诊科, 沈阳 110004)
探讨Shc相关磷酸化酪氨酸适配蛋白p66shc在血管衰老表达的变化,对阐明血管衰老对动脉粥样硬化的诊治具有重要意义。将Wistar大鼠分为4、10、16、24月龄组,测定各组血浆丙二醛(MDA)、超氧化物歧化酶(SOD)水平,同时采用恒速注入流体方法测定大鼠颈动脉血管的顺应性,并利用蛋白免疫印迹法分析各组p66shc、半胱氨酸天门冬氨酸蛋白酶-3水平。随增龄,大鼠主动脉管壁增厚,纤维化程度增高,MDA浓度明显升高(与4月龄和10月龄相比,均<0.01),SOD浓度明显降低(与4月龄相比,均<0.01;与10月龄相比,均<0.05),颈动脉血管的顺应性增高、弹性速率和弹性面积的差异有统计学意义(与4月龄相比,均<0.01;与10月龄相比,均<0.05),p66shc、Caspase-3蛋白表达呈时间依赖性上调。血管衰老性重塑的分子机制之一可能与上调p66shc、Caspase-3蛋白的表达有关,进一步阐明其调控机制可为延缓血管衰老、防治动脉硬化提供理论依据。
Shc; p66; 半胱氨酸天门冬氨酸蛋白酶-3; 血管衰老; 动脉硬化; 基因调控
衰老是心血管疾病的独立危险因素,大量研究指出,血管结构、功能随增龄发生改变,即血管衰老直接改变了各种心血管疾病的病理生理机制,从而改变了疾病发生的阈值、严重程度和预后。增龄相关动脉弹性降低常出现于动脉硬化和心血管事件之前,血管衰老改变了各种心血管病发生的阈值和严重程度,显著增加了心血管疾病发生的危险性[1,2],故增龄成为心血管疾病的首位危险因素。近年来,Shc相关磷酸化酪氨酸适配蛋白(66-kilodalton isoform of Shc gene products,p66shc)在长寿中的作用引起极大的关注,p66shc可能在衰老相关性疾病,如神经退化性疾病和老年痴呆症中起重要的作用[3],但其引起血管衰老的机制尚不清楚,故本文通过测定衰老大鼠动脉血管顺应性、p66shc和凋亡相关基因半胱氨酸天门冬氨酸蛋白酶-3(Cysteinylasparate specific proteinase-3,Caspase-3)的变化,旨在从分子水平阐明动脉衰老的机理,为防治动脉硬化开辟新途径。
1 材料与方法
1.1 实验动物及分组
60只健康雄性Wistar大鼠(中国医科大学实验动物中心提供),按月龄分为4组(4、10、16、24月龄组),每组15只,常规饲养10d。
1.2 主动脉取材
HX-2型小动物血压计测量鼠尾收缩压,称重后,大鼠腹腔注射2%戊巴比妥钠(45mg/kg)麻醉后,开胸心腔取血及胸主动脉组织,检测相关指标。
1.3 主动脉形态学观察
主动脉常规石蜡包埋,连续切片,片厚5μm,HE染色光镜下观察血管一般形态,HPLAS-1000型图像分析系统检测内膜中膜厚度、血管内径、内膜中膜厚度/内径;Masson染色后分析平滑肌(smooth muscle cell,SMC)、胶原纤维(collagen fiber,CF)在各血管壁中的相对含量(Aa%)。
1.4 血浆丙二醛(malonaldehyde, MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测
硫代巴比妥酸法测定血浆MDA,黄嘌呤氧化酶法测定血浆SOD。
1.5 颈动脉顺应性测定
选定长度为1cm的血管段,一端套在比颈动脉管径略粗的硬塑料管上,并用手术缝合线扎紧。硬塑料管与生理记录仪的血压换能器连接。整个系统用生理盐水充满并排除气泡。血压换能器和塑料管通过三通阀门与恒速注射器连通,用1ml注射器配合恒速注射器以3.67µl/s为单位,拉力/斜率以mmHg/s为单位,曲线下面积以µmol/L为单位。这两个指标均以压力从基线上升至3s这段曲线为计算依据。斜率与曲线下面积升高表示血管顺应性下降。
1.6 Western印记法检测主动脉p66shc、Caspase-3的蛋白水平
取100mg胸主动脉组织放入试管,加入600µl RIPA进行冰浴匀浆,4℃,12000r/min离心10min后上清液至新试管中,再次离心一次,取上清分装,-20℃保存待用。考马斯亮蓝法测定蛋白质样品浓度,每个样品上样量为20μl,常规蛋白质电泳分离胶浓度为12%(pH8.8),浓缩胶浓度4%(pH6.8),抽提纯化的蛋白质行SDS-PAGE电泳后转移至PVDF膜,5%脱脂奶粉的TBST 4℃封闭过夜,加入一抗(兔抗大鼠p66shc、Caspase-3,1∶100)室温摇床孵育3h,TBST洗涤后,与二抗室温摇床孵育0.5h,常规洗膜化学发光试剂显色,Alpha Imager图像处理系统扫描测定感光区带平均积分吸光度。β-actin为内参照,计算相对含量。
1.7 统计学处理

2 结 果
2.1 大鼠的一般状况
各组大鼠生活状况良好,体质量正常,随增龄收缩压呈时间依赖性升高(与4月龄和10月龄比较,<0.05或<0.01;表1)。
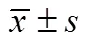
表1 不同月龄组大鼠收缩压变化比较
注: 与4月龄组比较,*<0.05,*<0.01; 与10月龄组比较,#<0.05,##<0.01
2.2 主动脉形态结构变化
校正收缩压、体质量影响后,4、10、16月龄组内膜中膜厚度、内径、内膜中膜厚度/内径及胶原纤维、平滑肌含量随增龄逐渐升高(与4月龄比较,<0.01;与10月龄比较,<0.05或<0.01),但24月龄组与16月龄组比较差异无统计学意义(>0.05;表2)。
2.3 血浆MDA、SOD含量及动脉顺应性
随增龄,血浆MDA浓度呈时间依赖性升高(与4月龄和10月龄相比,均<0.01),SOD浓度呈时间依赖性降低(与4月龄相比,均为<0.01;与10月龄相比,均为<0.05);随增龄,弹性速率和弹性面积升高(与4月龄比较,均<0.01;与和10月龄比较,均<0.01;表3)。
2.4 p66shc、Caspase-3蛋白表达
Western印记法显示,4月龄组仅有微量的p66shc、Caspase-3蛋白表达,其后,它们的表达随增龄逐渐增高,24月龄组时至高峰(<0.01,图1、2)。
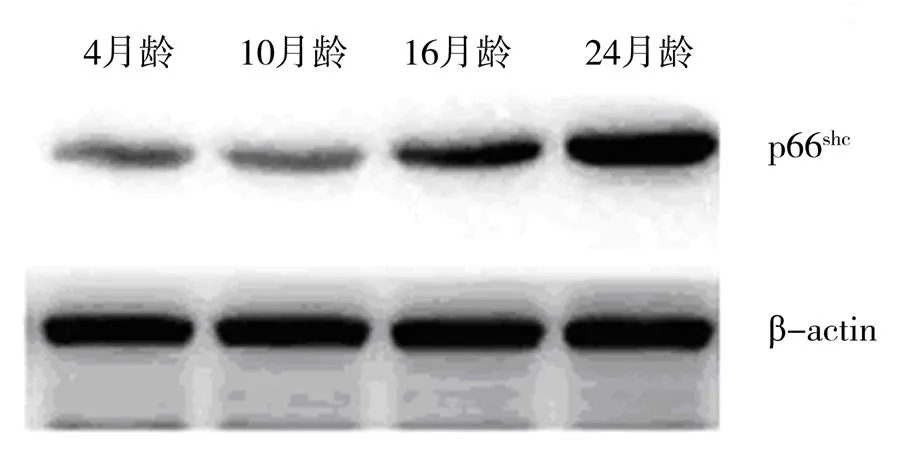
图1 不同月龄大鼠主动脉p66shc蛋白表达的比较
Figure 1 Western blotting analysis of p66shcprotein expression in 4 groups
3 讨 论
血管衰老是一种重要而必然的生理现象,其发生有多方面的因素,与遗传因素、环境影响、表观遗传修饰和疾病等有关。血管衰老的生理改变主要是血管顺应性降低,主动脉血管顺应性降低是造成老年收缩压升高的主要原因[1,2,4]。本实验血管顺应性测定发现,衰老组弹性速率和弹性面积升高,其中弹性面积差异统计学意义(<0.05);氧化应激是衰老的重要诱发原因之一,通过刺激细胞凋亡,进而引起机体的衰老,而脂褐素是机体氧化应激的产物,其是衰老的重要标志产物之一,MDA是脂褐素形成过程的中间产物,它能间接反映机体内氧化应激过程中脂质过氧化水平,MDA升高和SOD下降是衰老的重要表现。大量研究证实,衰老时MDA水平显著升高而SOD明显下降,这与本研究结果相一致[5]。
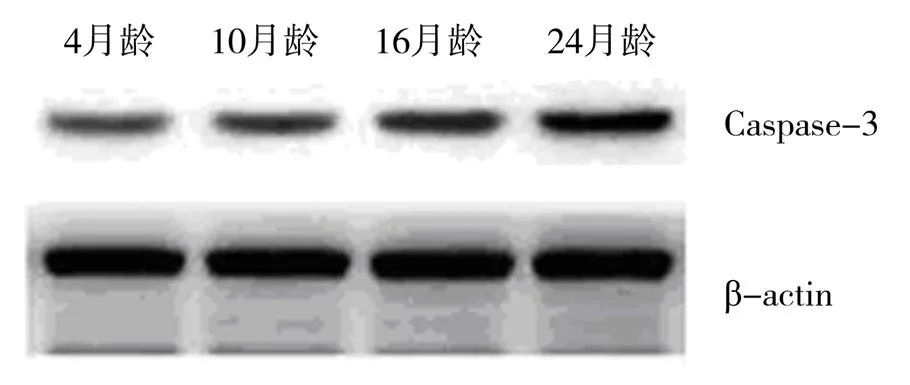
图2 不同月龄大鼠主动脉Caspase-3蛋白表达的比较
Figure 2 Western blotting analysis of Caspase-3 protein expression in 4 groups
近年来,国内外关于细胞衰老的研究主要集中在基因调控方面的研究,但血管衰老过程中缺乏精确可靠的细胞和生化标志物,阻碍了对血管衰老本质及其后继效应的鉴别研究[6,7]。在前期血管衰老的机制研究中,我们课题组已观察到衰老大鼠血管Caspase-3的mRNA及蛋白表达水平降低可能是血管衰老的重要分子机制之一。本实验通过对凋亡相关基因Caspase-3蛋白检测发现,随增龄Caspase-3表达增强,正常情况下,Caspase-3以酶原形式存在于细胞中,可经线粒体依赖性途径和细胞表面死亡受体信号通路激活,活化后的Caspase-3切割蛋白质底物,破坏细胞内多种蛋白酶复合体,激活核内核酸酶,造成DNA损伤,从而导致细胞凋亡及衰老[5,6]。目前,p66Shc在长寿中的作用引起极大的关注,p66Shc蛋白是ShcA基因编码的3种蛋白之一,其余两种是p46Shc、p52Shc。尽管3种Shc蛋白均属于酪氨酸磷酸化,并且导致诱导生长因子的产生,但是研究发现其具有不同的生物学作用。p66ShcN端包含一个富含脯氨酸结构域(CH2),研究发现其在p66Shc调节氧化应激和凋亡及衰老过程中起到重要的作用。有研究表明:p66shc敲除小鼠可以延长30%的寿命,且对氧化应激抵抗增加[3,6];p66shc突变体小鼠,显示寿命周期延长,细胞内氧化物产生下降,抵制氧化应激诱导的凋亡发生,具有抗心血管疾病、衰老及糖尿病的作用[9,10]。p66shc蛋白是ShcA基因编码的3种亚型蛋白之一[3,7,8],研究发现其参与了氧化应激、细胞凋亡及衰老等过程的调控[9-11]。本研究结果提示,p66shc一方面能促进活性氧自由基(reactive oxygen species,ROS)的产生,另一方面能下调SOD、过氧化氢酶表达水平,导致ROS的水平增多,促进了细胞凋亡及衰老。在衰老发生过程中,p66shc参与了线粒体ROS的产生,通过影响线粒体钙稳定,降低膜电位,导致细胞色素C释放以及Caspase-3活化,而p66shc-ser36磷酸化是这一过程的关键,同时不能排除其他机制参与的可能。
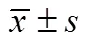
表2 不同月龄组大鼠主动脉形态结构分析
注: T: 内膜中膜厚度; D: 血管内径; T/D: 内膜中膜厚度/内径; SMC Aa%: 平滑肌在血管壁中的相对含量; CF Aa%: 胶原纤维在血管壁中的相对含量。与4月龄组比较,**<0.01; 与10月龄组比较,#<0.05,##<0.01
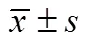
表3 不同月龄大鼠血浆MDA、SOD浓度和主动脉血管顺应性的比较
注: MDA: 丙二醛; SOD: 超氧化物歧化酶。与4月龄组比较,**<0.01; 与10月龄组比较,#<0.05,##<0.01
综上所述,本研究发现,随增龄Caspase-3、p66shc的含量均明显升高,提示二者均参与了氧化应激和衰老过程,这可能为将来对延缓血管衰老的研究提供一种新的策略,即通过抑制p66shc/Caspase-3通路来延缓血管老化,为防治动脉硬化开辟新途径。
[1] Herrera MD, Mingorance C, Rodriguez RR,. Endothelial dysfunction and aging: an update [J]. Ageing Res Rev, 2010, 9(2): 142-152.
[2] Laschober GT, Ruli D, Hofer E,. Identification of evolutionarily conserved genetic regulators of cellular aging[J]. Aging Cell, 2010, 9(6): 1084-1097.
[3] Suski JM, Karkucinska WA, Lebiedzinska M,. p66Shcaging protein in control of fibroblasts cell fate[J]. Int J Mol Sci, 2011, 12(8): 5373-5389.
[4] Tzivion G, Hay N. PI3K-AKT-FoxO axis in cancer and aging[J]. Biochim Biophys Acta, 2011, 1813(11): 1925.
[5] 单海燕, 白小涓, 陈香美. 衰老生物学标志的研究进展[J]. 中华老年医学杂志, 2008, 27(4): 309-312.
[6] Tiberi L, Faisal A, Rossi M,. p66Shc gene has a pro-apoptotic role in human cell lines and it is activated by a p53-independent pathway[J]. Biochem Biophys Res Commun, 2006, 342(2): 503-508.
[7] Lakatta EG, Levy D. Arterial and cardiac aging: major shareholders in cardiovascular disease enterprises part I: aging arteries: a "set up" for vascular disease[J]. Circulation, 2003, 107(1): 139-146.
[8] Shan HY, Bai XJ, Chen XM. AngiotensinⅡ induces endothelial cell senescencethe activation of mitogen-activated protein kinases[J]. Cell Biochem Funct, 2008, 26(4): 459-466.
[9] Paneni F, Cosentino F. p66Shcas the engine of vascular aging[J]. Curr Vasc Pharmacol, 2012, 10(6): 697-699.
[10] Afanas'ev I. Reactive oxygen species and age-related genes p66shc, Sirtuin, FOX03 and Klotho in senescence[J]. Oxid Med Cell Longev, 2010, 3(2): 77-85.
[11] Cosentino F, Francia P, Camici GG,. Final common molecular pathways of aging and cardiovascular disease: role of the p66Shcprotein[J]. Arterioscler Thromb Vasc Biol, 2008, 28(4): 622-628.
(编辑: 胡晓晖)
Regulatory effects of Shc-related phosphotyrosine adaptor proteins on vascular aging in rats
SHAN Hai-Yan1*, ZHANG Si-Yang2, ZHAO Xin1, LI Wan1, YU Kai1, BAI Xiao-Juan3
(1Department of Gerontology, First Affiliated Hospital;2Department 3, Center of Experimental Technologies, China Medical University, Shenyang 110001, China;3Department of Gerontology and Geriatrics, Shengjing Hospital, China Medical University, Shenyang 110004, China)
p66shc(66-kilodalton isoform of Shc gene products) gene, encoding a phosphotyrosine signal adapter protein, is confirmed to extend life span by 30%. Our aim was to determine the expression of Shc-related phosphotyrosine adaptor proteins in rat vascular aging in order to elucidate the value of vascular aging in the diagnosis and treatment of atherosclerosis.A total of 60 Wistar rats were divided into 4 groups according to age, that is 4, 10, 16 and 24 months old rats respectively. Aorta plasma levels of malondialdehyde (MDA) and superoxide dismutase (SOD) were detected, and the compliance of rat carotid segment was measured by constant liquid injection. Western blotting was used to detect the expression of p66shcand caspase-3 in the healthy rats of different ages.With aging, aorta wall was thickened with more severe fibrosis. MDA content in the rats of 16 and 24 months old was evidently ascended when compared with 4 and 10 months old (<0.01), but that of SOD was markedly declined (<0.01 compared with that of 4 month old rats;<0.05 compared with that of 10 month old rats). The carotid flexibility was increased, especially flexibility area was significantly different (<0.01 compared with that of 4 month old rats;<0.05 compared with that of 10 month old rats). The expression of p66shcand Caspase-3 at protein level was increased in a time-dependent manner.The molecular mechanism of vascular aging might be associated with up-regulaton of p66shcand Caspase-3 with aging. Its underlying mechanism may provide theoretical basis for slowing down of vascular aging, and prevention and treatment of atherosclerosis.
Shc; p66; cysteinylasparate specific proteinase-3; vascular aging; arteriosclerosis; gene regulation
(No.81200245),(No.20122104120003),(No.2012225091, No.201202263),(F10-205-1-44)
R339.3; R592; R541
A
10.3724/SP.J.1264.2013.00086
2013-04-03;
2013-04-23
国家自然科学基金(No.81200245); 高等学校博士学科点专项科研基金联合资助课题(No.20122104120003); 辽宁省科学技术研究项目(No.2012225091, No.201202263); 沈阳市科学技术计划项目(F10-205-1-44)
单海燕, Tel: 024-83282776, E-mail: shanhy024@163.com

