非顺应球囊高压处理半顺应球囊不能扩张的冠状动脉病变的临床应用
崔锦钢 田涛 管浩 王天杰 胡奉环 杨伟宪 袁建松 吴永健 杨跃进 乔树宾
僵硬钙化的冠状动脉病变的经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)仍然是一个巨大的挑战。常规顺应性球囊无法扩张的冠状动脉病变是介入性心脏病专家面对的严重问题。不能完全扩张的病变可能会导致支架不能通过或支架不能充分扩张,从而增加了支架急性血栓形成及支架内再狭窄的风险[1]。正确地识别、评估钙化病变,选择恰当的介入治疗技术,对于提高手术成功率、降低并发症发生率非常重要[2]。临床工作中,有各种策略和技术以应对钙化病变引起的问题,其中包括使用标准球囊的简单扩张和使用“聚力”的血管成形装置,如切割球囊、棘突球囊、双导丝球囊,使用冠状动脉内旋磨术的斑块修饰,以及未广泛采用的超声振波技术和激光斑块消蚀技术[3-8]。但其中一些设备需要特定的培训、专业知识和经验,同时操作的复杂性不可避免地导致更高的并发症发生率。在一项多中心研究中,冠状动脉内旋磨术的冠状动脉穿孔发生率为0.7%,与标准球囊扩张操作程序(0.1%)相比,风险明显增加[9]。棘突和切割球囊通过性差,对于真正的僵硬钙化不能扩张病变治疗效果有限,同时在病变处理中有出现脱落和穿孔的报道[10-11]。
本研究回顾性分析中国医学科学院阜外医院冠心病中心使用非顺应性球囊高压扩张处理常规球囊不能扩张的病变的临床结果,初步评估对于常规球囊不能扩张的病变使用非顺应性球囊高压扩张的安全性和有效性。
1 对象与方法
1.1 研究对象
回顾性分析中国医学科学院阜外医院2016年1月至2019年12月住院期间常规使用半顺应性预扩张球囊不能充分扩张病变的36例行PCI的患者,其中男22例,女14例,年龄58~78岁,平均(67.8±6.8)岁,均在常规顺应性球囊未达到满意的扩张效果后使用非顺应性球囊高压扩张。
1.2 介入方法及过程
所有患者均选用经桡动脉入径,使用6 F或7 F指引导管。术前均服用阿司匹林100 mg、每日1次,氯吡格雷75 mg、每日1次或替格瑞洛90 mg、每日2次,在PCI开始时,通过动脉鞘管给予肝素100 U/kg,维持激活的凝血时间(activated clotting time,ACT)在250~300 s。对于冠状动脉病变,首先根据冠状动脉血管大小及狭窄程度,选择半顺应性球囊扩张;在达到16 atm(1 atm=101.325 kPa)后病变仍不能扩张的情况下,采用非顺应性球囊扩张。首选直径2.5 mm非顺应性球囊[波士顿科学quantum 2.5 mm×(8~15)mm,美敦力NC Sprinter 2.5 mm×(9~15)mm,雅培NC TREK 2.5 mm×(8~15)mm],在扩张病变前给予充分回吸,排空装置内空气,避免在高压扩张过程中球囊破裂造成气体栓塞,在球囊扩张过程中密切观察球囊病变处形态,在非顺应性球囊压力达到22 atm以上,每5~8 s加压2 atm,最大球囊扩张压力30 atm,直至病变充分扩张。将球囊保留在病变处,检查无血管穿孔后再撤出球囊,随后完成不能扩张病变的后续介入治疗。
手术成功定义为非顺应性球囊通过病变,并对不能扩张病变进行高压扩张。球囊扩张后通过药物涂层支架或药物涂层球囊处理病变,介入治疗完成后病变局部残余狭窄<20%,无冠状动脉夹层、穿孔、血栓形成,且前向血流为心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级Ⅲ级。
非顺应性球囊高压相关并发症主要包括冠状动脉穿孔、夹层和急性血管闭塞。住院期间主要不良心脑血管事件(main adverse cardiovascular and cerebrovascular events,MACCE)包括死亡、心肌梗死、卒中和紧急血运重建的复合终点。
1.3 统计学分析
采用SPSS 22.0统计学软件进行统计分析。计量资料采用(±s)表示,计数资料采用频率(%)表示。
2 结果
所有36例患者的临床基本情况见表1。36例常规球囊不能扩张患者中,左主干病变1例(2.8%),左前降支病变18例(50.0%),右冠状动脉病变15例(41.7%),左回旋支病变2例(5.6%)。使用高压非顺应性球囊扩张后,25例(69.4%)达到了病变充分扩张(典型病例1,图1),随后顺利置入支架(3例为支架术后膨胀不全再狭窄患者);8例使用非顺应性球囊高压不能扩张病变,采用旋磨治疗,其中5例(13.9%)经旋磨治疗后使用半顺应性球囊扩张成功,2例旋磨后常规半顺应性球囊仍不能充分扩张病变,经非顺应性球囊高压扩张成功(典型病例2,图2),1例(2.8%)旋磨后使用非顺应性球囊高压仍不能扩张病变;2例(5.6%)由于血管钙化迂曲,半顺应性小球囊扩张病变后非顺应性球囊通过困难,到达病变后仅使用额定压力扩张病变,病变未充分扩张后放弃高压扩张;1例(2.8%)经高压球囊扩张后置入支架发现病变仍未充分扩张,使用非顺应性球囊高压后扩张未成功(图1),建议术后予加强抗血小板治疗,住院期间无MACCE发生。使用非顺应性球囊治疗常规球囊不能扩张病变有2例冠状动脉夹层,分别使用1.5 mm和2.0 mm半顺应性球囊低压扩张后,TIMI血流分级恢复至Ⅲ级,术中2例在高压(分别为22、24 atm)时出现非顺应性球囊破裂,患者一过性胸闷,无血管穿孔并发症发生。住院期间无急性和亚急性支架内血栓闭塞及其他相关并发症发生。病变情况及操作特点见表2。
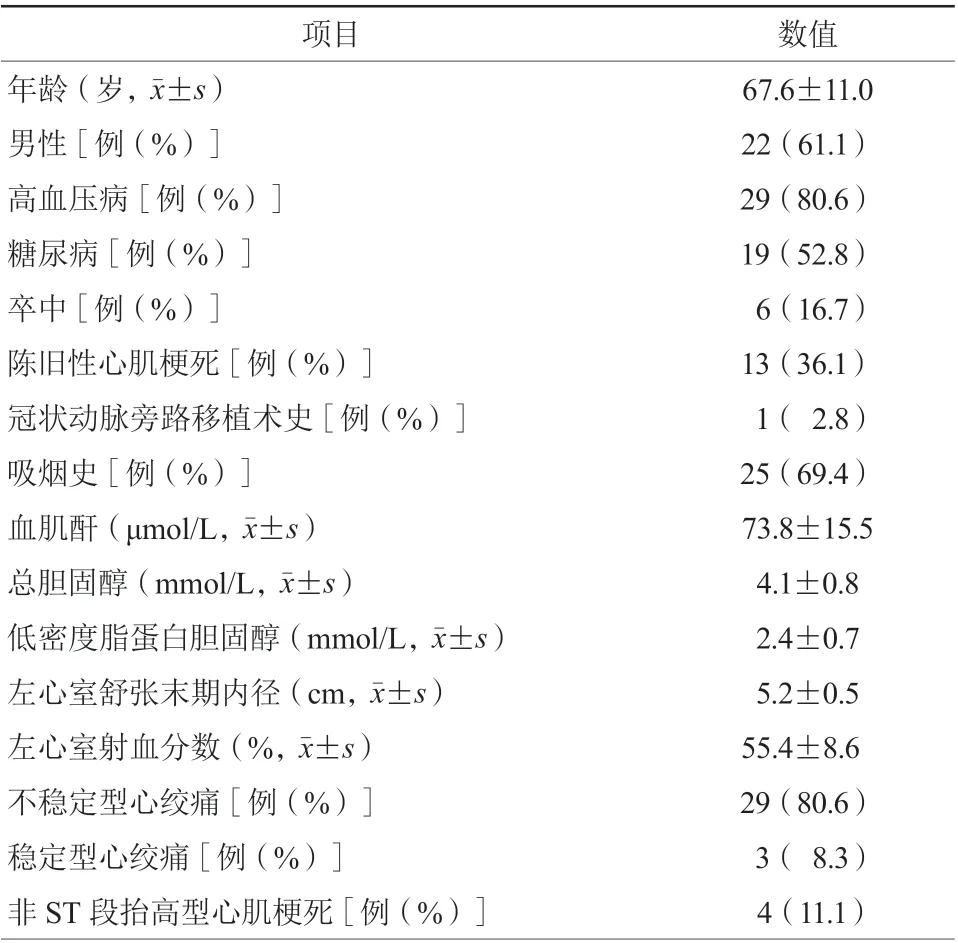
表1 患者基本临床资料(36 例)
3 讨论
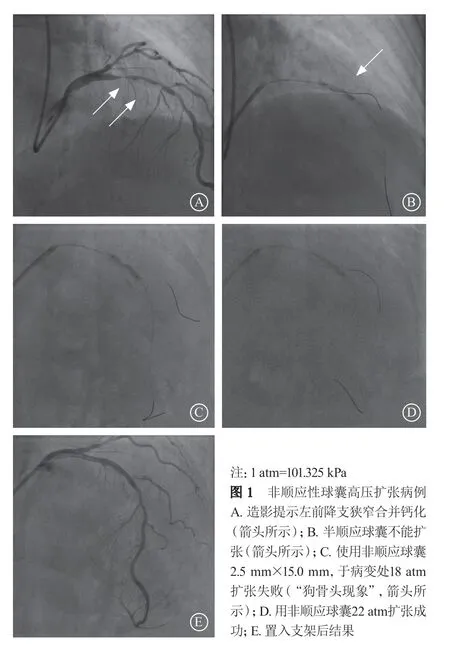
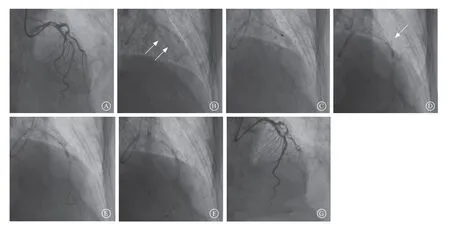
图2 严重钙化旋磨后以非顺应性球囊高压扩张 A.造影提示左前降支严重钙化狭窄;B.单纯透视下可见左前降支轮廓(箭头所示);C.用1.75 mm直径旋磨头行旋磨治疗;D.用2.5 mm×15.0 mm非顺应性球囊额定压力(20 atm)扩张病变失败(箭头所示);E.用2.5 mm×8.0 mm非顺应性球囊高压(26 atm)扩张;F.用2.75 mm×15.00 mm非顺应性球囊高压(24 atm)扩张;G.左前降支置入支架后结果

表2 非顺应性球囊在不同病变中的使用和操作结果(36 例)
冠状动脉钙化病变会降低血管的顺应性,介入治疗过程中血管扩张困难,或者不能均一扩张,引起明显的“狗骨头”现象或者血管夹层损伤,影响介入治疗的效果,这是造成介入失败的原因之一[1]。对于常规半顺应性球囊不能扩张病变者,冠状动脉内旋磨术是处理冠状动脉严重钙化病变的重要手段,正确使用可有效地消蚀冠状动脉钙化病变,为最终置入支架创造良好的手术条件[3]。但目前能开展旋磨技术的医院数量有限,且旋磨并发症发生率较单纯球囊扩张明显增加,费用较高,需要特殊的装备和技术训练,以上均限制了它的应用。国内对于钙化病变采用计划与非计划旋磨技术的相关并发症报道相似[12]。切割球囊对于治疗不能扩张的病变有一定效果,但刀片硬度过高,通过性差,对于严重钙化病变,有使用切割球囊刀片脱落和血管穿孔的报道[10-11]。有报道,超高压球囊额定爆破压力达35 atm,最大测定压力达42 atm,在治疗钙化不能扩张的病变中取得了良好的效果[13-15]。但国内尚无此种超高压球囊的临床应用。本研究为国内应用非顺应性球囊高压治疗常规球囊不能扩张病变总结了临床应用经验,提示非顺应性球囊在不能扩张的钙化病变中的使用是安全有效的。使用过高的压力扩张钙化病变的风险在于球囊破裂和血管穿孔。本研究中使用的非顺应性球囊直径较小,以能扩张病变最窄处即可,这样可避免出现病变周围血管损伤和“狗骨头”现象。本研究使用非顺应性球囊高压成功地扩张了常规顺应性球囊扩张失败的病变,操作方法简便,而且对于旋磨后不能扩张的病变,使用非顺应性高压球囊扩张也取得了良好的效果,避免病变预处理不充分引起的不良后果。非顺应性球囊爆破压一般为18~20 atm。本研究中非顺应性球囊扩张压力超出爆破压扩张,有发生球囊破裂的风险。本研究中2例发生球囊破裂,压力分别为22、24 atm,考虑与钙化病变中钙化小结引起球囊不均匀受力引起,其后采用旋磨治疗后成功扩张。因此在球囊准备中要充分回吸,排空装置中的气体,避免球囊破裂引起气体栓塞风险。同时在扩张病变过程中,要密切观察病变扩张情况,用最低的压力达到最满意的处理病变的效果。对于冠状动脉穿孔并发症的处理,要准备相应的治疗措施,以确保患者安全。
本研究还存在一定的局限性:首先,作为单中心、回顾性研究,病例数偏少,对研究结论的阐述可能存在偏倚;其次,对于半顺应性球囊不能扩张的钙化病变,缺乏足够的影像学评估,对何种病变采用非顺应性球囊扩张尚需进一步总结经验;再次,对使用非顺应性球囊高压扩张钙化病变的应用经验仍有待提高,国外有报道使用高压球囊有穿孔的发生[14],需密切关注高压扩张的安全性;同时要加强器械的改进,进一步提高球囊器械的耐高压和通过性能,减少处理不能扩张钙化病变过程中球囊破裂的发生。
总之,在当前药物洗脱支架介入治疗的时代,钙化病变成为介入医师面临的重要问题。本研究采用非顺应性球囊扩张常规球囊不能扩张的钙化病变,不需要额外的装备和特殊的培训。因此,对于不能扩张的钙化病变,非顺应性球囊扩张是费效比很好的选择,也是一种简便易行的策略选择。

