经导管肺动脉瓣置换术的新器械与新技术进展
田军 尚小珂 陈澍 董念国 张长东
作者单位:430022 湖北武汉,华中科技大学同济医学院附属协和医院心脏大血管外科
肺少血型复杂先天性心脏病(如法洛四联症、肺动脉闭锁等)在接受首次矫治手术后常常出现残余肺动脉瓣反流(pulmonary regurgitation,PR),这是此类手术后(尤其是采用了跨环补片修复技术)远期最常见的并发症。严重PR可引起右心室流出道(right ventricular outfl ow tract,RVOT)瘤样扩张和功能障碍、肺动脉瘤样扩张、心室收缩不同步和心律失常、进行性右心室扩张/右心室功能障碍,以及随后的右心衰竭,最终导致心力衰竭和死亡[1]。近年来肺动脉瓣重建的意义越来越受到重视。传统的外科肺动脉瓣置换需要再次开胸,在体外循环下进行。人工瓣类型(包括生物瓣、机械瓣及带瓣管道)均有较多应用。经导管肺动脉瓣置换术(transcatheter pulmonary valve replacement,TPVR)是自Bonhoeffer等[2]于2000年首次报道后逐渐兴起的一种微创手术方式,其可替代外科肺动脉瓣置换,并改善这类患者的长期预后[3]。经导管肺动脉瓣置换术虽然最早面世,但受到患者群数量、适应证、耐久性与推广价值等方面的影响,其发展相对滞后于左心瓣膜疾病的经导管治疗。本文就TPVR的发展现状及未来展望进行阐述。
1 法洛四联症术式选择及远期右心室流出道复杂解剖
在婴幼儿或儿童时期进行的首次法洛四联症矫治手术通常是通过各种方式疏通或重建RVOT,缓解肺动脉狭窄,但可导致即刻或迟发渐进的PR。根据病变程度及范围,可将法洛四联症具体术式分为RVOT切开疏通、RVOT补片、肺动脉瓣及瓣环切开、瓣膜切除、不同范围的跨瓣环补片、带瓣膜跨环补片(自制)、同种或异种带瓣管道替换、聚四氟乙烯人工双瓣管道、右心室-肺动脉外管道、RVOT双通道等,术后RVOT解剖类型多样,加上长期PR造成的慢性RVOT和肺动脉瘤样扩张,使得其解剖学更为复杂。经右心房/经肺动脉的漏斗部保留法可改善中期房室功能和降低心律失常风险,但不同手术入径仍缺乏明确的长期纵向对比结果[4]。肺动脉瓣保留技术理论上可维持长期的瓣膜功能,但会出现狭窄及持续的右心室高压。完全经右心室修复联合肺动脉瓣球囊成形术可优化瓣环的生长,但其长期效益未能证实。RVOT切口技术也常常受到横跨在流出道的冠状动脉变异影响,单瓣叶跨环补片修复技术往往会出现晚期肺动脉瓣功能丧失。目前关于法洛四联症患者根治手术,最佳的手术方式和手术时机尚缺乏共识,但手术方式制定时需尽可能注意保留右心室功能,充分考虑远期肺动脉瓣和右心室流出道解剖状态和功能,并减少心律失常出现的可能[5]。
法洛四联症术后患者RVOT解剖形态特点多样,Schievano等[6]对其进行了形态学分类,定义了五个示意性RVOT几何形状,包括正“八”字型、反“八”字型、直筒型、梭型、哑铃型。虽然简化了形态类型,但在每种类型中仍然存在广泛的变异性。此外,手术史或基础病理与随后的RVOT形态学分类之间没有发现直接的相关性,证实了其不可预测性和广泛的变异性。鉴于置入部位的解剖结构,必须提供支架的良好铆定,以确保经导管瓣膜的稳定性及功能。不同类型、不同直径的RVOT形态对于置入适应证的判断、置入部位和方法的确定、瓣膜型号选择都有重要影响。除了自体RVOT往往尺寸过大外,在整个心动周期中RVOT尺寸具有很大的变异性,RVOT横截面积和直径(包括长径和短径)变化幅度可超过50%,轴向长度变异性(缩短和延长)可高达80%。有些患者呈局部瘤样结构,扩张不对称,几何形状不规则,顺应性过好且差异很大,这也增加了RVOT动态结构的复杂性和难以预测性。
既往外科肺动脉瓣二次手术治疗包括机械或生物肺瓣膜置换、扩大的带人工双叶瓣的聚四氟乙烯管道、同种带瓣管道(主动脉或肺同种移植物)、异种带瓣管道(无支架猪瓣、缝合猪瓣的人工管道、牛颈静脉)替换等。生物人工瓣膜和带瓣管道在置入后10~20年内最终都会发生进行性瓣膜功能障碍,同时还必须权衡感染性心内膜炎的风险。传统的生物猪瓣与心包瓣的耐久性类似,在成人手术中常作为首选,且有利于将来再次经导管肺动脉瓣置换术。理论上讲同种带瓣管道耐久性最好,适合于婴幼儿手术使用,且在肺动脉位使用的耐久性更优于心外位(右心室至肺动脉切开)。牛颈静脉在婴幼儿中耐久性与同种移植物类似,故也被广泛使用。然而同种带瓣管道在成年期的耐久性低于标准生物瓣和无支架生物瓣[7]。有些新型管道尚缺乏长期数据,尤其是心外管道,由于其很难进行再次经皮瓣膜置换术,应尽可能避免使用。机械肺动脉瓣置换术虽然瓣膜恶化率低,但需要终身全身抗凝治疗,以避免血栓形成,而由于年轻人和青少年全身抗凝的各种限制或禁忌、肺动脉分支介入治疗的入径限制等,实际应用很少,除非合并左心机械瓣置换或其他需要长期抗凝的疾病。
2 球囊扩张瓣膜的特点及局限性
目前国际上比较成熟的球囊扩张式经导管肺动脉瓣有Melody瓣膜系统(美敦力,美国)和Sapien瓣膜系统(爱德华,美国),全球总置入量已有万例(其中大部分使用的是Melody瓣膜)。由于欧美广泛使用带瓣管道的手术策略,远期以管道再狭窄(±反流)为主,球囊扩张瓣膜产品的设计理念是重建右心室流出道-肺动脉带瓣管道中功能不全的肺动脉瓣,已成为治疗术后肺动脉瓣狭窄合并反流的标准方法[8]。由于瓣膜型号较小,不适合因长期PR而出现瘤样扩张的RVOT解剖学特点,上述两款产品也均未在国内开展临床应用及上市销售。
2.1 Melody瓣膜
Melody瓣膜是第一款上市的商业化瓣膜,2006年获得欧盟(Conformite Europeenne Mark,CE Mark)认证,2010年进入美国,2015年获得美国食品药品监督管理局(Food and Drug administration,FDA)上市前批准,2017年被正式批准用于经导管肺动脉瓣治疗及瓣中瓣置入。Melody瓣膜是由Bonhoeffer等[2]使用的初始装置发展而来,是将牛颈静脉带瓣管道(三叶式瓣膜)沿支架全程缝合在铂铱合金支架载体上,支架的编织金属丝上的每个节点通过黄金填料焊接成封闭单元(图1)。支架长28 mm,压缩后直径6 mm。瓣膜外径比内径大约2 mm,瓣膜内径可根据球囊大小扩张至18 mm、20 mm、22 mm范围内(对应扩张后支架长度23 mm、24 mm、26 mm)。最初的干预标准包括RVOT-肺动脉管道直径>16 mm、球囊测量最窄处直径为14~20 mm,中到重度PR或狭窄(压差>35 mmHg,1 mmHg=0.133 kPa)。有报道可以超指征使用24 mm球囊最大限度地扩张支架,如果在高压下(>4 atm,1 atm=101.325 kPa)扩张则可扩至内径25 mm[9]。目前Melody瓣膜已广泛用于治疗右心室-肺动脉管道功能障碍、生物瓣衰败,并用于一部分瓣环直径不大的自体流出道PR,自体流出道内置入需采用包括预支架在内的改良置入技术,因瓣膜置入通常需要一定的环形铆定区,而对于右心室-肺动脉外管道(如Rastelli术后)内的TPVR也可见诸报道。

图1 Melody瓣膜
Melody肺动脉瓣膜使用的Ensemble输送系统包含Tip头、内外球囊、牵引导丝管/内球囊管/外球囊管系统、外鞘管、兼容导丝、导引鞘、止血阀等部分组成,远端外径22 F,近端外径15 F,外部为可撤回的聚四氟乙烯(poly tetra fluoroethylene,PTFE)外鞘管,一般配合更大尺寸的长导引鞘输送至肺动脉内,建议用于体重>20 kg的患者。球囊采用Balloonin-Balloon高压双球囊扩张系统,扩张时内球囊直径为外球囊直径的一半,球囊为尼龙材料,外球囊直径有18 mm、20 mm、22 mm三种(24 mm未经批准),在置入前需手动将瓣膜压接在球囊上。
目前国外关于TPVR的远期并发症(包括支架断裂、感染性心内膜炎等)及长期疗效数据几乎均是基于Melody瓣膜的临床研究结果。Melody瓣膜的5年内76%的患者无需再干预,狭窄合并反流患者的中远期心功能改善比单纯反流患者改善更明显。瓣膜耐久性结果及在5年以上免于再干预比例仍然缺乏数据[5]。再干预最常见的原因是支架断裂导致置入瓣膜再狭窄,而15%的原因是感染性心内膜炎导致的置入物移除及瓣膜置换。现有证据表明,Melody瓣膜支架断裂常发生在管道或自体流出道瓣膜功能障碍的患者中,很可能是由于铂铱合金支架上的反复应力所致[10]。文献中支架断裂的发生率为5%~25%,危险因素包括手术年龄较小、较高的术前和术后跨瓣压差、管道直径小、释放后支架反冲或膨胀不全、瓣膜紧邻胸骨正下方、管道弯度大等[10]。Nordmeyer等[10]对支架断裂进行了分类:绝大多数为Ⅰ型支架断裂,至少1根支架柱断裂,不丧失支架完整性,常于术后早期观察到,临床意义不大,通常与不良事件无关,不需要再次干预,但需定期监测其进展;而Ⅱ型(支架断裂伴支架完整性丧失)和Ⅲ型(支架断裂伴支架碎片分离或远端栓塞)通常需要再次干预,因为可导致管道狭窄和瓣膜功能障碍。在Melody瓣膜置入前预先置入一枚球囊扩张式裸金属支架作为着陆区,可显著降低支架断裂的发生率,同时可以保证瓣膜支架的形态学稳定性和术后血流动力学指标,减少再介入概率。瓣膜置入后的充分后扩张也被认为可以减少支架断裂及相关的再狭窄。再次经导管瓣膜置入术是治疗Melody瓣膜支架断裂的主要方法。
2.2 Sapien瓣膜
Edwards Sapien系列最早用于经导管主动脉瓣置入,2006年在美国实施了肺动脉瓣的首次人体置入,2010年获得CE Mark,2016年Sapien XT获得FDA批准用于人工管道衰败的经导管肺动脉瓣置入。Sapien XT瓣膜有23 mm、26 mm、29 mm三种规格,对应支架高度为14.3 mm、17.2 mm和19.1 mm。支架材料为激光切割成型的钴铬合金,瓣叶为牛心包,缝合在支架内侧,并缝合有PET材质的密封裙边(图2)。第三代Sapien 3瓣膜(型号20 mm、23 mm、26 mm、29 mm,对应支架高度16 mm、18 mm、20 mm、22.5 mm)已经在主动脉位商业化应用,目前正在进行TPVR的临床试验评估其有效性(COMPASSION S3 Clinical Trial nct0274677),除带瓣管道衰败外,也已成功用于生物瓣衰败瓣中瓣置入和自体流出道置入。由于拥有更大的尺寸,其可置入于更大直径的流出道内,也有学者曾尝试使用新的柔软的Nucleus球囊输送系统,使Sapien XT瓣膜扩张到更大的尺寸。
Sapien XT瓣膜输送系统采用经股Nova Flex系统/经心室Ascendra系统(Sapien 3瓣膜为Commander系统,尺寸降低至14~16 F),尺寸为16~20 F,Nova Flex系统包括2根导管(球囊内导管和球囊外导管),开始瓣膜位于外导管输送杆球囊近端,经过下腔静脉/腹主动脉时回撤球囊导管,保持外导管位置不变,则使球囊向瓣膜靠近。根据球囊两端的X线下标记可优化瓣膜置入部位。瓣膜使用容积控制性单球囊扩张(扩张容积分别为17 mL、22 mL、33 mL,爆破压7 atm),通过预装载在输送器球囊上,输送时无外鞘管保护。输送手柄具有调弯系统。对于更大的自体RVOT,有人尝试过在流出道置入多枚支架重叠,为经导管瓣膜创造一个合适的着陆区。对于RVOT-肺动脉全程直径较大者,也有学者尝试在左、右肺动脉分支各置入一枚Sapien瓣膜,这种异位置入也有较好的效果,已累计报道数十例,但技术难度偏大,失败率及死亡率偏高[11]。为了适应更大直径的自体流出道,Edwards公司2018年开发了一款经皮置入的Alterra自适应性预置入支架[12],旨在内部重塑自体RVOT,缩小RVOT直径并产生刚性着陆区,作为对接适配器后置入标准29 mm球囊扩张瓣膜,已完成了第1例人体置入试验。支架为对称的沙漏型设计,除流出端外支架大部分以PET覆膜缝合在支架内表面,流出部网眼为非覆膜,流入和流出直径为40 mm,中心直径为27 mm,总长度48 mm,完全覆膜部分的长度30 mm,通过16 Fr eSheath(包括可伸缩的外输送鞘、装载支架的内输送鞘、连接器、锥形尖端、手柄、冲水端口等)置入自体流出道后搭配29 mm Sapian 3瓣膜置入(图3)。目前正在美国进行早期可行性研究。

图2 Sapien XT与Sapien 3瓣膜
从目前的临床研究结果看,无论有没有预先置入支架,Sapien瓣膜支架断裂也很少见,这可能与钴铬支架更耐用有关。COMPASSION研究[13]最新报道的结果显示,TPVR手术后4年免于再次外科手术比率为91.8%,术后4年免于再次TPVR干预的比率为91.2%,术后5年无手术相关死亡,也无支架断裂情况出现。
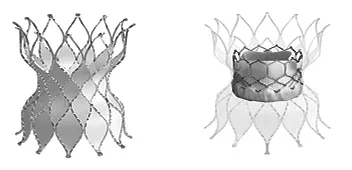
图3 Alterra自适应性预置入支架
3 自膨胀瓣膜的特点及局限性
使用跨瓣环补片技术重建RVOT在法洛四联症矫治手术中非常普遍,但术后远期可导致显著的RVOT-肺动脉扩张和失用性PR,RVOT的大小很容易超过目前可用的球囊扩张瓣膜最大尺寸,因此大部分情况下不适合使用球囊扩张瓣膜。目前经导管肺动脉瓣的大小选择主要取决于自身瓣环大小。有报道称,在补片扩大的自体RVOT中置入经导管肺动脉瓣要求置入部位直径小于29 mm,因而大约有2/3超大肺动脉瓣环的患者被排除在经皮治疗方案之外[14]。另一篇报道则估计目前只有15%的自体流出道PR患者符合经导管球囊扩张瓣膜置入的条件[15]。临床迫切需要专门用于扩张的自体RVOT的经导管肺动脉瓣装置,目前至少有4个瓣膜正在进行初步临床研究试图填补这一空白。然而与右心室肺动脉管道不同,自体RVOT解剖学十分复杂,设计和置入一个能适应术后多种自体RVOT解剖的自膨胀系统是一个很大的挑战,超弹性镍钛记忆合金可能是最适合的支架材质,以使支架在整个心脏周期内具有较大的可逆性形变能力和抗疲劳、抗断裂能力。目前已出现的产品整体结构相似,释放时大都是将压缩的支架导入到一侧分支肺动脉,于分支开口水平将远端缓慢释放,直至瓣膜在主肺动脉远端完全展开(有时需要将已释放支架远端拉回至预计展开的主肺动脉位置),然后释放全部的支架。
3.1 Harmony瓣膜
2010年Schievano等[16]首次报道了将自膨胀式经皮肺动脉瓣置入扩张的自体流出道内,后来被命名为Medtronic Harmony瓣膜,用于治疗自体流出道PR。患者的术前影像评估采用了四维CT创建的数据计算和仿真模型,并改进了后续研究中患者的主要筛查方法。Harmony瓣膜为哑铃形,在近端和远端具有较大直径,猪心包瓣膜位于中心狭窄部分(图4),依靠镍钛合金的温度依赖性形状记忆特性,使得其被释放于不同的流出道解剖结构中。猪心包组织采用了α-氨基油酸抗钙化工艺和0.2%戊二醛灭菌。瓣膜输送系统是25 Fr线圈装载系统和集成导管鞘,早期可行性研究报道了20例患者成功置入并完成了2年随访[17],除了2例患者需要早期手术器械移除外(1例24 h内远端移位和1例近端Ⅱ型支架断裂导致梗阻),其余18例的支架完整性和瓣膜功能维持良好,平均压力梯度在(15±6)mmHg,2例有轻度瓣周漏,3例有Ⅰ型支架断裂,早期研究中使用的瓣膜仅有单一型号,远端花冠、腰部、近端花冠直径分别为34 mm、23.5 mm、42 mm,支架总长度为55 mm。研究初步结果证明了其中长期有效性和安全性,但也提示需要改进产品细节设计和扩充型号以解决已发现的一些问题。Harmony瓣膜目前正在美国进行Ⅲ期多中心临床试验(Medtronic Harmony TPV临床试验NCT 02979587),并设计了更多规格型号。
3.2 Venus P瓣膜
Venus P Valve是由杭州启明公司研发的自膨胀、沙漏型经导管肺动脉瓣膜,用于经皮介入置入自体右心室流出道。首例置入2013年于上海中山医院完成,目前国内临床试验在6家中心完成55例置入[18],正在等待上市前审批。Venus P在全世界范围内已在16个国家27个中心完成了220多例置入,并已完成CE mark临床研究入组(80例),即将开展FDA approval IDE研究。
Venus P瓣膜支架由3部分组成,两端呈喇叭口状,远端喇叭口为完全镂空的裸金属支架,网眼较大且较为柔软以避免分支血流遮挡和受损,下段喇叭和中间直段为覆膜的猪心包组织缝合固定在镍钛合金支架上,三叶猪心包瓣均由聚乙烯缝线缝合在一个猪心包膜裙边上,瓣膜所在的中间直段较长,为主要的支撑铆定部位(图5)。根据中间段直径瓣膜型号范围从16 mm到32 mm,每2 mm为一个规格,并有不同中间段径向长度,近端流入道花冠直径较中间段大10 mm,远端流出道花冠直径较中间段大7 mm。从既往的使用经验上来说,瓣膜型号选择标准为在肺动脉瓣环直径基础上加2~4 mm,由于自体流出道良好的顺应性特点,瓣环直径主要通过术中球囊测量而得。早期研究数据显示了优良的血流动力学结果和右心室容积改善。同时Venus P已开发更大型号的34 mm、36 mm规格瓣膜,以使更多患者有条件接受该手术方式。
Venus P瓣膜导管输送系统包括导管柄、推进器、鞘管、胶囊腔和尖端,导管中间杆长度100 cm以确保瓣膜能到达释放位置并提供操纵的推送力和扭控力。通过体外手工将人工肺动脉瓣装载在头端胶囊腔内,导入体内后导管柄用于在准确定位后释放瓣膜,旋转手柄上的微调旋钮即可释放瓣膜。输送系统的主体导管为16 F,瓣膜装载的胶囊腔为20~22 F,瓣位、支架中间直段与两端喇叭部交接处各有一组不透X射线的Mark标记,能在瓣膜置入过程中监测瓣膜释放和确定位置。
3.3 Pulsta瓣膜
韩国SNU-TaeWoo Medical公司发明的Pulsta瓣膜是另一种为自体RVOT设计的自扩张经导管肺动脉瓣,支架形态更接近直筒状,骨架为0.0115 in(1 in=2.45 cm)直径的镍钛合金丝双股编织而成,且没有焊接(图6)。与其他自膨胀瓣膜相比其支架更软,在顺应性大、直径变化率高的自体RVOT病变中具有更好的预防支架断裂的潜力,同时可降低输送系统尺寸。支架腰部呈轻微弧型内凹,上下端最大径仅比腰部直径大4 mm。瓣膜腰部直径18~28 mm,长度28~38 mm。更大型号30 mm、32 mm瓣膜的体外测试已经完成,有望很快用于临床。Pulsta瓣膜通过多步骤的特殊处理工艺,以最大限度地保留组织,减少钙化,降低免疫原性,防止早期退变,程序包括脱细胞、α-半乳糖苷酶处理去除α-半乳糖异种抗原、空间填充物处理、戊二醛固定、有机溶剂处理、解毒,是第一种无α-半乳糖的猪心包瓣膜。处理后完成了40万次以上的支架疲劳试验和2亿次以上的瓣膜加速磨损试验。支架内层覆膜采用猪心包组织由5-0聚酯编织丝紧密地手工缝合在支架壁上,以保证裁剪好的三叶猪心包瓣缝合后对合良好。除两端外的支架壁大部分以猪心包覆膜。
Pulsta瓣膜配套的经导管输送系统可用长度110 cm,锥形尖端长度17 mm,瓣膜装载腔为18 F,输送导管轴为12 F。输送系统与瓣膜近端铰接处设计有钩块,可控制瓣膜的稳定释放并有效防止释放过程中瓣膜突然跳出。据报道已成功完成10例人体置入[19],目前正在进行韩国的多中心临床试验以进一步评估安全性和有效性(clinical trials.gov标识符:NCT03110861)。
3.4 PT Valve瓣膜
由北京迈迪顶峰公司研发出的PT Valve在国内已完成20多例人体置入,早期可行性研究显示了良好的安全性和有效性[20],特征是其哑铃形、对称性的镍钛合金支架设计,支架的两端较柔软而腰部瓣位的支架小而硬,支架流出端与腰部的连接为开环设计,瓣膜为猪心包瓣叶裁切缝合而成,支架内为猪心包密封膜(图7)。依据支架花冠部和腰部的直径,瓣膜型号:28 mm-20 mm、32 mm-23 mm、36 mm-26 mm、40 mm-26 mm、44 mm-26 mm五种,即有5个支架尺寸和3个瓣膜尺寸,其中26 mm瓣膜有3个不同的框架(36 mm/40 mm/44 mm)。未来也正在开发另外两款48 mm-29 mm、52 mm-29 mm两种规格以更多适应国人的自体流出道解剖特点。输送系统胶囊腔为21 F,推送杆部分为12 F,并在尾端自带有可移动的入路止血阀设计。
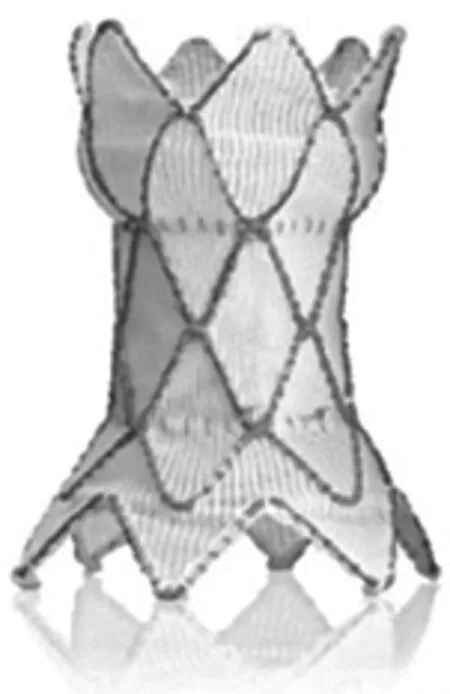
图4 Harmony瓣膜
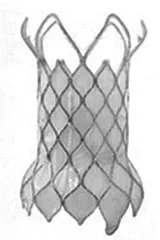
图5 Venus P瓣膜

图6 Pulsta瓣膜

图7 PT Valve
瓣膜支架的定位主要依赖于两侧膨大的花冠铆定在主肺动脉及流出道内(术前需要进行多平面测量),型号选择不受瓣环的直径限制,因而可以处理肺环直径超过30 mm的患者(最大可达36~38 mm)。由于中间相对狭窄的支架腰部瓣位不受压,不影响瓣膜小叶的性能,减少了小叶展开不全导致的跨瓣梯度升高和机械剪切力增加,不影响瓣膜耐久性,同时可显著降低支架中段外压导致的冠状动脉压迫的风险(左冠状动脉往往走行在瓣环左后方附近),多数病例甚至可无需行球囊压迫试验。支架猪心包全覆膜设计使得支架与流出道有足够的接触面以减少瓣周漏的出现。
4 手术技术与临床问题
TPVR手术中可能面临技术难题,鉴于患者的复杂流出道解剖学,将大型号的瓣膜输送系统推送到肺动脉远端十分具有挑战性。多种操作技术包括手法调整、双侧双导丝轨道、RVOT辅助球囊、圈套器拉伸调弯、右心房后坐支撑以及经颈静脉途径都可作为尝试。输送用的轨道钢丝一般可使用Lunderquist特硬导丝,并需要预先塑形为猪尾状曲线以保护肺动脉分支,防止推送过程中及呼吸运动导致的远端受损。对于狭窄合并钙化的病例有时Lunderquist可能过硬,需更换为稍软的Amlplatz Superstiff导丝。目前报道的研究中由于暴力操作导致的管道撕裂或破裂并发症的发生率是4.1%,然而由于外科术后局部广泛粘连,大多数为局部渗血而并不导致血流动力学异常,少部分病例远端肺动脉夹层或破裂可能是危及生命的,需尽快通过覆膜支架或外科手术治疗[21]。有国外的中心统计瓣膜置入技术失败率、转外科手术、转经胸入径置入瓣膜等情况发生率可高达10%,对于术中导丝和输送技术的选择、经验的积累是通过反复试验来实现的。
TPV型号选择策略主要取决于自体瓣环直径或主肺动脉最窄径,即依靠瓣膜水平的支架压缩产生的支撑力来确保安全置入,或者依赖支架两端的有效铆定来确保装置的稳定性。即使如此,由于大多数患者的肺动脉瓣环直径实际已超过30~40 mm,明显限制了TPV瓣膜型号选择和解剖适应证。按照目前的多款自膨胀瓣膜的临床选择经验,可能仅20%~40%符合TPVR解剖学适应证。瓣膜型号选择偏小或者解剖学适应证不合适,一般与手术规划、释放策略、适应证选择和肺动脉瓣环直径测量误差有关。尤其对于经验不足的中心,瓣膜严重移位可引起灾难性后果,需尽快转为外科开胸手术。短支架的球囊扩张瓣膜更容易远端移位和栓塞,可导致肺动脉梗阻,通常需转外科手术取出。长支架的自膨胀式瓣膜更容易受肺动脉压力影响而向下移位,由于扩张的肺动脉、扩大的流出道补片顺应性非常好,直径随心动周期变化幅度大,能否作为铆定部位,除了收缩期最大径外还应结合RVOT的整体长度和弯曲度。瓣膜向下移位完全可进入右心室,因此对于直径过大、倒漏斗型的自体流出道解剖特点者,手术选择需十分慎重。
由于复杂先心病患者冠状动脉解剖的变异性,在自体RVOT/管道的球囊压迫试验中发现有5%~7%的患者存在冠状动脉压迫风险。由于左冠状动脉主干通常走行于肺动脉瓣环水平附近的左后方,对于风险较大者,多数情况下不能实施TPVR。考虑到这种灾难性并发症的发生率,需要对其解剖特点、潜在受压风险进行详细评估。迄今为止,文献报道了几例因压迫引起的冠状动脉闭塞和死亡,甚至有术后数月迟发的冠状动脉受压[22]。目前检测冠状动脉压迫风险的标准方法是用与计划使用瓣膜相同尺寸的球囊进行压迫试验,现行指南中实施TPVR手术均建议进行冠状动脉压迫试验(Ⅰ b级推荐)[23]。
术前计算机断层血管造影(computed tomography angiography,CTA)评估在识别高危人群中也十分重要,三维旋转血管造影、CTA与数字减影血管造影(digital subtraction angiography,DSA)融合成像现在也被用在冠状动脉风险评估当中。除冠状动脉压迫外,另外已经有报道显示在球囊压迫试验中发现其可导致显著的主动脉根部压迫及主动脉瓣反流。PT Valve和Harmony Valve由于其窄腰设计和腰部非支撑性铆定方式,理论上可能不会对瓣环和外周组织造成压迫,可降低冠状动脉压迫的风险,有限的文献报道中提示通过术前CTA和仔细规划手术对冠状动脉风险进行详细评估,有可能大部分可以省掉瓣膜置入过程中原本必须实施的冠状动脉压迫试验,简化手术过程,但仍不足以改变现行指南推荐,尤其是对于合并肺动脉瓣狭窄病变的病例[18]。
5 未来展望
国内法洛四联症矫治手术广泛使用跨环补片(据估计超过85%),而近年来每年完成的手术量约1万余台,这部分患者大部分可能在10~30年后面临大量PR需要进行肺动脉瓣二次手术,未来患者数量可能面临井喷之势。经导管肺动脉瓣技术已被证明是一种安全有效的治疗PR的方法,对于解剖结构合适的法洛四联症矫治后合并重度PR患者已成为可替代外科PVR的手术选择,并可作为治疗首选。然而即使在目前多种球囊扩张、自膨胀瓣膜产品可及的情况下,符合TPVR解剖适应证的患者可能仍仅有20%~40%。远端长度不足的“八”字型的倒漏斗状流出道、流出道全程直径大于40 mm等解剖特点者目前仍被认为不适合TPVR,开发出能适用于这两种流出道解剖特点的TPV可使更多的患者受惠。开发更小尺寸、更柔软输送装置的经导管瓣膜可以使得更低龄、低体重患者有接受TPVR手术的机会,同时可保证置入更为精确,也有利于瓣膜的可回收性、重新定位或者移除。而开发直径更大、长度更短的自膨胀瓣膜以扩大解剖适应证也是必要的趋势之一。RVOT重塑装置有望能扩展球扩式瓣膜的置入适应证。外科开胸RVOT/肺动脉折叠术与TPVR的杂交手术可解决一部分流出道结构过宽及冠状动脉风险高危的患者。目前TPVR产品仍存在装置移位、瓣周漏、感染性心内膜炎、支架断裂及再狭窄或冠状动脉梗阻等并发症和风险,减少需要再干预的并发症,增加器械临床效果和长期耐久性,未来新出现的瓣膜产品同样需要重点考虑这些问题。
心脏磁共振分析和三维CT融合成像等新兴技术的研究有助于更好地决断手术干预时机及简化手术操作难度。由于患者相对年轻,经导管肺动脉瓣的长期耐久性问题也值得关注。瓣膜寿命在很大程度上受到继发于宿主免疫反应和营养不良性钙化的进行式瓣膜退化的限制。在临床前研究中已经证明了使用自体干细胞成功开发并置入组织工程肺动脉瓣。组织工程瓣膜和适应性材料设计的进步可以使得儿科人工瓣膜能够随着儿童年龄的增长而适应心脏结构的扩大,并尽可能提高瓣膜使用寿命。鉴于目前早期干预的趋势,未来可能会在儿科患者群体中扩大TPVR的使用[12]。

