激活乙醛脱氢酶2抑制老年大鼠心肌缺血再灌注损伤
邢 媛, 殷 玥, 石曌玲, 李 晨, 王博文, 王衍帅, 高 峰, 马 恒
激活乙醛脱氢酶2抑制老年大鼠心肌缺血再灌注损伤
邢 媛1, 殷 玥1, 石曌玲2, 李 晨3, 王博文3, 王衍帅3, 高 峰1, 马 恒1
(第四军医大学:1生理学教研室;2西京医院儿科;3口腔医学系, 西安 710032)
衰老心肌对缺血/再灌注(I/R)损伤的耐受能力显著降低,导致老年心肌缺血易损性。本研究旨在探讨乙醛脱氢酶2(ALDH2)激动剂Alda-1对老年大鼠心肌I/R损伤的影响。成年(3~4月龄,40只)和老年(22~24月龄,40只)雄性SD大鼠随机分为I/R组和I/R+Alda-1治疗组。采用冠状动脉左前降支结扎缺血30min再灌注4h建立在体大鼠急性心肌I/R模型,于再灌注前5min经静脉分别以2ml/(kg·h)速度分别输注生理盐水(0.9% NaCl)和Alda-1(16mg/kg)并持续到再灌注结束。于术中监测血流动力学指标,再灌注结束后取心肌组织检测ALDH2活性、蛋白质羰基化程度和心肌内活性氧簇(ROS)水平,抽取血样检测LDH水平。检测心肌ALDH2活性显示,老年心肌ALDH2活性较成年组显著降低。与成年组相比,老年心肌缺血再灌注损伤显著加重,表现为心肌收缩舒张速率显著降低,血清乳酸脱氢酶(LDH)水平显著增加(均<0.05)。再灌注期Alda-1治疗可有效提高老年I/R心肌ALDH2活性(<0.05),并显著抑制老年大鼠的上述心肌缺血再灌注损伤(均<0.05)。老年组I/R心肌中蛋白质羰基化程度和ROS生成较成年I/R心肌显著增加(均<0.05)。Alda-1治疗可有效改善老年I/R心肌中的蛋白质羰基化和ROS水平。激活心肌ALDH2可显著改善衰老心肌抗I/R损伤能力,其机制可能与减轻I/R导致的蛋白质氧化损伤有关。
乙醛脱氢酶2; 衰老; 缺血再灌注损伤; 蛋白质羰基化; 活性氧簇
大量的流行病学资料显示,随着患者年龄的增加,心血管系统对缺血损伤的耐受能力显著降低,表现为心肌易损性增加[1]。这是导致老年人群缺血性心脏病高发病率和高死亡率的重要原因[2]。但是,老年性心肌缺血易损状态的发生机制尚不清楚。
在缺血再灌注(ischemia/reperfusion,I/R)过程中,细胞内产生多种内源性的具有很强生物反应活性的不饱和醛类化合物[3],其结果导致蛋白质交联变性形成羰基化改变,破坏心肌蛋白活性[4]。正常生理条件下,内源性生成的醛类物质的产生和清除是一个动态平衡过程,并在体内履行一定的生理功能[5]。但是在衰老过程中已经观察到体内的醛毒清除能力逐渐减弱,导致蛋白质等生物大分子的羰基化失活增加。乙醛脱氢酶(acetaldehyde dehydro- genase 2,ALDH2)催化细胞内醛类氧化为羧基酸是体内最彻底的羰基转化机制[6]。近来的研究显示,激活ALDH2可抑制心肌缺血再灌注损伤[7,8]。我们前期研究显示,心肌中ALDH2可清除缺血再灌注心肌内的4-HNE等醛类物质毒性,保护心肌细胞功能。但是,衰老心肌中ALDH2的表达水平与老年心肌缺血易损状态的联系尚不清楚。本研究旨在观察新近发现的小分子激动剂Alda-1激活心肌ALDH2对老年大鼠缺血再灌注心肌损伤的影响,比较分析ALDH2对衰老心肌发挥保护作用的可能机制,为更加全面地认识ALDH2心肌保护机制提供新的依据。
1 材料与方法
1.1 材料
成年(3~4月龄)和老年(20~22月龄)雄性SD(Sprague Dawley)大鼠由第四军医大学实验动物中心提供。DU640紫外分光光度计(美国Beckman公司)。乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购于南京建成生物制品研究所。微量注射泵为美国Harvard公司产品。
1.2 实验分组
成年和老年SD大鼠进行开胸、冠状动脉左室支挂线以及经静脉输液等操作。采用左前降支结扎缺血30min再灌注4h建立在体大鼠急性心肌I/R模型,于再灌注前5min经静脉以程控微量注药泵输液给药,分别以2ml/(kg·h)速度输注生理盐水(0.9% NaCl);和Alda-1(16mg/kg)并持续到再灌注结束。再灌注开始后,封闭胸腔,恢复动物自主呼吸。将微导管自右侧颈动脉插管至左心室,记录左室内压。左室收缩压(left ventricular systolic pressure,LVSP)及其变化微分(±LVdp/dtmax)均通过数据分析系统由计算机采集并计算。于再灌注结束后取血用分光光度法检测LDH活性。
1.3 ALDH2活性测定
比色法定量检测心肌ALDH2活性水平。ALDH2的酶活性是根据在NAD+转化为NADH+的过程中应用紫外分光光度仪检测340nm的吸光度值而定。NADH在340nm处的毫摩尔消光系数为6.22。ALDH2的活性表示为NADH/(min·mg protein)。
1.4 HNE含量检测
采用双抗体夹心ELISA法测定细胞及组织中4-HNE水平,试剂盒购自美国Cell BioLabs (OxiSelect™ HNE-His Adduct ELISA Kit)。
1.5 蛋白质羰基化检测
心肌蛋白样品悬浮于10mmol/L的2,4-二硝基苯肼,室温孵育30min,加入20%三氯酸,离心后悬浮于6mol/L的胍溶液。于360~390nm检测光吸收羰基含量计算公式:在360nm处的吸收×45.45nmol/蛋白质含量(mg)。
1.6 心肌细胞内活性氧簇的检测
用ROS敏感的荧光探针(CM-H2DCFDA)标记心肌细胞,荧光显微镜下检测细胞内H2DCFDA荧光强度变化,以荧光强度反映细胞内活性氧簇(reactiveoxygen species,ROS)含量的变化。ROS阳性细胞在整个核区被染成红色。拍照后用图像分析软件Image-Pro Plus 6.0(Media-Cybernetics Inc)计算平均吸光度值。
1.7 统计学处理
采用SPSS10.0统计软件进行统计学分析,实验数据以均数±标准差表示。组间数据比较采用单因素方差分析(One-Way Analysis Ovariance,One-Way ANOVA),若总体差异显著, 再以SNK-q检验分析相应两组间显著性差异。以<0.05 为差异有统计学意义。
2 结 果
2.1 心肌ALDH2酶活性
在基础状态下,与成年心肌相比,老年组心肌中的ALDH2活性显著降低(<0.05)。在生理盐水对照组,I/R可抑制成年及老年心肌中的ALDH2活性,但是老年组的ALDH2活性程度降至更低。与盐水对照组相比,再灌注过程中给予Alda-1治疗可显著激活成年及老年心肌ALDH2的活性(均<0.05;图1)。
2.2 Alda-1治疗对成年及老年I/R心脏血流动力学的影响
缺血前各组间血流动力学各指标差异无统计学意义。缺血后室内压及其微分均出现降低,但各组间差异无统计学意义。再灌注期间予不同输液处理,各组间心率差异未见统计学意义。但是,采用心率压力指数及室内压微分±LVdP/dtmax衡量心脏功能发现,在盐水对照组,与成年组相比,老年心肌再灌注4h后心率压力指数及±LVdP/dtmax均显著降低(均<0.05),表明老年心肌缺血再灌注损伤显著加重。治疗组的结果提示,Alda-1治疗可有效提高成年及老年组心肌缺血再灌注后心脏功能指标,心率压力指数及±LVdP/dtmax较盐水对照组均得到显著改善(均<0.05)。并且,对比缺血再灌注后心脏功能指标发现,成年Alda-1治疗组与老年Alda-1治疗组相比差异并无统计学意义。该结果提示,Alda-1治疗可有效提高老年心肌的抗缺血损伤能力,促进老年心肌缺血再灌注后心脏功能恢复(图2)。
2.3 Alda-1治疗对血清LDH的的影响
采用分光光度法检测心肌I/R后外周静脉血清LDH活性。如图3所示,在盐水对照组,与成年组相比,老年心肌再灌注4h后血清LDH水平显著增加(<0.05),表明老年心肌缺血再灌注损伤显著加重。与盐水对照组相比,Alda-1治疗有效降低成年及老年组心肌缺血再灌注后血清LDH水平(均<0.05)。成年Alda-1治疗组与老年Alda-1治疗组相比并无明显差异(图3)。
2.4 Alda-1治疗对蛋白质羰基化程度的影响
心肌I/R后提取心肌蛋白检测蛋白质羰基化程度。结果显示,盐水对照组中,老年心肌再灌注4h后蛋白质羰基化水平与成年组相比显著增加(<0.05),表明老年心肌中缺血再灌注导致的蛋白质损伤程度显著加重。与盐水对照组相比,Alda-1治疗有效降低成年及老年组心肌缺血再灌注后蛋白质羰基化水平(均<0.05)。成年Alda-1治疗组与老年Alda-1治疗组相比并无明显差异(图4)。
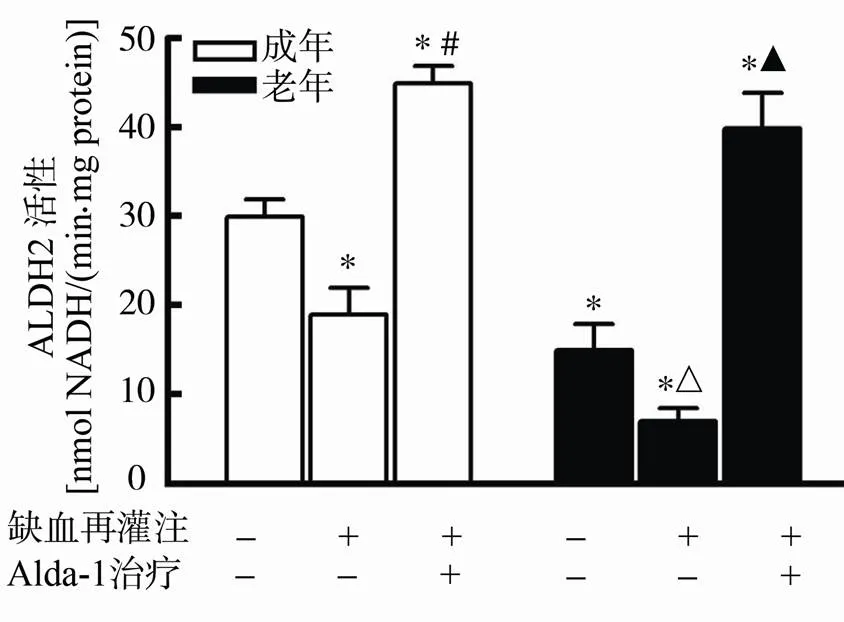
图1 Alda-1治疗对成年及老年缺血再灌注心肌ALDH2酶活性的影响
Figure 1 Effect of Alda-1 treatment on activity of ALDH2 in adult and aged ischemia/reperfusion myocardium (=8)
与成年对照组比较,*<0.05; 与成年缺血再灌注组比较,#<0.05; 与老年对照组比较,△<0.05; 与老年缺血再灌注组比较,▲<0.05
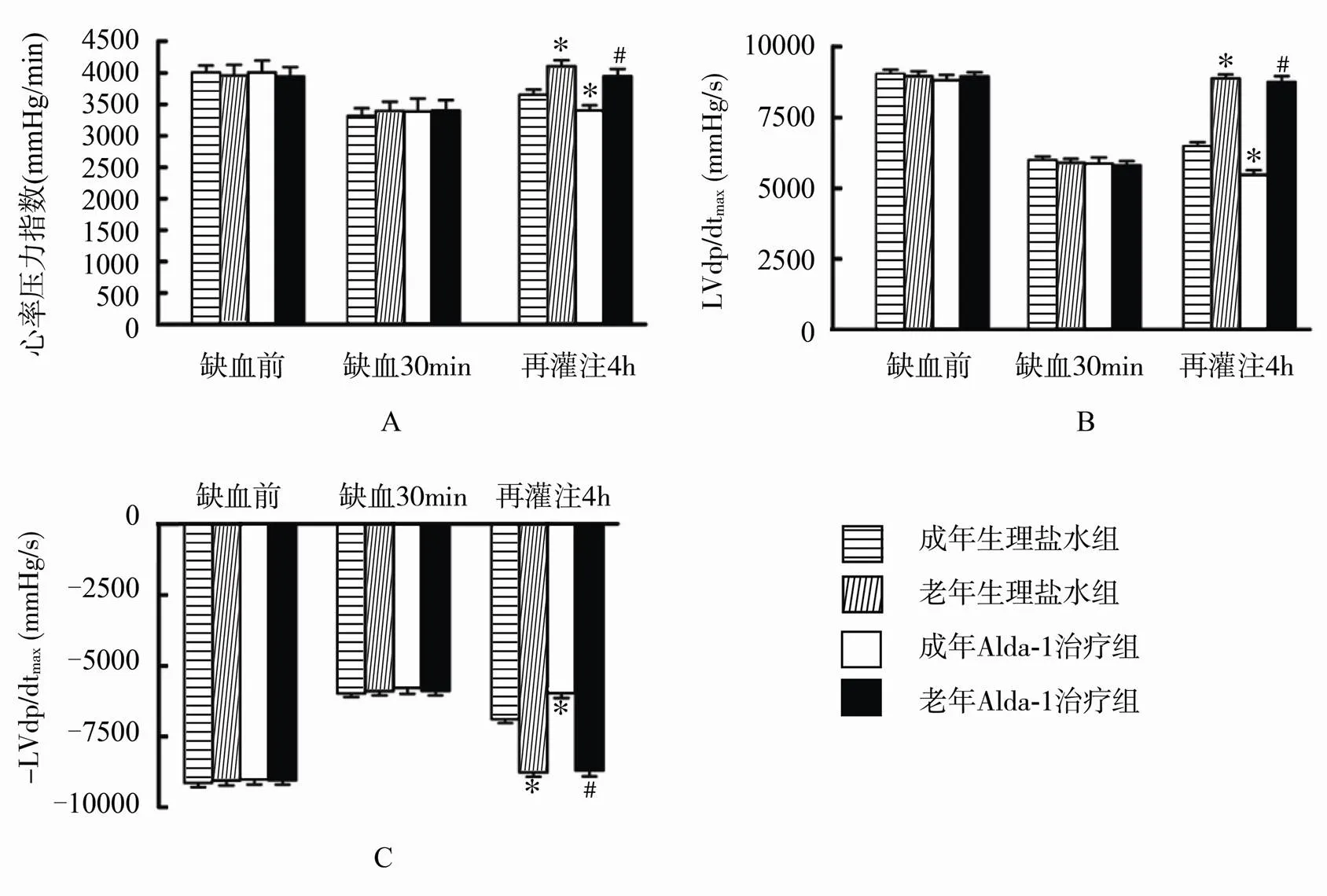
图2 Alda-1治疗对成年及老年I/R心脏血流动力学的影响
Figure 2 Effect of Alda-1 treatment on hemodynamics of adult and aged ischemia/reperfusion myocardium (=10)
A: 心率压力指数; B, C: 室内压微分。与成年生理盐水组比较,*<0.05; 与老年生理盐水组比较,#<0.05

图3 Alda-1治疗对成年及老年缺血再灌注大鼠血清LDH的影响
Figure 3 Effect of Alda-1 treatment on serum level of LDH2 in adult and aged rats (=10)
与成年生理盐水组比较,*<0.05; 与老年生理盐水组比较,#<0.05
2.5 Alda-1治疗对心肌ROS的影响
心肌I/R后提取心肌蛋白检测心肌中ROS含量后发现,盐水对照组中,老年心肌再灌注4h后ROS水平与成年组相比显著增加(<0.05),表明老年心肌中I/R导致的氧化应激损伤程度显著加重。与盐水对照组相比,Alda-1治疗有效降低成年及老年组心肌缺血再灌注后心肌ROS水平(均<0.05)。成年Alda-1治疗组与老年Alda-1治疗组相比并无明显差异(图5)。
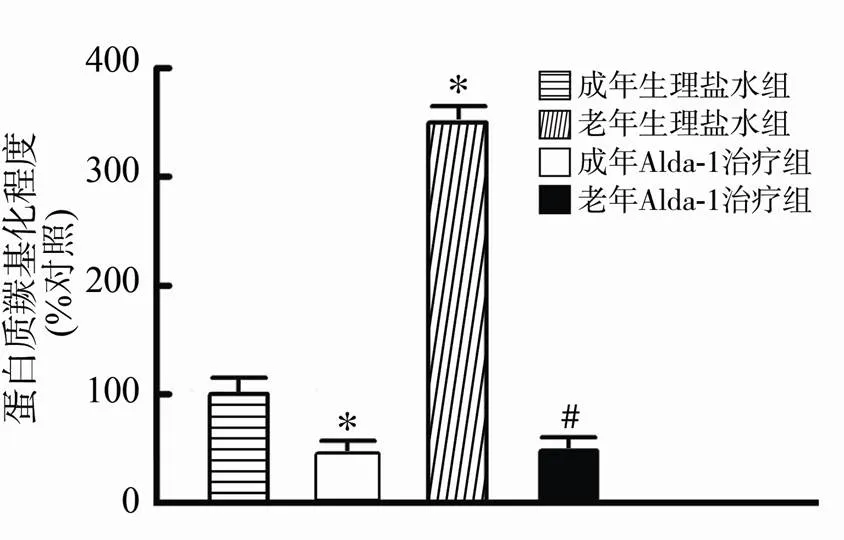
图4 Alda-1治疗对成年及老年缺血再灌注大鼠心肌蛋白质羰基化的影响
Figure 4 Effect of Alda-1 treatment on protein carbonyl of ALDH2 in adult and aged ischemia/reperfusion myocardium (=10)
与成年生理盐水组比较,*<0.05; 与老年生理盐水组比较,#<0.05
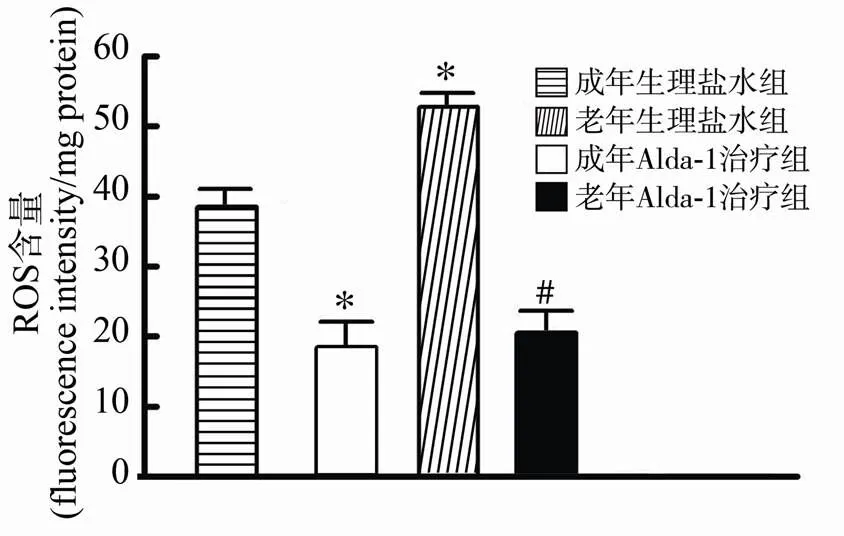
图5 Alda-1治疗对成年及老年缺血再灌注大鼠心肌ROS水平的影响
Figure 5 Effect of Alda-1 treatment on level of ROS in adult and aged ischemia/reperfusion myocardium (=10)
与成年生理盐水组比较,<0.05; 与老年生理盐水组比较,#<0.05
3 讨 论
我国正面临人口老龄化的严峻挑战。中华医学会多重心血管病危险综合防治建议中指出,人口老龄化已经成为我国人群心血管病发病率和死亡率逐年上升的重要原因[9]。衰老导致心肌出现易损状态,显著降低心脏抵抗I/R损伤的耐受力。大量的流行病学资料显示,随着患者年龄的增加,心血管系统对缺血损伤的耐受能力显著降低,表现为心肌易损性增加[1]。这是导致老年人群缺血性心脏病高发病率和高死亡率的重要原因[2]。临床资料显示,70岁以上急性心肌缺血患者出现明显的预后不良,如较低的射血分数,更多的并发症等,并且老年患者心肌缺血死亡率较年轻患者显著增加[10]。动物实验同样证实,心肌缺血耐受性的损失,始于中年(12个月)出现,随衰老而日益恶化(18个月和24~28个月)[11]。虽然临床和实验室观察均显示,衰老降低了心脏抵抗I/R损伤的耐受力,但是老年性心肌易损状态的原因尚不清楚。本研究明确证实,老年心肌I/R损伤与成年组相比显著加重,表现为心肌收缩舒张速率显著降低,血清LDH水平显著增加。因此,深入探讨老年性心肌缺血易损性的发病机制及其防治措施意义重大。
心肌具有高氧耗、低储能的特性;同时,自身的抗氧化能力相对较弱。近年来,内源性代谢产生的高反应性醛在心血管系统损伤的细胞毒性过程中的作用开始引起关注。体内脂肪酸过氧化会产生多种内源性的、具有很强生物反应活性的不饱和醛类化合物。例如:4-羟基-2-壬烯醛(4-HNE)、丙二醛、丙烯醛等。由于醛类物质的化学特性,极易发生亲核基团反应,进而破坏细胞膜,使蛋白质交联变性形成羰基化加合物,破坏心肌激酶活性[12]。此外,越来越多的线索显示,高反应性醛具有细胞毒性并且与多种疾病(特别是退行性疾病)相关:高血糖诱导丙酮醛参与糖尿病性细胞损伤[13];4-HNE 参与I/R心肌损伤,4-HNE 还导致关键激酶失活;4-HNE 直接作用抑制心肌细胞收缩舒张能力,破坏线粒体活性[8];丙烯醛显著增加心肌易损性[14]。内源性醛类物质的心肌毒性日渐明确。并且,毒性醛能穿过膜结构到达全身,而具有共轭结构的蛋白质羰基化产物能够稳定地留在细胞内[15]。但是,有针对性地改善醛毒性积累导致的蛋白质羰基化损伤是否可以增加老年心肌抗缺血能力仍属未知。正常生理条件下,内源性生成的不饱和醛类物质的产生和清除是一个动态平衡过程[5]。一旦醛毒的产生和清除的平衡被打破,导致了蛋白质等生物大分子的羰基化失活增加,在遭受缺血再灌注等有害损伤下,将导致损伤加重。而线粒体ALDH2是细胞内将毒性醛氧化为羧基酸的最重要催化机制[16]。ALDH2广泛存在于真核生物和原核生物中,在辅酶I存在的条件下,它催化包括乙醇在内的某些一级或二级醇、醛和酮的脱氢反应。我们对ALDH2的前期研究显示,在心肌细胞中ALDH2可以迅速清除细胞内的HNE等醛类物质毒性,保护心肌细胞功能[8]。但是,激活ALDH2抑制蛋白质羰基化损伤能否保护老年心肌功能、抑制衰老心肌缺血易损性,尚需深入研究。
针对上述问题,本研究首次发现,再灌注期间激活心肌ALDH2可有效改善老年心肌I/R后收缩舒张功能恢复,减小心肌损伤。因此,激活心肌ALDH2可显著改善衰老心肌抗I/R损伤能力。并且,本研究在心肌I/R后提取心肌蛋白定量观察了激活心肌ALDH2对老年心肌蛋白质羰基化和氧化应激的影响,发现激活心肌ALDH2可有效抑制老年心肌中蛋白质羰基化水平和氧化应激程度,这可能是ALDH2改善衰老心肌抗I/R损伤能力的机制之一。上述发现提示,ALDH2可能是抑制老年性心肌损伤的干预新靶点。
综上所述,本研究显示,衰老导致心肌I/R损伤显著加重,激活心肌ALDH2可显著改善衰老心肌抗I/R损伤能力,进而促进老年心脏再灌注后功能的恢复。该作用可能与ALDH2清除老年心肌中的醛毒性、有效抑制老年心肌中蛋白质羰基化损伤和氧化应激程度有关。本研究有助于阐明ALDH2在心肌衰老中的关键基础机制并丰富衰老与心肌缺血易损性的内在分子联系。
[1] Boengler K, Schulz R, Heusch G. Loss of cardioprotection with ageing[J]. Cardiovasc Res, 2009, 83(2): 247-261.
[2] Mariani J, Ou R, Bailey M,. Tolerance to ischemia and hypoxia is reduced in aged human myocardium[J]. J Thorac Cardiovasc Surg, 2000, 120(4): 660-667.
[3] Uchida K. Role of reactive aldehyde in cardiovascular diseases[J]. Free Radic Biol Med, 2000, 28(12): 1685-1696.
[4] Levine RL. Carbonyl modified proteins in cellular regulation, aging, and disease[J]. Free Radic Biol Med, 2002, 32(9): 790-796.
[5] Chen CH, Sun L, Mochly-Rosen D. Mitochondrial aldehyde dehydrogenase and cardiac diseases[J]. Cardiovasc Res, 2010, 88(1): 51-57.
[6] Ma H, Li J, Gao F,. Aldehyde dehydrogenase 2 ameliorates acute cardiac toxicity of ethanol: role of protein phosphatase and forkhead transcription factor[J]. J Am Coll Cardiol, 2009, 54(23): 2187-2196.
[7] Chen CH, Budas GR, Churchill EN,. Activation of aldehyde dehydrogenase-2 reduces ischemic damage to the heart[J]. Science, 2008, 321(5895): 1493-1495.
[8] Ma H, Guo R, Yu L,. Aldehyde dehydrogenase 2 (ALDH2) rescues myocardial ischaemia/reperfusion injury: role of autophagy paradox and toxic aldehyde[J]. Eur Heart J, 2011, 32(8): 1025-1038.
[9] 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 多重心血管病危险综合防治建议[J]. 中华心血管病杂志, 2006, 34(12): 1061-1071.
[10] Stone GW, Grines CL, Browne KF,. Predictors of in-hospital and 6-month outcome after acute myocardial infarction in the reperfusion era: the Primary Angioplasty in Myocardial Infarction (PAMI) trail[J]. J Am Coll Cardiol, 1995, 25(2): 370-377.
[11] Tani M, Suganuma Y, Hasegawa H,. Changes in ischemic tolerance and effects of ischemic preconditioning in middle-aged rat hearts[J]. Circulation, 1997, 95(11): 2559-2566.
[12] Uchida K. 4-Hydroxy-2-nonenal: a product and mediator of oxidative stress[J]. Prog Lipid Res, 2003, 42(4): 318-343.
[13] Moheimani F, Morgan PE, van Reyk DM,. Deleterious effects of reactive aldehydes and glycated proteins on macrophage proteasomal function: possible links between diabetes and atherosclerosis[J]. Biochim Biophys Acta, 2010, 1802(6): 561-571.
[14] Ismahil MA, Hamid T, Haberzettl P,. Chronic oral exposure to the aldehyde pollutant acrolein induces dilated cardiomyopathy[J]. Am J Physiol Heart Circ Physiol, 2011, 301(5): H2050-2060.
[15] 李国林, 印大中. 蛋白质羰基化与衰老[J]. 中国老年学杂志, 2008, 28(20): 2070-2073.
[16] Ma H, Yu L, Byra EA,. Aldehyde dehydrogenase 2 knockout accentuates ethanol-induced cardiac depression: role of protein phosphatases[J]. J Mol Cell Cardiol, 2010, 49(2): 322-329.
(编辑: 王雪萍)
Acetaldehyde dehydrogenase 2 activation inhibits myocardial ischemia-reperfusion injury in senescent rats
XING Yuan1, YIN Yue1, SHI Zhao-Ling2, LI Chen3, WANG Bo-Wen3, WANG Yan-Shuai3, GAO Feng1, MA Heng1
(1Department of Physiology,2Department of Pediatrics, Xijing Hospital,3School of Stomatology, Fourth Military Medical University, Xi¢an 710032, China)
Aging heart shows significantly reduced tolerance to myocardial ischemia/reperfusion (I/R) injury, so senescent heart is prone to be damaged by the injury. This study was designed to investigate the protective effect of acetaldehyde dehydrogenase 2 (ALDH2) agonist Alda-1 in aging rats after myocardial I/R injury.A total of 40 aging male Sprague Dawley (SD) rats (at an age of 20 to 22 months) were randomized into I/R group (I/R) and Alda-1 group (I/R+Alda). Another 40 adult rats at an age of 3 to 4 months served as adult control. Rat acute myocardial I/R model was established by ligation of left anterior descending artery for 30min followed by reperfusion for 4h. Alda-1(16mg/kg) and normal saline at the same volume were intravenously infused at a flow rate of 2ml/(kg·h) into the left ventricle of corresponding rats in 5min before reperfusion. The left ventricular pressure was monitored at the same time. At the end of 4 hours reperfusion, ALDH2 activity, reactive oxygen species (ROS) production, and protein carbonylation in the myocardial tissue were measured. Serum level of lactate dehydrogenase (LDH) was tested.A significant decrease in ALDH2 activity was observed in the aging hearts, but this effect was blocked by Alda-1. Compared with the adult hearts, myocardial I/R injury was significantly aggravated in aging hearts, which were evidenced by reduced±LVdP/dtmaxand increased serum level of LDH (<0.05). ALDH2 activator infusion during reperfusion effectively suppressed the above mentioned ischemic injury in the aging hearts (<0.05). Furthermore, protein carbonylation and ROS production in the myocardium were increased in the aging hearts compared with the adult hearts (<0.05), which was attenuated by Alda-1 treatment.Activating myocardial ALDH2 significantly improves the resistance ability to myocardial I/R injury in aging heart. ALDH2-induced cardiac protection may be through suppressing myocardial I/R-induced protein oxidative damage.
ALDH2; aging; myocardial ischemia/reperfusion; protein carbonyl; reactive oxygen species
(No.81170108).
R331.3; R592
A
10.3724/SP.J.1264.2013.00096
2012-10-29;
2012-11-30
国家自然科学基金(No.81170108)
马 恒, Tel: 029-84779210, E-mail: hengma@fmmu.edu.cn

