类风湿关节炎滑液MMPs表达与血清免疫球蛋白的相关性研究
周 涛 (湖北省武汉市普仁医院风湿免疫科,湖北 武汉 430080)
类风湿关节炎(RA)的病因和发病机制目前尚不明确,RA是一种免疫介导以滑膜炎为病理特征的自身免疫病,关节破坏是RA最主要的表现,体液免疫参与RA的发病[1]。近些年研究表明,基质金属蛋白酶(MMPs)可降解软骨和骨质,在关节的破坏中占有极重要地位。笔者通过检测RA患者和健康者血清免疫球蛋白及滑膜液MMP-1、MMP-3水平,探讨体液免疫与MMPs在RA发病过程中的变化和两者之间的关系。
1 资料与方法
1.1 一般资料:42例RA患者为2010年10月~2012年5月在武汉市普仁医院风湿免疫科住院患者,男13例,女29例,年龄27~62岁,平均(47.91±13.79)岁;平均病程(5.3± 3.28)年;正常对照组27例,男10例,女17例,平均(45.64± 11.27)岁。两组年龄、性别、职业构成等方面比较,差异无统计学意义(P>0.05)。RA患者均符合美国风湿病学会2010年(ACR)修订的RA诊断标准,排除其他风湿性疾病、感染、肿瘤、严重肝肾损害及心脑血管疾病等;根据RA疾病活动度积分(DAS28)将RA患者分为两组:DAS28评分≥3.2为RA活动组(男7例,女15例),DAS28评分≤2.6为RA缓解组(男6例,女14例),两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 取样:①空腹取肘中静脉血3 ml,3 000 r/min,离心15 min,分离血清,用1.5 ml Eppendorf管分装,置-20℃保存待测。②抽取膝关节滑液1~2 ml,抽取前做关节屈伸运动,保障关节内滑液混合均匀,并无血液混入。
1.2.2 检测:采用酶联免疫吸附法(ELISA)检测滑液组织中MMP-1及MMP-3的表达(MMP-1,MMP-3检测试剂盒购自上海西唐生物科技有限公司);采用免疫散射比浊法测定滑膜液中免疫球蛋白IgG及IgM水平,兔抗人IgG、IgM血清由上海长征医学科学有限公司提供.采用日立7600~020全自动生化分析仪进行检测。
1.3 统计学方法:所有数据用SPSS17.0软件处理,试验数据以均数±标准差(±s)表示,采用ANOVA进行组间差异比较,MMPs与免疫球蛋白的相关性采用线性回归分析,P<0.05表示差异有统计学意义。
2 结果
2.1 滑膜液中MMP-1及MMP-3的表达情况:MMP-1及MMP-3在RA活动组中的表达均显著高于RA缓解组和正常对照组(P<0.05)。详见表1。
表1 滑膜液中MMP-1及MMP-3的表达情况比较(±s)

表1 滑膜液中MMP-1及MMP-3的表达情况比较(±s)
注:与正常对照组比较,①P<0.05;RA活动组与缓解组比较,②P<0.05
组别 例数 MMP-1(ng/ml) MMP-3(ng/ml) RA活动组 22 179.54±53.82② 243.79±78.56①②RA缓解组 20 118.41±35.74① 165.34±50.27①正常对照组27 47.6±25.93 76.61±36.50
2.2 血清中IgG及IgM表达情况:IgG及IgM在RA活动组中的表达均显著高于RA缓解组(P<0.05)。详见表2。
表2 血清中IgG及IgM表达情况(±s)
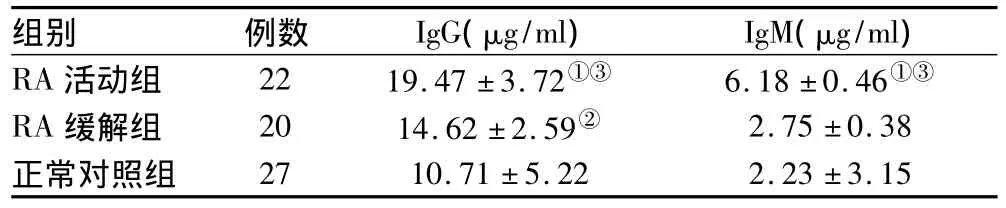
表2 血清中IgG及IgM表达情况(±s)
注:与正常对照组比较,①②P<0.05;RA活动组与缓解组比较,③P<0.05
组别 例数 IgG(μg/ml) IgM(μg/ml) RA活动组 22 19.47±3.72①③ 6.18±0.46①③RA缓解组 20 14.62±2.59② 2.75±0.38正常对照组27 10.71±5.22 2.23±3.15
2.3 RA患者滑膜液中MMP-1及MMP-3与血清中IgG及IgM的相关性:RA患者滑膜液中MMP-1、MMP-3与血清中IgG及IgM均呈现直线正相关关系(P<0.05)。详见表3。

表3 RA患者滑膜液中MMP-1及MMP-3与血清中IgG及IgM的相关性
3 讨论
目前RA被认为是一种病因不明的、以反复发作滑膜炎为主要病理表现的自身免疫病。近些年来研究表明,体液免疫在RA发病过程中发挥着重要作用,免疫球蛋白是一组具有抗体活性的蛋白质,血清IgG、IgM水平可作为RA病情、疗效评价的客观指标;本试验研究结果显示,RA患者随着病情的缓解,血清IgG、IgM的表达水平显著下降,与上述结论一致。RA致病因子通过活化Th细胞,激活B细胞分泌大量免疫球蛋白,形成大量免疫复合物,沉积于关节滑膜处,诱导滑膜炎性反应的产生;另外活化的Th细胞分泌多种细胞因子及炎性反应介质,亦会进一步加剧免疫联级反应,加重关节滑膜组织损伤[2]。影像学研究显示,RA患者在发病早期就会表现出显著的软骨侵蚀及骨髓内水肿,随病情发展软骨及骨质破坏进一步加剧,这与RA患者滑膜液中大量表达基质金属蛋白酶(MMPs)有着密切联系;研究发现,MMPs的异常表达可降解关节软骨及骨质,从而造成关节破坏,参与RA发病[3]; MMP-3被认为是导致软骨降解的最重要的蛋白酶,不仅能直接降解软骨和骨质对RA患者关节产生破坏,还能激活间质胶原酶MMP-1发挥生物学效应破坏关节,而蛋白水解酶的释放和其后在基质中的活化破坏了基质屏障,导致胶原崩解和蛋白多糖的分裂,从而导致软骨细胞生存的微环境恶化。释放的炎性细胞因子参加关节炎性反应,软骨细胞无法从基质中获得充分的营养而致功能受损,形成基质-软骨细胞之间恶性循环,导致关节软骨结构可溶性增加。同时血管增生形成血管翳-软骨结合区纤维增生,造成关节变形畸形强直致残[4]。本文试验结果显示,RA患者滑膜液MMP-1、MMP-3均显著升高,当RA病情缓解时,MMP-1、MMP-3表达亦降低,这与文献报道一致。本试验对RA患者血清免疫球蛋白IgG、IgM与滑膜液MMP-1、MMP-3的相关性分析表明,MMPs与免疫球蛋白呈直线相关,提示RA致病过程中免疫球蛋白的异常表达会促进局部MMP-1、MMP-3水平的上调,这可能是加剧软骨和骨质破坏的重要过程。笔者认为,抑制RA体液免疫反应,下调MMPs表达可能是缓解RA骨质破坏的有效治疗方法。
[1] 潘继承,倪黎刚,朱 建.联合检测RA患者血清IG、C、ESR、RF和CRP的临床意义[J].江苏医药,2011,7(5):598.
[2] 徐 雯,陶 娟.血清免疫球蛋白、补体水平与初诊类风湿性关节炎活动度的相关性[J].临床医药实践杂志,2008,17(10):815.
[3] 卢 洁,魏国忠,戴利亚.IL-17、MMP-3在类风湿关节炎患者滑膜液及血浆中的表达及意义[J].放射免疫学杂志,2011,24(2):205.
[4] 周沈贤,金忠棋,陈 健.基质金属蛋白酶及活性酶在类风湿关节炎上表达研究[J].浙江创伤外科,2006,11(1):12.

