NAVA呼吸模式在儿童先天性心脏病术后的临床应用
赵海涛 王亚芳
先天性心脏病(congenital heart disease,CHD)是婴幼儿期常见的先天性疾病之一,发病率为4‰~9‰。患儿术前存在特殊的血流力学,肺部血管和气道存在不同程度的解剖学变异加之手术对心功能的不利影响以及体外循环(cardiopulmonary bypass,CPB)对心肺功能的损害,机械通气(mechanical ventilation,MV)是患儿术后麻醉恢复期、循环功能不稳定期必不可少的治疗手段。MV应用目的是减轻呼吸肌负荷并提供足够的气体交换,间接减轻心肺负担,快速恢复心肺功能。但部分危重患儿可因为病情原因或有呼吸机依赖症状,需长时间机械通气。另外,多种原因造成自主呼吸与机械呼吸不同步(人机对抗)和(或)呼吸机相关性肺损伤(ventilation-induced lung injury,VILI),严重影响患儿术后心肺功能恢复,严重时可致死亡。将神经调节辅助通气(neurally adjusted ventilatory assist,NAVA)模式应用于CHD术后患儿的辅助通气,利用该模式的诸多优势,为今后的呼吸机治疗开辟了新领域。
1 NAVA的工作原理
近年来对肺部病理学与呼吸机的研究促进了新型呼吸模式的产生,目标是充分的氧合与通气,最小化VILI,促进呼吸肌恢复并成功撤机。NAVA是一种新型呼吸辅助模式,呼吸机在吸气相根据Edi按比例传递正压。改变了以往由气道内力学变化触发呼吸机工作的历史,从理论上最大限度的降低了触发延迟、人机不同步的发生率。NAVA的工作原理是在保留患者膈肌(最主要的呼吸肌,大约70%的呼吸功由其承担)自主活动,也就是存在自主呼吸的情况下,通过监测Edi信号来感知患者实际通气需要,成比例的予以通气辅助,提供合适的通气支持。电活动信号(electrical activity of diaphragm,Edi)由特制的经鼻胃管及相关软件获得及分析。Edi是中枢神经系统对膈神经发放冲动强度显示,可以反映呼吸中枢对膈肌的驱动。正常自主呼吸过程是:当呼吸中枢发出呼吸驱动,经由膈神经纤维传导动作电位到达神经-肌肉耦联接头,引起膈肌的兴奋,产生Edi,随之膈肌收缩,产生呼吸动作,促使肺泡内气体发生通气交换。呼吸需求程度与呼吸肌的效能决定呼吸中枢的输出程度(呼吸需求/呼吸肌效能=中枢神经输出)。在健康人群中,膈肌振幅较低,这显示:呼吸-神经结合是高效的,最大潜能的5%~8%被应用即可满足呼吸需求。在疾病患者中,膈肌效能降低,导致呼吸中枢输出度增加以弥补生理呼吸需要的额外动力。在COPD与脊髓灰质炎患者中可见增大的Edi信号(≥40%),反映了大部分膈肌储备被应用的事实[1]。见图1。
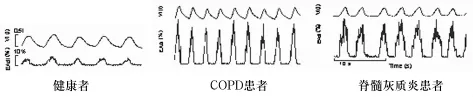
图1 Edi信号强度示意图
由于Edi与膈神经冲动相关,虽然无法直接监测呼吸中枢活动或吸气神经元放电,但是监测Edi可以了解呼吸中枢对膈肌的驱动。NAVA的工作流程可以描述为对Edi信号的感知、传输和反馈过程。在实施NAVA通气之前,必须在合适的位置安放探测电极收集患者Edi信号,这一点至关重要,确认正确的Edi导管位置是NAVA呼吸机自带的特殊功能。通过传感器将信号传送至安装有NAVA相关软件的呼吸机,呼吸机感知到这些信号以后,根据预设的触发范围和支持水平给予通气支持。整个机械通气周期的启动是直接基于患者的呼吸中枢驱动,也就是患者本身实际的通气需要,而不是传统意义上的时间、流速或压力的改变,从而保证了对患者合理的通气支持水平,也最大限度地提高了人机协调性。由于整个工作原理发生了根本性变化,在NAVA模式下,无需设置压力、流量触发以及压力、容量支持水平等参数,取而代之的是膈肌电触发(Edi trigger)和 NAVA 辅助水平(NAVA level,表示为 cm H2O/μV)。
当患者Edi强度达到预设的触发水平(Edi trigger)时,就启动1次通气,此时呼吸机根据预设的NAVA辅助水平给予与Edi信号波形类似的压力驱动。NAVA模式为非气动依赖模式,其呼气触发发生于Edi信号减至峰值的70%时,所以整个呼吸过程的启动、维持和吸呼气转换均由患者控制,实际发生的潮气量则与患者Edi信号强度和肺顺应性相关。NAVA与其他普通机械通气模式相比,只需设定Edi信号触发水平和NAVA辅助水平,而不必预先设置压力或流量触发水平、压力或者容量支持水平、波形、吸气时间等参数。在健康志愿者的研究中显示,在最大吸气时,NAVA可以安全有效地为呼吸肌去负荷,且不会造成肺部过度膨胀,亦不会发生呼气切换失败。
2 NAVA水平
经特殊的鼻胃管所获得Edi数值经处理决定吸气相,表达为μV。NAVA辅助水平表达了一个转换比率,即每μV的Edi可以将多少cm H2O的压力传递给患者。例如,NAVA水平为1 cm H2O/μV,那么当Edi是5 μV时将传递5 cm H2O的压力。同样,Edi是5 μV,但 NAVA 水平是2 cm H2O/μV,那么呼吸机将传递10 cm H2O压力。假设肺部力学特性(肺顺应性与气道阻力)是恒定的,应用NAVA期间,当增加NAVA辅助水平时,潮气量也增加,一旦达到目标后,将发生Edi降低或呼吸频率降低的二者之一,以维持进入肺部的压力平衡,保持潮气量稳定。
3 MV与CHD患儿
先天性心脏病患儿呼吸功能可能因为从左向右分流引起的肺血流增加而受到损害[2]。一些儿童心脏手术后肺阻力增加,严重者发展为术后呼吸衰竭。急性增加的肺动脉压也可产生明显的肺部力学改变。在急性肺高压期,气道阻力增加43%且顺应性下降11%[3]。严重的肺高压患者肺组织活检标本显示支气管平滑肌结构混乱,暗示同样的原因可引起支气管痉挛。辅助心导管检查可见,机械呼吸的患儿中肺血流量的增加与呼吸阻力的增长成正比[4]。患儿经过增加肺血流的手术后肺部液体量将变为原来的3倍。另外,肺部因正压通气而扩张引起自身前列腺素释放,导致肺血管扩张。这些因素都可导致肺部顺应性降低,气道压力增加,严重影响机械呼吸效果与气体交换质量,故呼吸功能不全广泛存在于心脏术后患儿,严重影响患儿预后状况。
另一个最常见的对肺部的不利影响是肺不张,据报道在经过CPB的儿童患者中出现比例高达82%[5],非心源性肺水肿与急性支气管痉挛在经历了CPB的患儿与成人中均有报道[6]。
此外,在先天性心脏病患儿中,来自心脏和大血管的结构变异造成对肺部的外部压迫,也可对肺功能产生不利影响。
呼吸机相关性肺损伤(VILI)是机械通气应用中的严重并发症,近年来备受临床医生重视。VILI是急性肺实质损伤与肺组织炎性反应,由于多种因素导致肺泡结构受损,肺水肿、肺纤维化、肺泡表面活性物质功能不全,加速肺功能不全的进展[7],其主要临床表现为:纵隔气肿、皮下气肿、气胸、张力性肺大泡等。有报道认为其临床发生率为5% ~15%[8]。VILI不仅仅造成肺局部损伤,还会引起机体全身性炎症级联反应,从而致使肺部和肺外脏器损伤,甚至诱发多器官功能衰竭,临床死亡率高[9]。
专家们提出了著名的“肺保护策略”,通过小潮气量通气(VT≤6 ml/kg)与PEEP的应用等措施,减少VILI、降低患者的病死率。但是这种策略是以牺牲通气量为代价的,临床效果存在争议[10,11]。
因此,这些因素都将影响CHD患儿术后呼吸功能的恢复,选择最符合正常生理的机械呼吸模式显得尤为重要。大部分先心病患儿能在术后24 h内撤机,但对婴幼儿(尤其是早产儿、低体重儿)、术前伴肺功能不全或PAH、复杂型先心病患儿,肺部力学的改变对血流动力学有较明显的影响,所以必须全面了解心脏手术的特点、心肺之间的相互作用和各种呼吸机模式的优缺点,选择使血流动力学最优化的MV模式。
4 NAVA应用于CHD术后患儿的优点
4.1 提高人机协调性 NAVA是利用患者自身神经反射控制呼吸机工作,在人机协调方面有两层涵义。(1)患者自身呼吸努力的起始与终止和呼吸机送气的时间点有良好的关联。(2)呼吸机辅助送气量与患者呼吸努力有良好的关联。尤其对于儿童来说,NAVA辅助与Edi成比例非常重要。传统模式下固定的触发压力、触发潮气量或时间未必可以很好的适应患儿病情变化需要。尽管在熟练应用的传统呼吸机辅助方式时可以很少发生漏触发、误触发,但在Beck等[12]观察发现NAVA模式下没有上述事件发生。在NAVA模式下,可将镇静镇痛类药物应用达到最小化且保持人机同步性,对CHD术后患儿显示出优越性:(1)减少药物对心脏及其它脏器功能的影响。(2)患儿更易自我控制,主动咳嗽促进痰液排出。
4.2 不受漏气影响 为了评估在拔管后在易漏气的非创伤性接口的情况下,NAVA是否能协调、成比例的协助通气做了研究:结果是在相同的NAVA水平伴相同的PEEP水平情况下,由于Edi的不同而导致经鼻非创伤性插管较经口的气管插管所产生的传输压明显升高,而PaO2和PaCO2并没有变化,实验表明:NAVA不受漏气的影响,可以有效的应用在即使接口处存在漏气非创伤性插管的病人,使呼吸机和患者的呼吸协调一致[13]。
4.3 有效减轻呼吸肌负荷 NAVA是一种受EAdi控制的机械通气模式。最大吸气的时候,压力传输可能达到最大水平从而可能造成肺损伤。Sinderby等[14]的研究结果表明:在健康志愿者,在最大深吸气的时候,NAVA可以安全有效的减轻呼吸肌负荷,不会影响呼吸周期,不会引起肺的过度扩张。高水平的NANA可以最大限度的减轻膈肌的工作负荷,而EAdi仍然可以出现并能控制通气。
4.4 有助于保护性机械通气 近期研究发现NAVA与小潮气量通气策略都可以减轻急性肺损伤时VILI和肺外器官损坏。与常规机械通气相比,NAVA能使氧合指数明显改善,肺组织湿干重比减轻,血浆和肺泡灌洗液中白细胞介素(IL-8)、凝血因子、组织因子和纤溶酶原激活物抑制剂(PAI)1浓度明显降低;而NAVA组心输出量、尿量、肾脏肌酐明显高于常规机械通气组,肺外组织IL-8浓度最低。尽管NAVA组与小潮气量组相比,上述参数没有统计学差异,但是大多数参数低于小潮气量组[15]。小潮气量组需要使用麻醉剂抑制呼吸,而NAVA组则不必使用,这将避免膈肌功能障碍以及药物的其他不良反应。在CHD术后患儿研究显示,应用PSV与NAVA维持同样的PaCO2水平,NAVA所需PIP明显低于PSV,提示对比PSV,NAVA更具潜在的肺保护作用。
4.5 指导PEEP选择 在婴幼儿及动物的研究中发现可以利用Edi指导PEEP选择。正常情况下,吸气时Edi增高,称为位相性Edi,呼气时Edi消失。若在呼气时Edi仍然存在,则称为紧张性Edi,位相性Edi振幅低且不规则,提示可能有ALI的存在。紧张性Edi的产生通常与肺泡塌陷、肺水肿引起的迷走神经反射激活有关,PEEP水平会影响紧张性 Edi的幅度[16]。Emeriaud等[17]研究表明,PEEP为0时,紧张性Edi明显增加,应用PEEP后,紧张性Edi降低,位相性Edi升高,是因为PEEP应用后陷闭的肺泡重新开放和功能残气量增加,肺水肿减轻,潮气量增加,呼吸幅度增加,迷走神经兴奋性降低,使膈肌张力下降,活动度增加。ALI时机械通气目标是:设定最佳PEEP与合适的潮气量以改善肺部通气与换气功能,同时避免产生VILI。在实验中,对ALI兔使用Edi的动态变化选择PEEP水平,当紧张性Edi最低时的PEEP水平,即为Edi决定的最佳PEEP水平。
4.6 指导机械通气患者撤机 撤机失败的患者常因呼吸负荷增加或膈肌收缩功能下降,引起呼吸中枢驱动增加,导致撤机失败[18]。由于Edi能够较好的反映呼吸中枢驱动与膈肌通气效能,所以联合潮气量及气道压数值,膈肌电活动有可能用于指导撤机工作[19]。有研究显示,撤离呼吸机后需要重新进行气管插管或无创通气的CHD术后患儿,在重新操作之前Edi信号强度明显高于其他成功撤机患儿,暗示Edi是呼吸负荷量的指示,拔管后Edi持续增加的患儿可能需要再插管或无创通气[20]。
4.7 有助于诊断膈肌功能不全 CHD手术过程中有损伤膈神经的可能,术后患儿自主呼吸时Edi信号消失或太微弱,确认Edi导管位置正确后,应该考虑术后双侧膈神经受损的可能,这有助于我们诊断术后膈肌功能不全。研究显示膈肌功能不全常见于机械通气的患者,且可能与导致撤机失败相关[21]。尽管如此,呼吸机可自动在1/2个呼吸暂停期内将NAVA模式转换为PSV模式,如果Edi再次出现,呼吸机将安全警告,人工可再次转为NAVA模式。若全部呼吸暂停期内无神经或吸气触发,NAVA/PSV模式将被IPPV模式取代。在NAVA应用与监护期间,需要注意镇静药物的应用后可能产生呼吸中枢抑制导致Edi信号消失,应注意鉴别。这点在新生儿与早产儿中尤为明显,可能与其自身呼吸中枢尚未发育成熟有关。患儿镇静程度与Edi有负相关性,镇静过深会减弱患者呼吸中枢对膈肌的呼吸驱动,延长机械通气时间。所以适宜的镇静程度对于缩短机械通气时间及住院时间有帮助。
5 NAVA模式的未来展望
NAVA是一种新型机械通气模式,与以往由时间决定或患者气道内压力、气流速度变化而触发呼吸机的传统通气模式不同,患者呼吸中枢直接控制呼吸机,吸气触发和呼气转换均由膈肌Edi变化控制,因而两者的关系更紧密,反应更迅速,大大减少传统机械通气模式所引起的人机对抗、反应滞后、辅助不足或过度、误触发、漏触发等问题。
应用机械通气时,临床医生应该掌握呼吸系统的生理和病理生理机制以及患者和机器的相互影响,NAVA也不例外。以往研究中发现,NAVA组平均潮气量为3 ml/kg,比传统认为具有肺保护效应的6 ml/kg更低,这是NAVA模式产生肺保护效应的根本原因吗?同时我们又提出了疑问:肺保护策略通气策略中最佳潮气量是多少?6 ml/kg是否是最佳,还是因人而异?如果使用NAVA模式或许就只要患者利用自身的生物反馈体系自我选择,这些有待临床研究去探索。而对频繁呕吐(曾遇1例置入Edi导管后严重呕吐,只能将导管撤出,应用SIMV+PS传统通气模式)、呼吸中枢、膈神经、神经肌接头处受损的患者是否能应用NAVA及如何应用则应进行更多的研究。NAVA技术在成为临床常用技术之前我们还有很多工作要做。
1 Sinderby C,Beck J,Spahija J,et al.Voluntary activation of the human diaphragm in health and disease.J Appl Physiol,1998,85:2146-2158.
2 Greenspan JS,Davis DA,Russo P,et al.Infant thoracic surgery:procedure-dependent pulmonary response.J Pediatr Surg,1996,31:878-880.
3 DiCarlo JV,Raphaely RC,Steven JM,et al.Pulmonarymechanics in infants after cardiac surgery.Crit Care Med,1992,20:22-27.
4 Freezer NJ,Lanteri CJ,Sly PD.Effect of pulmonary blood flow on measurements of respiratory mechanics using the interrupter technique.J Appl Physiol,1993,74:1083-1088.
5 Emhardt JD,Moorthy SS,Brown JW,et al.Chest radiograph changes after cardiopulmonary bypass in children.J Cardiovasc Surg(Torino),1991,32:314-317.
6 Kawahito S,Kitahata H,Tanaka K,et al.Bronchospasm induced by cardio-pulmonary bypass.Ann Thorac Cardiovasc Surg,2001,7:49-51.
7 Attar MA,Donn SM.Mechanisms of ventilator-induced lung injury in premature infants.Semin Neonatol,2002,7:353-360.
8 Priestley MA,Helfaer MA.Approaches in the management of acute respiratory failure in children.Curr Opin Pediatr,2004,16:293-298.
9 Tobin MJ.Advances in mechanical ventilation.N Engl J Med,2001,344:1986-1996.
10 Amato MB,Barbas CS,Medeiros DM,et al.Effect of aprotective-ventilation strategy on mortality in the acute respiratory distress syndromeN.Eng J Med,1998,338:347-354.
11 Anon.Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome.The Acute Respiratory Distress Syndrome Network.N Engl J Med,2000,342:1301-1308.
12 Beck J,Reilly M,Grasselli G,et al.Patient-ventilator Interaction during neurally adjusted ventilatory assist in low birth weight infants.Pediatr Res,2009,65:663-668.
13 Beck J,Brander L,Slutsky AS,et al.Non-invasive neurally adjusted ventilatory assist in rabbits with acute lung injury.Intensive Care Med,2008,34:316-323.
14 Sinderby C,Beck J,Spahija J,et al.Inspiratory muscle unloading by neurally adjusted ventilatory assist during maximal inspiratory efforts in healthy subjects.Chest,2007,131:711-717.
15 Brander L,Sinderby C,Lecomte F,et al.Neurally adjusted ventilatory assist decreases ventilator-induced lung injury and non-pulmonary organ dysfunction in rabbits with acute lung injury.Intensive Care Med,2009,35:1979-1989.
16 Allo JC,Beck JC,Brander L,et al.Influence of neurally adjusted ventilatory assist and positive end-expiratory pressure on breathing pattern in rabbits with acute lung injury.Crit Care Med,2006,34:2997-3004.
17 Emeriaud G,Beck J,Tucci M,et al.Diaphragm electrical activity during expiration in mechanically ventilated infants.Pediatr Res,2006,59:705-710.
18 Petrof BJ,Jaber S,Matecki S.Ventilator-induced diaphragmatic dysfunction.Curropincrit Care,2010,16:19-25.
19 Beck J,Gottfried SB,Navalesi P,et al.Electrical activity of the diaphragm during pressure support ventilation inacute respiratory failure.Am J Respir Crit Care Med,2001,164:419-424.
20 Liu HG,Wu AP,Yang Y,et al.Survey and application of Edi.Chin J Respir Crit Care Med,2010,9:447-450.
21 Jaber S,Jung B,Matecki S,et al.Clinical review:ventilator-induced diaphragmatic dysfunction-human studies confirm animal model findings.Crit Care,2011,15:206.

