扶正化瘀方对大鼠肝再生过程中cyclinD1影响的实验研究
张玉果 赵素贤 李建梅 任伟光 李亚 南月敏
前期动物实验表明扶正化瘀方可提高大鼠肝大部切除后24 h的肝再生速度。本实验拟进一步验证扶正化瘀方对大鼠肝再生的影响,采用大鼠肝大部切除(partial hepatectomy,PH)肝再生模型,以促肝细胞生长素(hepatocyte growth promoting factors,pHGF)为阳性对照药物,研究扶正化瘀方对大鼠肝大部切除后72 h cyclinD1和肝再生的影响,探讨扶正化瘀方促进肝再生的可能作用机制。
1 材料与方法
1.1 动物与试剂 清洁级雄性Wistar大鼠24只,体重240~280 g,购自河北医科大学实验动物学部(合格证号:1201030)。扶正化瘀方药液为由上海黄海制药有限责任公司生产的扶正化瘀胶囊用蒸馏水配制成75 g/L。促肝细胞生长素(pHGF)购自长春富春制药有限公司,批号 H20058141。兔抗人cyclinD1单克隆抗体购自北京中杉金桥生物技术有限公司。GAPDH、cyclinD1引物由上海生工生物工程技术服务有限公司合成。FastQuant cDNA第一链合成试剂盒和RealMasterMix购自天根生化科技(北京)有限公司。
GAPDH上游引物:5'-ACCACAGTCCATGCCATCAC-3',GAPDH下游引物:5'-TCCACCACCCTGTTGCTGTA-3';cyclinD1上游引物:5'-GCACAACGCACTTTCTTTCC-3',cyclinD1下游引物:5'-TCCAGAAGGGCTTCAATCTG-3'。
1.2 动物分组 将雄性Wistar大鼠随机分为假手术组(对照组)、模型(PH)组、PH+扶正化瘀组和PH+pHGF组,每组6只。于实验前3 d至实验结束,扶正化瘀组给予扶正化瘀药液灌胃1 ml/100 g,pHGF组给予腹腔注射pHGF 1 ml/100 g,对照组、模型组均给予腹腔注射0.9%氯化钠溶液1 ml/100 g,1次/d。
1.3 造模方法 大鼠自由喂养1周后,术前12 h禁食,术前6 h禁饮,按照秦建民等[1]介绍的方法在无菌条件下操作,用1%戊巴比妥钠(用量40 mg/kg)腹腔注射麻醉大鼠,在大鼠上腹部做一个纵形长约1 cm的切口,暴露左叶和中叶,在其根部结扎,切除肝脏左叶和中叶(占70%),术毕皮下给予0.9%氯化钠溶液1 ml,缝合切口,消毒。对照组大鼠仅切开腹腔暴露出肝左叶和中叶,随后送入腹腔,术后自由饮食物和水,术后72 h处死动物,切取全部再生肝组织,称取湿重。取相同部位肝组织(1.0 cm ×0.5 cm ×0.5 cm)两块,一块以10%甲醛溶液固定,用于肝组织学观察和免疫组化染色,另块置于5 ml冻存管立即放入-80℃冰箱保存用于肝组织总RNA提取。
1.4 指标检测
1.4.1 肝脏再生速度:[C -(A -B)/A]×100%,A=B/0.7,即估计全肝重;B=PH时切除的肝叶湿重;C=处死动物时再生肝脏湿重。
1.4.2 肝组织学检查:取肝组织经10%甲醛固定24 h后,常规脱水、石蜡包埋,连续切片(厚约4 μm),经苏木素-伊红(hematoxylin and eosin,HE)染色,光学显微镜下观察肝组织病理学改变。有丝分裂指数:每份标本随机选取400×视野10个,应用Image-Pro 5.0图像分析软件计算每个视野中有丝分裂肝细胞数占肝细胞总数的比例。cyclinD1免疫组化染色并结合图像半定量分析计算肝细胞核阳性率。
1.4.3 肝组织cyclinD1 mRNA的表达情况:采用荧光定量RTPCR检测。
1.5 统计学分析应用SPSS 13.0统计软件,计量资料以表示,采用单因素方差分析(one-way ANOVA),多个样本均值间两两比较用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 动物的一般情况 假手术组PH术后1~2 h即可自由饮水、进食,实验结束时解剖肝脏如正常肝脏鲜红色。PH组、PH+扶正化瘀组和PH+pHGF组术后1~2 h清醒,活动力差,需协助饮水,4~6 h后可自由饮水、进食。4组手术及术后死亡率均为0。
2.2 肝脏再生速度 与PH组比较,PH+pHGF组和PH+扶正化瘀组大鼠肝再生速度显著升高(P<0.05),而PH+扶正化瘀组和PH+pHGF组差异无统计学意义(P>0.05)。见表1。
表14组PH后72 h肝再生速度n=6,%,±s

表14组PH后72 h肝再生速度n=6,%,±s
注:与PH组比较,*P <0.05
?
2.3 肝组织学观察
2.3.1 一般形态学观察:正常肝小叶肝细胞板排列有序,多为单排,以中央静脉为中心呈放射状,肝细胞大小较一致,少数双核肝细胞,很少见核分裂(图1)。PH后72 h肝细胞板部分呈双排,肝细胞明显增大,肝细胞及核大小不一,小叶中间带可见多数双核肝细胞及有丝分裂,间质细胞反应活跃(图2)。
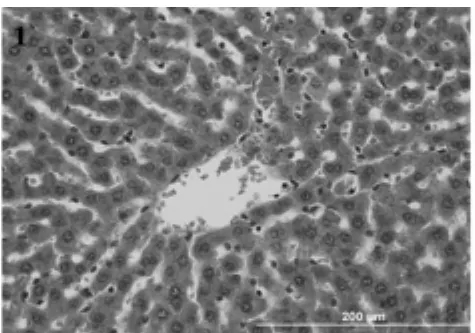
图1 正常肝小叶肝细胞板多为单排,以中央静脉为中心呈放射状,很少见核分裂(HE×40)
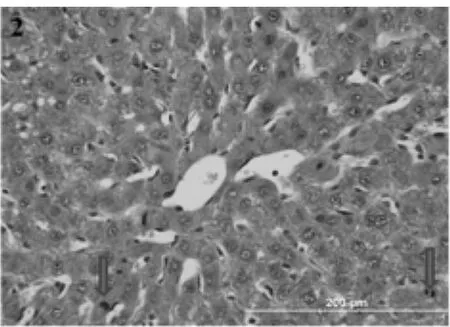
图2 PH后72 h肝细胞板部分呈双排,可见多数双核肝细胞(细箭头)及有丝分裂(粗箭头),间质细胞反应活跃(HE×40)
2.3.2 有丝分裂指数:假手术组很少见到有丝分裂,与假手术组比较,PH组、PH+pHGF组和PH+扶正化瘀组PH术后3 d有丝分裂指数显著升高(P<0.05),与PH组比较,PH+pHGF组和PH+扶正化瘀组有丝分裂指数显著升高(P均<0.05),而PH+扶正化瘀组和PH+pHGF组差异无统计学意义(P>0.05)。见表2。
表2 PH术后72 h 4组有丝分裂指数n=6,%,±s

表2 PH术后72 h 4组有丝分裂指数n=6,%,±s
注:与假手术组比较,*P <0.05;与PH组比较,#P <0.05
?
2.3.3 cyclinD1免疫组化染色:与假手术组比较,PH组、PH+pHGF组和PH+扶正化瘀组大鼠肝组织cyclinD1肝细胞核阳性率显著升高(P<0.05);与PH组比较,PH+pHGF组和PH+扶正化瘀组大鼠肝组织cyclinD1肝细胞核阳性率显著升高(P均<0.05),而PH+扶正化瘀组和PH+pHGF组差异无统计学意义(P>0.05)。见表3。
表3 PH术后72 h 4组肝细胞核cyclinD1阳性表达率n=6,%,±s
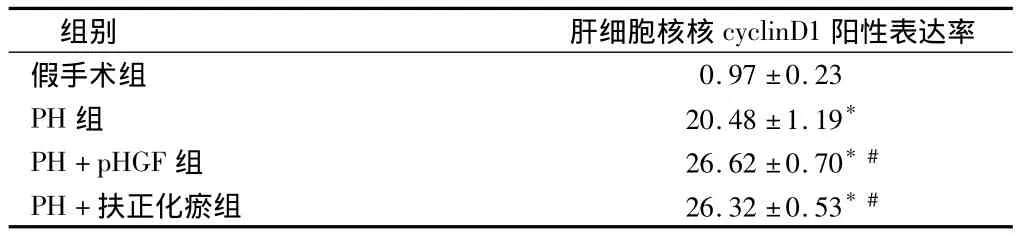
表3 PH术后72 h 4组肝细胞核cyclinD1阳性表达率n=6,%,±s
注:与假手术组比较,*P <0.05;与PH组比较,#P <0.05
?
2.4 肝组织cyclinD1 mRNA的表达 与假手术组比较,PH组、PH+pHGF和PH+扶正化瘀组大鼠肝组织cyclinD1表达均显著升高(P均<0.05);与PH组比较,PH+pHGF组和PH+扶正化瘀组大鼠肝组织cyclinD1表达均显著升高(P均<0.05),PH+pHGF组和PH+扶正化瘀组大鼠肝组织cyclinD1表达差异无统计学意义(P>0.05)。见表4。
表4 PH术后72 h 4组肝组织cyclinD1 mRNA表达情况n=6,±s

表4 PH术后72 h 4组肝组织cyclinD1 mRNA表达情况n=6,±s
注:与假手术组比较,*P <0.05;与PH组比较,#P <0.05
?
3 讨论
肝脏再生是一个包括多种细胞增殖,是由多条通路、多种因素共同参与的一种复杂而又精确的生理过程,最终达到肝组织结构的重建及肝功能恢复。近期研究认为一些因素包括因子、药物等可影响肝脏再生[2,3]。扶正化瘀方由丹参、虫草菌丝、桃仁、五味子、松花粉和绞股蓝等六味中药组成,既往研究多注重于其抗纤维化作用,对肝再生的影响尚无实验依据。本研究以肝再生增殖阶段重要的细胞因子肝细胞生长因子(hepatocyte growth factor,HGF)[4]为阳性对照药物,比较正常大鼠PH后72 h PH组、PH+pHGF和PH+扶正化瘀组间肝再生速度、有丝分裂指数的差别,表明扶正化瘀方具有同HGF类似的促进肝再生的作用。
大鼠70%肝部分切除后10~14 d可完全恢复缺失肝组织,期间各种细胞迅速有序增殖,剩余的肝细胞大部分在术后24 h达到DNA合成高峰,少部分肝细胞会出现第二次DNA合成[5]。细胞周期素D1(cyclinD1)是G1期进展的限速控制因素,被认为是细胞进入细胞周期G1期的标志,大鼠肝大部切除术后24 h肝细胞核 cyclin D1蛋白表达达到高峰[6],马克学等[7]研究大鼠肝再生过程中cyclinD1的动态变化表明PH后72~96 h出现第二次高峰。本研究结果显示PH+pHGF和PH+扶正化瘀组大鼠PH后72 h肝组织cyclin D1 mRNA和肝细胞核cyclin D1蛋白表达均显著高于单纯PH组,而PH+pHGF和PH+扶正化瘀组间无显著性差别,表明扶正化瘀方可上调大鼠PH术后72 h肝脏cyclin D1的表达。
综上所述,扶正化瘀方可上调正常大鼠肝大部切除术后72 h肝细胞cyclinD1的表达,促进肝再生。为临床医生解决如何促进肝损伤后肝再生和肝功能恢复提供了新的实验证据和治疗选择。
1 秦建民,刘淑琴,曾锦章,等.转化生长因子β1在大鼠肝再生过程中表达变化的实验研究.中华普通外科杂志,2004,19:180-181.
2 陈国栋,刘玉兰,尤鹏,等.粒细胞集落刺激因子促进小鼠肝再生的作用.世界华人消化杂志,2006,14:1466-1470.
3 李天兴,朱清静,蔡艳萍,等.大黄对大鼠肝再生过程中cyclinD1影响的实验研究.中国中西医结合消化杂志,2010,18:227-229.
4 Ogura Y,Hamanoue M,Tanabe G,et al.Hepatocyte Growth Factor Promotes liver regeneration and Protein Synthesis after Hepatectomy in Cirrhotic Rats.Hepato-Gastroenterology,2001,48:545-549.
5 Michalopoulos GK.Liver regeneration.J Cell Physiol,2007,213:286-300.
6 Jaumot M,Estanyol JM,Serratosa J,et al.Activation of cdk4 and cdk2 during rat liver regeneration is associated with intranuclear rearrangements of cyclin-cdk complexes.Hepatology,1999,29:385-395.
7 马克学,席兴宇,李玉昌.大鼠肝再生中CyclinD1、PCNA的动态变化.河南师范大学学报(自然科学版),2005,33:97-99.

