DC-CIK生物治疗联合肝动脉灌注化疗治疗肝癌的短期临床观察
尤振宇 苏晓辉 刘洋
原发性肝癌是最常见的恶性肿瘤之一,因其恶性程度高,进展快,预后常较差。研究证明,DC-CIK能够显著提高抗肿瘤活性及IFN-γ的分泌,增加 CD3(+)CD56(+)细胞和 CD3(+)CD8(+)细胞的比率,并促进细胞分化[1]。2009年6月至2012年1月,采用介入治疗及DC-CIK生物治疗晚期肝癌236例。其中,单纯介入治疗118例,介入+DC-CIK生物治疗118例。取得一定疗效,报告如下。
1 资料与方法
1.1 一般资料 2009年6月至2012年1月中国人民解放军202医院肿瘤介入科所收治诊断为原发性肝癌患者。随机分为试验组(介入治疗+DC-CIK生物治疗)和对照组(介入治疗)。随机分组方法:将符合纳入标准的患者按入院顺序自动排序,得到序号;在每个序号数字之后生成一个随机数,函数是=RAND();将随机数按从小到大顺序进行重新排序,得到新序号。在新序号中位于奇数位置的患者分在实验组,位于偶数位置的患者分在对照组。符合纳入标准者244例,其中8例失访,随访完整的236例临床资料特征。见表1。

表1 2组患者临床特征 n=118,例
1.2 纳入标准 (1)原发性肝癌临床诊断明确。诊断及分期参照2001年9月广州第八届全国肝癌会议所制定标准:①AFP≥400 μg/L,能排除妊娠、生殖系胚胎源性肿瘤、活动性肝病及转移性肝癌,并能触及肿大、坚硬及有大结节状肿块的肝脏或影像学检查有肝癌特征的占位性病变者。②AFP<400 μg/L能排除妊娠、生殖系胚胎源性肿瘤、活动性肝病及转移性肝癌,并有两种影像学检查有肝癌特征的占位性病变或有两种肝癌标志物阳性及一种影像学检查有肝癌特征的占位性病变者。③有肝癌临床表现并有肯定的肝外转移病灶(包括肉眼可见的血性腹水或在其中发现癌细胞),并能排除转移性肝癌者。(2)
临床分期为ⅡB期以下,无外科手术指征。(3)CT检查示肝内病灶数不超过4个病灶,边界较清楚;(4)肝功能Child-Pugh分级为A或B级。(5)年龄不超过70岁,卡氏评分不小于70。(6)治疗前血常规、凝血功能及肝、肾功基本正常,且无其他介入治疗、化疗禁忌证。病例排除标准:(1)弥漫性肝癌;(2)一般状态差,不能耐受介入治疗者;(3)DSA造影显示中重度肝动脉-门静脉瘘或肝动脉一肝静脉瘘者。
1.3 方法
1.3.1 介入化疗:患者接受2~4次肝动脉化疗栓塞术,治疗间隔30~45 d。插管和造影技术按常规操作执行。术中化疗用药为:奥沙利铂100~160 mg用于化疗灌注,表柔比星20~40 mg与超液化碘油(用量为10~20 ml)做成乳剂栓塞。
1.3.2 DC-CIK 治疗方案:分离血细胞经培养后第 4、8、12、16天回输CIK,第8、12天皮下注射DC。肝动脉灌注治疗每两周期之间应用生物治疗。
1.4 评价标准
1.4.1 病灶改变:2000年美国国立癌症研究所推出的实体瘤反应评价标准,即RECIST。由于此标准没有考虑到肿瘤活性变化,2008年美国肝病学会采纳了存活肿瘤的概念,并提出了改良RECIST标准,用于评估肝癌治疗疗效[2],其内容为:CR:所有靶病灶动脉期强化消失;PR:同基线相比,所有靶病灶存活肿瘤最大径总和缩小30%以上;PD:靶病灶存活肿瘤最大径总和增加20%以上或出现新病灶;SD:病灶缩小未达PR或增加未至PD。研究证明:RECIST标准低估原发性肝癌化疗栓塞术局部治疗的效果[3]。改良RECIST标准与EASL(欧洲肝病学会标准)对疗效评价一致性程度,且改良RECIST标准在临床实践中更简便易行。
1.4.2 2组AFP下降大于20 ng/ml患者比率:临床受益率采用与治疗前比较,Karnofsky评分改善大于20分,体重变化增加5%,疼痛变化缓解50%以上的患者比率。其中疼痛为肿瘤所致疼痛。疼痛评价标准为数字疼痛分级法:0为无痛,10为最剧烈疼痛,让患者自己圈出最能代表其疼痛程度的数字。
1.4.3 免疫学评价:T淋巴细胞 rDNA转录活性分析:Ag-NORs为RNA聚合酶的亚单位,反映rRNA的转录效率和淋巴细胞活性。I.S=核仁积分面积/细胞核积分面积×100%。
1.5 统计学分析计数资料采用χ2检验,计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组近期疗效比较 试验组有效率和疾病控制率分别为42.4%和78.0%。对照组有效率和疾病控制率分别为32.2%和71.2%。2组差异无统计学意义(P>0.05)。见表2。
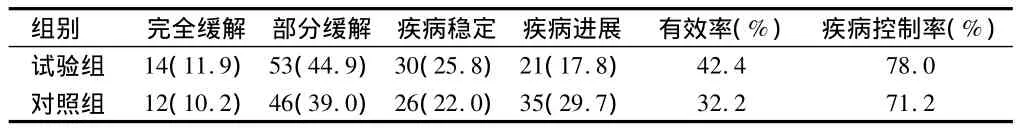
表2 2组近期疗效 n=118,例(%)
2.2 毒性反应 试验组1级骨髓抑制19例(19.2%),2级骨髓抑制4例(1.3%);对照组1级骨髓抑制22例(20.5%),2级骨髓抑制6例(2.6%),2组差异无统计学意义(P>0.05)。试验组胃肠道反应34例(24.4%),对照组38例(25.6%)。2组差异无统计学意义(P>0.05)。
2.3 肿瘤标记物检测 经治疗,试验组肿瘤标记物AFP下降>20 ng/ml 94例(79.7%),对照组 78 例(66.1%)。2 组比较差异有统计学意义(P<0.05)。
2.4 生活质量变化 治疗后与治疗前比较,试验组Karnofsky评分增加大于20分98例(83.1%),对照组80例(67.8%);试验组体重增加大于5%的57例(48.3%),对照组为41例(34.7%);试验组疼痛减轻大于50%者78例(66.1%),对照组61例(51.7%)。这三项指标2组差异有统计学意义(P<0.05)。
2.5 免疫学评价 试验组 Ag-NORs的 I.S均值为(5.76±0.14),对照组为(4.84 ±0.09),2 组差异有统计学意义(P<0.05)。
3 讨论
肝癌在我国发病率高,是第二位的肿瘤致死原因。由于起病隐匿,大半的原发性肝癌就诊时已进入中晚期,手术切除率低。经导管肝动脉化疗栓塞术由于其创伤小,超选灌注,局部药物浓度高等优点成为当前主要的治疗手段。但单一采取TACE的局限性在于肿瘤较大或乏供血则难以完全栓塞病灶。
近年来DC-CIK免疫治疗已成为较成熟的肿瘤新疗法。树突状细胞(DC)是体内抗原递呈细胞,处于启动、调控并维持免疫应答的中心环节。利用负载肿瘤抗原的DC作为瘤苗,能有效打破机体对肿瘤的耐受,激活T淋巴细胞,杀伤并清除肿瘤细胞。细胞因子活化的杀伤细胞(CIK)可以直接杀伤肿瘤细胞,与DC共同发挥着免疫治疗作用,有临床应用作为术后预防肿瘤复发的治疗[4]。
本研究采用肝动脉灌注化疗联合DC-CIK生物治疗,有效率达到42.4%,疾病控制率达到78.0%。按统计学分析,不优于单纯灌注化疗组。联合治疗组有效率有疾病控制率均较单纯介入化疗组略高,说明DC-CIK生物治疗在与其他治疗联合时可能起到一定的协同抗肿瘤作用,但是从短期疗效上对比,加用DC-CIK生物治疗并未提高短期疗效。
徐永茂等[5]研究表明,DC-CIK治疗有预防肿瘤复发的疗效。对比本文研究结果,似乎疗效相差很大。分析可能原因是术后患者肿瘤负荷非常小,而本文所涉及患者,其肿瘤负荷较大。DC-CIK生物治疗可能对肿瘤负荷较大者短期疗效不明显。研究发现,联合治疗比单纯介入化疗临床受益率高,Karnofsky评分增加大于20分占83.1%,而对照组为67.8%,体重增加超过5%者占47.5%,而对照组为34.7%,疼痛减轻较原来大于50%者占66.1%,而对照组为51.7%。DC-CIK治疗实体肿瘤,患者的肿瘤标记物和免疫功能明显改善[6]。本研究中,AFP下降试验组高于对照组。Ag-NORs 2组差异显著。Ag-NORs为RNA聚合酶的亚单位,反映rRNA的转录效率,间接反映机体免疫状态,对肿瘤疗效及预后具有重要意义[7]。其他研究也证实了DC-CIK生物治疗是可行的[8],可以增加患者的免疫能力[9]。联合DC-CIK生物治疗后,对患者无不良反应。研究中,骨髓抑制和胃肠道反应2组差异无统计学意义。恶性肿瘤经化疗后免疫力降低,应用DC-CIK细胞治疗,可以提高恶性肿瘤患者的免疫功能[10]。本研究证实两者联合治疗具有很好的安全性。
综上所述,DC-CIK生物治疗联合介入化疗不能提同肝癌患者短期疗效,但从患者生活质量提高上可起到积极作用。介入化疗联合DC-CIK生物治疗治疗晚期肝癌具有可行性和较好的应用前景。因研究未进行长期的疗效观察,还需进一步研究观察其远期效果。
1 QiJing Wang,Hui Wang,Ke Pan,et al.Comparative study on antitumor immune response of autologous cytokine-induced killer(CIK)cells,dendritic cells CIK(DC-CIK),and semi-allogeneic DC-CIK.Chinese Journal of Cancer,2010,29:641-648.
2 Llovet JM,Di Bisceglie AM,Bruix J,et al.Design and endpoints of clinical trials in hepatocellular carcinoma.J Natl Cancer Inst,2008,100:698-711.
3 余文昌,张孔志,陈示光,等.实体瘤反应评价标准、欧洲肝病学会和改良实体瘤反应评价标准评价原发性肝癌化疗栓塞效果一致性的比较.中华放射学杂志,2011,45:766-769.
4 高岱清,刘淑贞,赵鹏,等.恶性肿瘤术后DC联合CIK治疗的临床观察.中华肿瘤防治杂志,2009,16:222-225.
5 徐永茂,徐冬云,张南征,等.NP方案化疗同步放疗并序贯过继免疫细胞治疗非小细胞肺癌的临床研究.中华肿瘤防治杂志,2011,18:1032-1035.
6 Tao Yang,Ying Xiang,Yucheng Li,et al.Clinical Study of co-treatment with DC-CIK cells for advanced solid carcinomas.Chinese-German Journal Clinical Oncology.2011,10:354-359.
7 宗登伟,郭晨阳,黎海亮,等.肝动脉化疗栓塞加灌注治疗胃癌肝转移疗效评价.河北医药,2011,33:2301-2303.
8 Mesiano G,Todorovic M,Gammaitoni L,et al.Cytokine-induced killer(CIK)cells as feasible and effective adoptive immunotherapy for the treatment of solid tumors.Expert Opin Biol Ther,2012,12:673-84.
9 Zhou P,Liang P,Dong B,et al.Phase Ⅰ clinical study of combination therapy with microwave ablation and cellular immunotherapy in hepatocellular carcinoma.Cancer Biol Ther,2011,11:450-456.
10 吴宝英,周红霞,韩俊杰,等.肝动脉灌注栓塞术治疗肝癌的护理.中国基层医药,2012,19:306-308.

