脑电双频指数监测在肝硬化全麻患者中的应用分析
赵佳平 胡海立 侯米莎 张彦芳
肝硬化患者肝细胞受到病原微生物和化学毒物侵害后,由于直接毒性作用或细胞内酶系统的抑制,药物代谢功能降低。导致其麻醉用药量及麻醉深度不易掌控,麻醉风险增加,拔管及苏醒时间延长。本文以肝硬化门脉高压,脾切除,食道静脉横断手术患者40例为观察对象,探讨脑电双频指数(BIS)在肝硬化全凭静脉麻醉中的应用价值。
1 资料与方法
1.1 一般资料 选取肝硬化门脉高压,脾切除及食道贲门、胃底静脉断流手术患者40例,男28例,女12例;年龄37~65岁。所有患者肝功能Child-Pugh分级均为B级。按手术顺序随机分为BIS组和对照组,每组20例。
1.2 麻醉方法 所有患者术前注射安定10 mg,阿托品0.5 mg,入室后建立静脉通路,输入复方乳酸林格氏液,连接欧美达S/5 Avance麻醉机监护仪,监测心电图,无创血压,血氧饱和度,呼气末二氧化碳分压,行桡动脉穿刺有创血压监测。BIS组常规清洁额头皮肤将监测电极贴于患者前额正中,左侧眉弓上2 cm,左眼角外1 cm处,连接麻醉深度监护仪持续监测。
1.2.1 麻醉诱导及麻醉管理:2组患者均静脉给予格拉司琼3 mg后依次静脉注射咪唑安定0.2~0.3 mg/kg,舒芬太尼0.3 ~0.4 μg/kg,用 Module Dps Orchestra IS3 泵输注丙泊酚3 μg/ml血浆靶控(TCI)。BIS组患者BIS值55±5时,对照组患者意识消失后静脉注射顺式阿曲库安0.1 mg/kg,3 min后对照组行气管插管,BIS组患者BIS值40~50行气管插管。2组患者插管后均连接欧美达S/5 Avance型麻醉机控制呼吸。术中丙泊酚3 μg/ml血浆靶控(TCI),间断静脉注射舒芬太尼0.2 μg/kg,顺式阿曲库铵 0.04 ~ 0.06 mg/kg。术中根据监测情况输注复方乳酸钠林格氏液,万汶,维持循环稳定,手术结束前30 min停止使用舒芬太尼及顺式阿曲库铵,缝合皮肤停用丙泊酚。术中心率低于50次/min时静脉注射阿托品0.5 mg,血压低于术前20%时予多巴胺20 mg 0.9%氯化钠溶液稀释20 ml泵入,根据血压情况调整用量。术毕自主呼吸恢复后静脉注射阿托品0.5 mg,新斯地明1 mg拮抗残留的肌松作用。
1.2.2 麻醉深度:BIS组根据BIS值调整麻醉药剂量,使BIS维持在50±5;对照组根据血压、心率变化调整丙泊酚用剂量维持患者循环稳定及麻醉深度。
1.2.3 监测指标:记录患者诱导前(T0)、诱导后(T1)、手术30 min(T2)、术毕(T3)、拔管时(T4)平均动脉压、心率变化及麻醉期间丙泊酚、舒芬太尼、阿曲库铵的总用量,记录拔管时间、清醒时间,所有患者手术室完全清醒后返回病房。术后24 h随访患者术中知晓情况。
1.3 统计学分析应用SPSS 13.0统计软件,计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组拔管时间、清醒时间、手术时间比较 2组拔管时间和清醒时间比较,差异有统计学意义(P<0.05)。2组手术时间比较差异无统计学意义(P>0.05)。见表1。
表1 2组手术各时段时间比较n=20,±s
注:与对照组比较,*P <0.01
?
2.2 麻醉诱导及手术期间平均动脉压、心率的变化 2组患者诱导时(T1)的平均动脉压均有所下降,但对照组下降的幅度明显大于BIS组,在其他各时点对照组平均动脉压波动较明显。2组患者心率变化差异无统计学意义(P>0.05)。见表2。
表2 2组各时段平均动脉压和心率情况比较n=20,±s
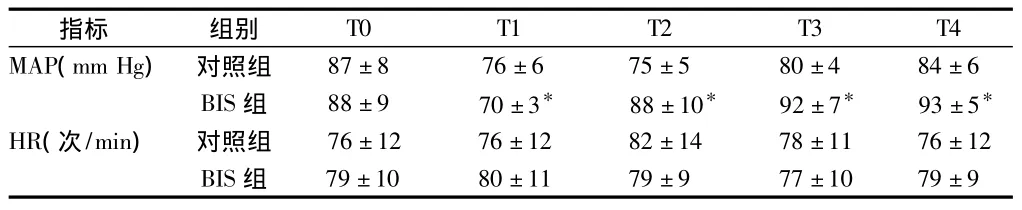
表2 2组各时段平均动脉压和心率情况比较n=20,±s
注:与对照组比较,*P <0.05
?
2.3 麻醉药用量情况 丙泊酚、舒芬太尼、顺式阿曲库铵总用量比较,BIS组用药量少于对照组(P<0.01)。见表3。
表3 麻醉药用量比较n=20,±s

表3 麻醉药用量比较n=20,±s
注:与对照组比较,*P <0.01
?
2.4 不良反应比较 麻醉期BIS组有2例患者需要多巴胺泵入调整血压,1例患者应用阿托品调整心率。对照组有5例患者需要多巴胺泵入调整血压,3例患者应用阿托品调整心率。2组患者术后随访均未出现术中知晓。
3 讨论
肝硬化的主要特征是由于肝组织的损害,引起弥漫的结缔组织增生和结节形成,导致正常肝小叶结构破坏和肝内循环障碍。
3.1 肝硬化对麻醉药代谢影响 肝脏是机体中最大的实质器官,参与体内物质和能量代谢。围术期绝大多数药物都要在肝脏进行生物转化,药物代谢酶是参与各种化学物质在体内生物转化的重要酶系,可分为Ⅰ相酶和Ⅱ相酶。Ⅰ相酶主要为细胞色素P450(CYP450),催化底物的氧化、还原、水解反应,使其代谢激活或灭活;而Ⅱ相酶主要为谷胱甘肽巯基转移酶、尿苷二磷酸葡萄糖醛酸转移酶等参与结合反应,加速药物或化学毒物本身及代谢产物以结合物的形式排出体外。CYP450代谢酶主要在肝脏合成,肝脏中活性最高。Ⅱ相酶也主要在肝脏中分布[1]。肝脏在疾病状态下将影响很多药物的代谢。人体内参与外源物代谢的CYP450s主要是P450I-IV家族中的同工酶,包括 CYPlA2、CYP2C9/10、CYP2C19、CYP2D6、CYP2E1 和 CYP3A4等[2]。CYP3A是人体CYP450家族中酶蛋白含量最高的酶,成人体内主要有CYP3A4和CYP3A5,而CYP3A7主要分布在胎儿体内。成人体内分布于肝脏和肠道的主要是CYP3A4,而CYP3A5则主要分布在肾脏。地西泮、咪唑安定、芬太尼等临床常见静脉全麻药的主要靶酶均为CYP3A4,因此肝硬化患者CYP3A4下降[3],将减慢上述药物脱烃和羟化反应的速率,使其代谢明显降低。
有学者从人体肝脏中分离出肝微粒体酶,其亚型参与了丙泊酚 的 代 谢,包 括 CYP2C9、CYP2A6、CYP2C8、CYP2C18、CYP2C19和CYPlA2,并指出CYP2C9至少参与了丙泊酚50%的氧化代谢,尤其是在较低的底物浓度时。CYP2C9在人体中主要分布于肝脏、肾脏和小肠。
目前有研究证实丙泊酚主要通过肝脏代谢,90%以上的药物与肝内葡萄糖醛酸或硫酸结合,形成1'或4'-葡萄糖醛酸或硫酸根丙泊酚,主要从尿液中排出。阿曲库铵和顺式阿曲库铵,主要通过Hofmann消除,不依赖肝脏清除,在肝硬化患者可常规使用。由于影响麻醉药代谢的因素十分复杂,摄取、分布、结合、消除等诸多环节都很重要,但肝硬化患者药酶含量及活性的改变从生物转化的根本环节上决定了药物的清除速率和效率,是用药时必须考虑的一个关键因素[5]。提示我们在肝硬化患者临床麻醉时应从药酶改变这一角度考虑减低患者的麻醉药用量。
3.2 BIS在肝硬化患者麻醉中的应用 肝病患者由于肝脏药物代谢障碍,术中恰当的麻醉用药和麻醉深度非常必要,既要避免增加患者的肝脏负担,又要防止术中知晓的发生。由于镇静药,肌松药和镇痛剂等药物的联合麻醉,传统的依靠血压、心率、肌肉松弛度等临床体征判断麻醉深度方法已经不能确切的反映麻醉的深度。肝硬化患者的生理病理特点导致麻醉深度不易控制,在全麻期间对患者麻醉深度的监测尤为重要。
BIS是通过复杂的数学方法分析不同频率脑电波的谐波与时相关系,基于对大量临床数据的分析,将相互独立的脑电变量整合为一个一维变量来反应镇静与催眠深度[6-8]。临床研究显示,BIS与作用于大脑皮质的药物如丙泊酚、咪唑安定、七氟醚之间均存在很好的相关性,可评价麻醉深度[9,10]。
BIS是衡量麻醉药镇静程度的量化指标,借助BIS监测可降低麻醉知晓率80%以上[11]。85≤BIS值≤100代表正常状态,65≤BIS值<85代表镇静状态,40≤BIS值<65代表麻醉状态,低于40可能呈现爆发抑制[12],一般认为,40≤BIS值 <65患者处于较满意麻醉状态。
本研究中应用BIS监测减少了丙泊酚、舒芬太尼和顺式阿曲库铵用量,缩短麻醉拔管及清醒时间,患者均未出现术中知晓。对于肝硬化患者应用BIS监测麻醉深度,可以科学的指导麻醉用药,实现用药个体化,减少由于肝硬化患者药物代谢延迟,造成的用药过量、苏醒困难或由于片面考虑患者肝功能的问题,减少用药量造成的术中知晓,给患者带来严重伤害。总之,麻醉中合理应用BIS监测可预防麻醉过深,提高肝硬化患者麻醉安全性,减轻患者肝脏负担。
1 杜冠华主编.实验药理学.第1版.北京:中国协和医科大学出版社,2004.280-288.
2 谭志荣,周淦,周宏灏,等.慢性肝疾病对肝CYP450酶活性的影响.中国新药杂志,2008,17:1203-1205.
3 Shibuya M,Echizen H,Kubo S,et al.Reduced urinary 6beta-hydroxycortisol to cortisol ratios in patients with liver cirhosis.Hepatol Res,2003,26:28-33.
4 陶国才,顾健腾,陈毅飞,等.麻醉药肝外代谢研究进展.第十二次长江流域暨华东六省一市麻醉学术会议论文集.2007.190-195.
5 Wrighton SA,Jones DP,Kelly SD,et al.The human drug metabolizing cytochromes P450.J Pharmacokinet Biopharm,1996,24:461-469.
6 Kissin L.Depth of anesthesia and bispectral index monitoring.Anesth Analg,2000,90:1114-1117.
7 林雪,李立环.脑电双频指数与丙泊酚麻醉.临床麻醉学杂志,2006,22:319-320.
8 刘靖,米卫东,张宏.听觉诱发电位指数、脑电双频指数及心血管反应评估“过浅麻醉”的价值.临床麻醉学杂志,2006,22:403-405.
9 褚淑娟,姚尚龙.脑电双频指数在麻醉深度监测中的研究进展.国外医学麻醉学与复苏分册,2005,26:170-173.
10 Rinaldi S,Consales G,De Gaudio AR.State entropy and bispectral in-dex:correlation withend tidal sevoflurane concentrations.Minerva Anestesiol,2007,73:39-48.
11 Myles PS,Leslie K,McNeil J,et al.Bispectral index monitoringto prevent awareness during anesthesia:the B-ware randomindeed controlled trail.Lancet,2004,363:1757-1763.
12 Struys MM,Jensen EW,Smith W,et al.Performance of the ARX-derived auditory evoked potential index as an indicator of anesthetic depth:a comparison with bispectral index and hemodynamic measures during propofol administration.Anesthesiology,2002,96:803-816.

