rd10 小鼠视网膜组织结构和功能变化
郭从容 马景学 张斌 崔月先
视网膜色素变性(RP)是一组以光感受器细胞和色素上皮细胞功能丧失为共同表现的遗传性视网膜疾病。其主要表现为夜盲和进行性视野损害,最终因光感受器细胞变性死亡而导致中心视力丧失[1]。RP是由一系列广泛的恶性基因突变所引发的病变,截至目前,已被发现的相关突变超过192种之多[2]。从基因突变到光感受器细胞变性死亡的发病机制尚不明确。目前在人类RP的某些类型中已经发现了和rd小鼠相同的基因突变位点[3]。目前rd1小鼠作为研究RP的动物模型已被广泛应用[4]。但因其发病早,进展迅速,而并非理想的动物模型。rd10小鼠生后18 d变性开始,其发病晚进展较缓慢作为研究常染色体隐性遗传性视网膜色素变性的模型明显优于rd1小鼠[5]。我们对rd10小鼠自然病程中视网膜组织结构和功能变化进行了分析,为进一步的研究提供可靠依据。
1 材料与方法
1.1 实验动物 C57BL/6(B6)和 B6.CXB1-Pde6brd10/J(rd10)小鼠均购自美国Jackson实验室。小鼠均在12 h光照(150 lux)/12 h黑暗循环下饲养。
1.2 视网膜电图(ERG)检查 B6和rd10小鼠18只,出生后17、25、32 d行ERG检查。每组6只小鼠,检查前暗适应过夜。腹腔注射氯胺酮(50 mg/kg)和甲苯噻嗪(10 mg/kg)麻醉,用含0.4%托吡卡胺和0.5%苯福林盐酸盐的滴眼液充分散瞳。参照文献[6]的方法,右眼行ERG检查。记录强度为30 cd-s/m2,3 ms闪光刺激产生的暗适应ERG波形。之后用30 cd-s/m2光明适应10 min后,记录30 cd-s/m2闪光刺激下明适应ERG波形。用SCOPE 3 Version 3.8.2软件测量暗适应ERG的a波和b波振幅及明适应ERG最大波峰值用于统计学分析。
1.3 光学相干断层成像(OCT)检查 右眼ERG检查后左眼行OCT检查。使用Heidelberg公司的SD-OCT,以视乳头为中心放射状(12线)扫描,并通过其自带的分析软件测量距视乳头中心2 000 μm的24点的全层视网膜厚度,取平均值用于统计学分析。
1.4 组织学检查 OCT检查后,断颈处死动物。立即摘出左眼球(每组6只眼球),保留1~2 mm长的视神经,固定于4℃,4%多聚甲醛磷酸缓冲液中24 h。梯度乙醇脱水,石蜡包埋,平行于角膜顶点至视盘的水平位做4 μm厚切片,行苏木精-伊红染色。测量两侧距视乳头500 μm处视网膜外颗粒层(ONL)厚度,计数两侧距视乳头500~740 μm范围内ONL中细胞核的数量。取平均值进行统计学分析。
1.5 统计学分析 应用SPSS 13.0统计软件,计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 OCT结果 用OCT检查测量小鼠活体视网膜全层厚度。B6小鼠生后17 d时视网膜全层厚度已达(256±15)μm,且日龄增长厚度无明显变化。rd10小鼠生后17 d时视网膜全层厚度达(253±15)μm,与对照组比较差异无统计学意义(P>0.05)。但生后25 d时迅速减少到(166±6)μm,并随日龄增长继续变薄,至生后32 d时,视网膜组织只有(148±4)μm厚。见图1。

图1 OCT图形及结果分析
2.2 组织学分析 组织学结果显示,B6小鼠生后17 d时ONL厚度已达(53.4±4.2)μm,且日龄增长厚度无明显变化。rd10小鼠生后17 d时 ONL厚度达(53.0±6.0)μm,与对照组比较差异无统计学意义(P>0.05)。但生后25 d迅速减少到(23.7 ±4.0)μm,并随日龄增长继续变薄,至生后 32 d 时,ONL只有(9.0±1.6)μm厚。ONL中细胞核的数量也是同样变化规律。见图2。
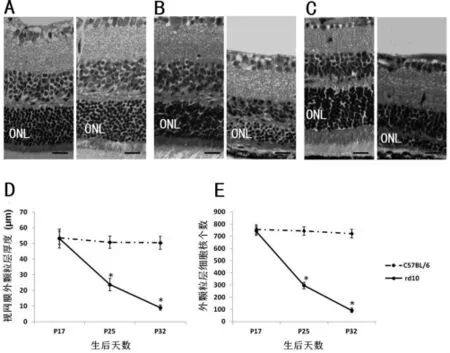
图2 组织学分析
2.3 ERG结果 无论是暗适应ERG还是明适应ERG的振幅,rd10小鼠组都明显低于对照组(P<0.05)。暗适应ERG a波,B6小鼠生后17 d时振幅已达(505±60)μV,并随日龄增加略有加大。而rd10小鼠生后17 d时振幅只有(306±30)μV,并随日龄增长振幅进一步降低。暗适应ERG b波,B6小鼠生后17 d时振幅已达(798±68)μV,并随日龄增加略有加大。而rd10小鼠生后17 d时振幅只有(422±48)μV,并随日龄增长振幅进一步降低。至日龄32 d时暗适应ERG几乎接近于直线。明适应ERG最大波峰值,B6小鼠生后17 d时振幅已达(128±16)μV,并随日龄增加略有加大。而rd10小鼠生后17 d时振幅为(110±12)μV,并随日龄增长振幅进一步降低,生后25 d为(70±9)μV,生后32 d为(40±8)μV。见图3。
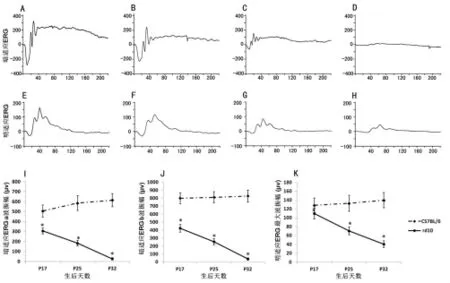
图3 ERG图形及结果分析
3 讨论
OCT检查是一种新的影像学检查方法,具有非创伤性、非接触性的优点,并可进行微米级的定量分析,现已广泛应用于临床。OCT检查是一种活体检查,可动态观察病变的变化,特别是某种治疗方法疗效的长期观察,可大大减少实验动物的使用量。
RP是遗传性视觉损害和盲目的常见原因之一,世界各国的发病率为1/5 000~1/3 000,据估计全世界约150万人患此疾病[7]。基于基因水平的药物治疗以及基因替代疗法已被广泛研究。但随着研究的深入,越来越多的相关突变基因被发现,这一事实要求对其的治疗进行更多的改进。然而这些改进都需要在动物模型上进行测试。测试效果取决于所采用的模型,而这些模型发生病变的速度要么太快,要么又太慢。以被广泛应用的rd1小鼠模型为例,早在生后5~14 d,就产生了PDE6b基因突变的导致的严重后果,以至于视网膜在完全成熟之前,就已经损失了多层光感受器细胞[8]。rd10小鼠生后17 d无论是视网膜全层厚度还是ONL厚度都达到正常对照小鼠的厚度。虽然视网膜功能方面未能达到正常水平,我们最近的研究显示完全黑暗环境下饲养rd10小鼠,可以使视网膜变性开始的时间延后和变性速度延缓。rd10小鼠的这种特性使得其更能模拟RP的发病过程。
我们的研究数据显示,作为RP的动物模型rd10小鼠明显优于rd1小鼠。特别是在早期治疗的测试中rd10小鼠模型有更大的应用价值。
1 Hartong DT,Berson EL,Dryja TP.Retinitis pigmentosa.Lancet,2006,368:1795-1809.
2 程亚颖,赵秀勉,宫丽芬.不同浓度大鼠吸氧对新生大鼠视网膜影响的研究.河北医药,2011,33:3698-3700.
3 Bowes C,Li T,Danciger M,et al.Retinal degeneration in the rd mouse is caused by a defect in the beta subunit of rod cGMP-phosphodiesterase.Nature,1990,347:677-680.
4 Punzo C,Cepko C.Cellular responses to photoreceptor death in the rd1 mouse model of retinal degeneration.Invest Ophthalmol Vis Sci,2007,48:849-857.
5 Chang B,Hawes NL,Pardue MT,et al.Two mouse retinal degenerations caused by missense mutations in the beta-subunit of rod cGMP phosphodiesterase gene.Vision Res,2007,47:624-633.
6 Takahashi M,Miyoshi H,Verma IM,et al.Rescue from photoreceptor degeneration in the rd mouse by human immunodeficiency virus vector-mediated gene transfer.J Virol,1999,73:7812-7816.
7 Yao J,Jia L,Khan N,Zheng QD,et al.Caspase inhibition with XIAP as an adjunct to AAV vector gene-replacement therapy:improving efficacy and prolonging the treatment window.PLoS One,2012,7:e37197.
8 Souied EH,Reid SN,Piri NI,et al.Non-invasive gene transfer by iontophoresis for therapy of an inherited retinal degeneration.Exp Eye Res,2008,87:168-175.

