新型香豆素N-取代-1,3,4-噻二唑基酰胺类化合物的合成及其光学性能 *
王彩霞,徐翠莲,樊素芳,杨国玉,胡亚平
(河南农业大学理学院化学系,河南郑州 450002)
香豆素类衍生物多数具有抗菌、抗凝结、抗HIV、抗癌和抗肿瘤活性[1~6]。因其含有生色团苯环和内酯结构,故这类化合物具有较强的荧光性能,是很好的荧光增白剂、激光染料、荧光探针及非线性光学材料[7~10],广泛应用于医药、食品、染料、光学材料及生物医学等领域。
本文以具有光学活性的8-甲氧基香豆素-3-甲酰氯(1)为先导化合物,与同样具有光学活性的5-氨基-2-取代-1,3,4-噻二唑类化合物(2a ~2i)[11]反应合成了9个新型的香豆素N-取代-1,3,4-噻二唑基酰胺类化合物(3a ~3i,Scheme 1),其结构经1H NMR,IR和HR-MS表征。并用UVVis和FL研究了3的光学性能,以期得到高荧光强度的化合物。
1 实验部分
1.1 仪器与试剂
X-4型数字显示显微熔点仪(温度未校正);CARY 300型紫外分光光度计(UV-Vis);CARYE clipse型荧光分光光度计(FL,激发和发射光狭缝宽度5 nm,波长300 nm~800 nm);BRUCKER 300M型核磁共振仪(DMSO为溶剂,TMS为内标);TENSOR 27型傅立叶红外光谱仪(KBr压片)。
1[12]和 2a ~ 2i[13]参考文献方法合成;其余所用试剂均为分析纯,其中三乙胺(99.0%)和二氯甲烷分别用KOH和P2O5干燥后重蒸使用。

Scheme 1
1.2 合成
在三颈烧瓶中依次加入1 0.95 g(4 mmol),2a~2i 4 mmol,二氯甲烷 35 mL 及三乙胺 3.5 mL,搅拌下于室温反应13 h。旋蒸除溶,残余物加少量水浸泡,静置30 min。抽滤,滤液用3%盐酸洗涤2次~3次,抽滤。合并两次滤饼,干燥得粗品,用混合溶剂[V(DMF)∶V(无水乙醇)=2 ∶1]重结晶得3a~3i。
3a:黄色粉末,产率42.3%,m.p.>260 ℃;1H NMR δ:3.73(s,3H,OCH3),6.62 ~ 6.91(m,3H,ArH),8.0(s,1H,NH),8.37(s,1H,=CH),9.5(s,1H,ArH);FT-IR ν:3 436,3 072,2 301,1 707,1 605,1 535,1 475,1 108,789 cm-1;HR-MSm/z:Calcd for[(C13H9N3O4S+Na)+]326.021 1,found 326.020 5。
3b:黄色粉末,产率35.6%,m.p.285℃ ~287 ℃;1H NMR δ:3.73(s,3H,OCH3),6.62 ~6.91(m,3H,ArH),8.0(s,1H,NH),8.37(s,1H,=CH),2.35(s,1H,CH3);IR ν:3 452,3 069,2 980,2 362,1 709,1 615,1 535,1 478,1 281,787 cm-1;HR-MSm/z:Calcd for [(C14H11N3O4S+Na)+]340.036 8,found 340.036 2。
3c:黄色粉末,产率 33.5%,m.p.249.5℃ ~251.2 ℃;1H NMR δ:3.73(s,3H,OCH3),6.62 ~6.91(m,3H,ArH),8.0(s,1H,NH),8.37(s,1H,=CH),2.59(s,2H,CH2),1.24(s,3H,CH3);IR ν:3 430,3 065,2 982,2 360,1 759,1 620,1 550,1 280,790 cm-1;HR-MSm/z:Calcd for [(C15H13N3O4S+Na+]354.052 4,found 354.052 0。
3d:黄色粉末,产率 41.56%,m.p.258.0℃ ~260.8 ℃;1H NMR δ:3.73(s,3H,OCH3),6.62 ~6.91(m,3H,ArH),8.0(s,1H,NH),8.37(s,1H,=CH),2.55(s,2H,CH2),1.66(s,2H,CH2),0.96(s,3H,CH3);IR ν:3 432,3 070,2 983,1 712,1 613,1 470,1 200,1 050,780 cm-1;HR-MSm/z:Calcd for [(C16H15N3O4S+Na)+]368.068 1,found 368.067 5。
3e:黄色粉末,产率 40.65%,m.p.268.2℃ ~270.8 ℃;1H NMR δ:3.73(s,3H,OCH3),6.62 ~6.91(m,3H,ArH),8.0(s,1H,NH),8.37(s,1H,=CH),2.55(s,2H,CH2),1.62(s,2H,CH2),1.33(s,2H,CH2),0.96(s,3H,CH3);IR ν:3 436,3 085,2 979,1 755,1 604,1 528,1 277,786 cm-1;HR-MSm/z:Calcd for [(C17H17N3O4S+Na)+]382.083 7,found 382.083 0。
3f:棕色粉末,产率 40.26%,m.p.260.5℃ ~262.1 ℃;1H NMR δ:3.73(s,3H,OCH3),6.62 ~6.91(m,3H,ArH),8.0(s,1H,NH),8.37(s,1H,=CH),4.64(s,2H,CH2Cl);IR ν:3 480,3 070,2 988,1 750,1 708,1 624,1 560,1 416,1 217,839,799 cm-1;HR-MSm/z:Calcd for [(C14H10N3O4SCl+Na)+]373.997 8,found 373.997 2。
3g:棕色粉末,产率 42.0%,m.p.265.6℃ ~266.3 ℃;1H NMR δ:3.73(s,3H,OCH3),6.62 ~6.91(m,3H,ArH),8.0(s,1H,NH),8.37(s,1H,=CH),6.744(s,1H,CHCl2);IR ν:3 420,3 070,2 990,1 725,1 700,1 610,1 410,1 142,1 024,806 cm-1;HR-MSm/z:Calcd for[(C14H10N3O4SCl2+Na)+]408.966 7,found 408.966 2。
3h:棕色粉末,产率37.2%,m.p.>345 ℃;1H NMR δ:3.73(s,3H,OCH3),6.62 ~ 6.91(m,3H,ArH),8.0(s,1H,NH),8.37(s,1H,=CH);IR ν:3 432,3 065,2 945,1 756,1 708,1 625,1 210,1 104,796 cm-1;HR-MSm/z:Calcd for[(C14H8N3O4SCl3+Na)+]441.919 9,found 441.919 6。
3i:黄色粉末,产率36.7%,m.p.>345℃;1H NMR δ:3.73(s,3H,OCH3),6.62 ~ 6.91(m,3H,ArH),8.0(s,1H,NH),8.37(s,1H,=CH);IR ν:3 479,3 035,2 980,1 750,1 604,1 478,1 275,1 103,785 cm-1;HR-MSm/z:Calcd for [(C14H8N3O4SF3+Na)+]394.008 5,found 394.008 1。
2 结果与讨论
2.1 光学性能
(1)UV-Vis
1,2c和3c的UV-Vis谱图见图1。从图1可见,1的骨架π→π*跃迁所对应的λmax位于265 nm,330 nm。2c(λmax=263 nm)生成 3c后,其265 nm吸收峰位基本不变,而另一吸收峰则由330 nm红移至340 nm~370 nm,变成一宽吸收带,摩尔吸收系数 ε 由 0.92 ×104L·mol-1·cm-1变为 1.58 ×104L·mol-1·cm-1,吸收强度增强。其余3的UV-Vis数据见表1。由表1可见,1与2反应生成3后,大于300 nm的λ2max均发生了红移,ε2max明显增大。从表1还可见,3a~3i吸收峰位置及吸收强度随噻二唑环上取代基不同变化情况不太明显。

图1 化合物的UV-Vis谱图*Figure 1 UV-Vis spectra of compounds*溶剂 DMF,c 5.0 ×10-5mol·L-1

表1 化合物的UV-Vis数据*Table 1 UV-Vis data of compounds
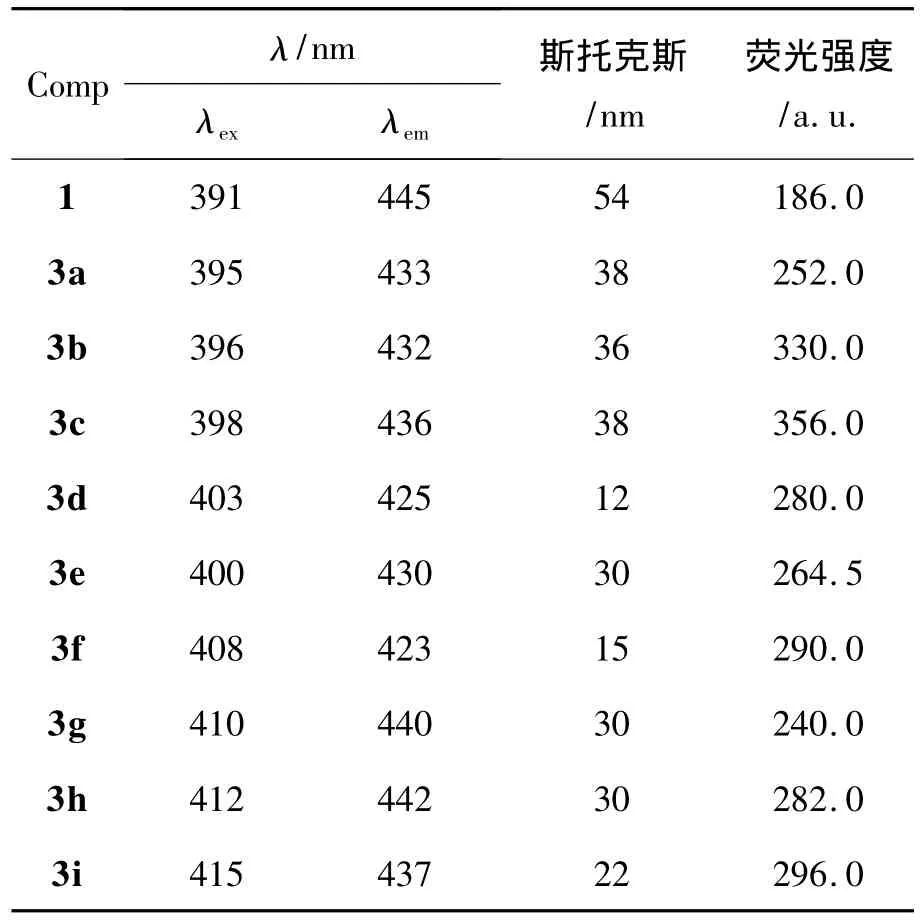
表2 化合物的FL数据*Table 2 FL data of compounds
(2)FL
1和3c的FL谱图见图2,其余化合物的FL数据见表2。从表2可以看出,3和1的激发(λex)和发射(λem)光谱数据均发生了斯托克斯位移[14],说明在激发和发射之间存在着一定的能量损失。主要原因是激发态分子在发射荧光之前,很快经历了振动松弛或(和)内转化过程而损失部分激发能,致使发射相对于激发有一定的能量损失。另外辐射跃迁可能只使激发态分子衰变到基态的不同振动能级,然后通过振动松驰进一步损失振动能量[14]。1的斯托克斯位移为54 nm,3c的斯托克斯位移为38 nm,两者相差16 nm。原因是3c的共轭体系比后者大,其激发波长比1的红移约7 nm。另外发射光谱3c的比1的蓝移了约9 nm(表2),说明3c的激发态分子和1的相比在发射荧光之前能量损失较少。而不同化合物的斯托克斯位移和1相比都变小了,但变化规律性不强。生成3后,荧光强度均比1的强度大,其中3c的荧光强度最大。

图2 1和3c的FL谱图*Figure 2 FL spectra of 1 and 3c*同图1
综上所述,3a~3i均表现出比1更强的荧光性能,其中3b和3c的荧光强度较强,可进一步考虑其在荧光方面的应用。
3a~3i的生物活性研究正在进行中,以开发其在生物学方面的应用。
[1]Andrea Behrenswerth,Nicole Volz,Jakob Torang,et al.Synthesis and pharmacological evalution of coumarin derivatives as cannabinoid receptor antagonists and inverse agonists[J].Bioorganic and Med Chem,2009,17:2842-2851.
[2]Suresh Khode,Veeresh Maddi,Prashant Aragade,et al.Synthesis and pharmacological evalution of a novel series of 5-(substituted)aryl-3-(3-coumarinyl)-1-phenyl-2-pyrazolines as novel anti-inflammatory and analgestic agents[J].European Journal of Med Chem,2009,44:1682 -1688.
[3]Su-nam Kim,Nam Hyun Kim,Yeon Sook Park,et
al.7-Diethylamino-3-(2'-benzoxazoly)coumarin is a novel microtubule inhibitor with antimitotic activity in multidrug resistant cancer cells[J].Biochemical Pharmacology,2009,77:1773 -1779.
[4]Georgia Melagraki,Antreas Afantitis,Olga Igglessi-Markopoulou,et al.Synthesis and evaluation of the antioxidant and anti-inflammatory activity of novel coumarin-3-aminoamides and their alpha-lipoic acid adducts[J].European Journal of Med Chem,2009,44:3020 -3026.
[5]S Stanchev,V Hadjimitova,T Traykov,et al.Investigation of the antioxidant properties of some new 4-hydroxycoumarin derivatives[J].European Journal of Med Chem,2009,44:3077 -3082.
[6]Yukiko Tada,Yasuhiro Shikishima,Yoshihisa Takaishi,et al.Coumarins and γ-pyrone derivatives from prangos pabularia:Antibacterial activity and inhibition of cytokine release[J].Phytochemistry,2002,59:649 -654.
[7]Ashis K S,Manoj K,Dilip K M,et al.Photophysical investigations of the solvent polarity effect on the properties of coumarin dye[J].ChemPhys Lett,2005,40:7114-7118.
[8]So-Yeon Park,Masahiro Ebihara,Yasuhiro Kubota,et al.The relationship beween solid-state fluorescence intensity and molecular packing of coumarin dyes[J].Dyes and Pigments,2009,82:258 -267.
[9]Zhang D,Zhang S,Ma D,et al.Low threshold amplified spontaneous emission based on coumarin 151 encapsulated in mesoporous SBA-15[J].Appl Phys Lett,2006,89:2311 -2312.
[10]Jessie A Key,Sherni Koh,Qadir K Timerghazin,et al.Photophysical characterization of triazole-substituted coumarin fluorophores[J].Dyes and Pigments,2009,82:196 -203.
[11]李会学,唐惠安,扬声,等.电子传输材料噻二唑衍生物的密度泛函研究[J].化学学报,2007,65(20):2229-2234.
[12]王彩霞,徐翠莲,杨国玉,等.含苯并噻唑基香豆素酰胺类化合物的合成及其光谱研究[J].化学通报,2010,73(11):1018 -1022.
[13]陈小保,石德清.新型N-(5-烷基-1,3,4-噻二唑-2-基)-1-[(杂芳基)甲基]-5-甲基-1H-1,2,3-三唑基-4-甲酰胺的合成与生物活性[J].有机化学,2009,29(7):1096-1099.
[14]许金钩,王尊本.荧光分析法(第3版)[M].北京:科学出版社,2006.

