新型三氮唑席夫碱吡唑衍生物的合成*
郑玉国,郭晴晴,唐文杰,周 莉,魏全鲜,宋泽斌
(兴义民族师范学院绿色化学合成技术研究所民族药用生物资源研究与开发实验室,贵州兴义 562400)
三氮唑衍生物具有广泛的生物活性,在农药和医药领域具有良好的应用前景[1,2]。目前已研制出抑菌剂三唑酮、烯唑醇、亚胺唑等,除草剂氨唑草酮、唑啶草酮等,杀虫剂三唑磷、唑蚜威等数十个高效低毒的三氮唑农药品种。席夫碱化合物具有抗菌、抗癌、杀虫、抗病毒及除草等多种生物活性[2,3]。以吡唑环为母体结构修饰在药物研发中具有广泛的应用[5~8],目前已有杀菌剂呋吡菌胺和吡噻菌胺、杀虫剂敌蝇威、锐劲特和吡虫酰胺等药物商品化。
本文根据活性基团拼接原理,将吡唑基团和1,2,4-三唑基团同时引入到希夫碱类化合物中,设计并合成7个新型的三氮唑席夫碱吡唑衍生物(4a~4g,Scheme 1),收率 74% ~87%,其结构经1H NMR,IR和元素分析表征。并对合成4a的反应条件进行了优化。
1 实验部分
1.1 仪器与试剂
X-5型熔点仪(温度未校正);JEOL-ECX 400 NMR型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Prestige-21型红外光谱仪(KBr压片);Elementar Vario-Ⅲ型元素分析仪。
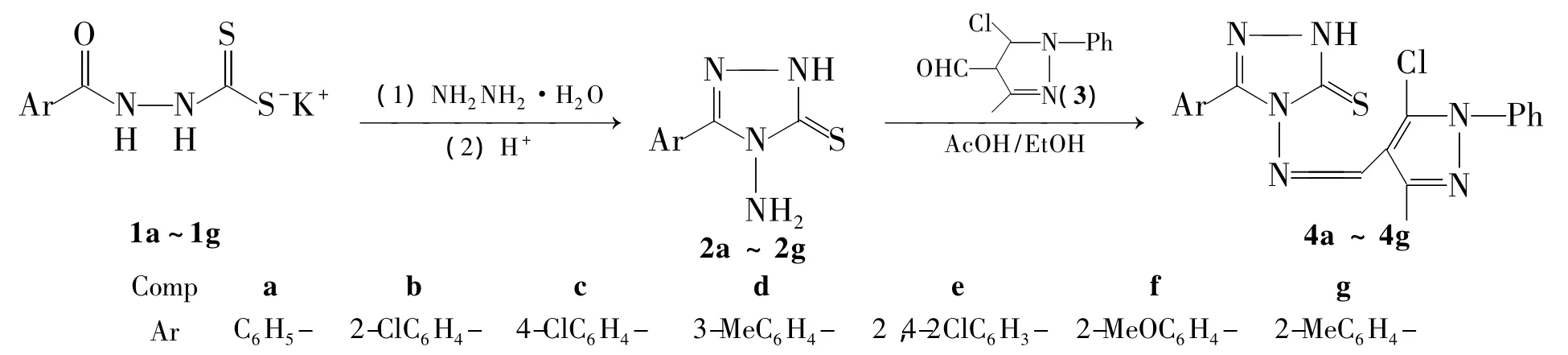
Scheme 1
1a ~1g[6]和 3[9]按文献方法制备;其余所用试剂均为分析纯。
1.2 合成
(1)4-氨基-5-(1-取代苯基)-1,2,4-三唑-3-硫酮的合成(以2a为例)
在反应瓶中加入1a 10 mmol,乙醇20 mL和80%水合肼0.6 g(12 mmol),搅拌下回流反应7 h。冷却至室温,过滤,滤液用水(100 mL)稀释,浓盐酸中和至中性,析出固体,过滤,滤饼用水洗涤,干燥后用无水乙醇重结晶得白色晶体4-氨基-5-苯基-1,2,4-三唑-3-硫酮(2a),收率76%,m.p.185 ℃ ~188 ℃;1H NMR δ:13.92(s,1H,NH),8.01 ~8.03(m,2H,PhH),7.51 ~7.54(m,3H,PhH),5.79(s,2H,NH2)。
用类似的方法合成2b~2g,其表征数据[10]与Scheme 1预期结构吻合。
(2)4-(1-苯基-3-甲基-5-氯吡唑次甲亚胺)-5-取代苯基-4H-1,2,4-三唑-3-硫酮的合成(以4a为例)
在反应瓶中加入2a 10 mmol和3 2.23 g(12 mmol)的无水乙醇(30 mL)溶液,搅拌下加入5滴冰醋酸,于65℃反应4 h(TLC检测)。冷却至室温,抽滤,滤饼用无水乙醇(或无水乙醇/DMF)重结晶得4-(1-苯基-3-甲基-5-氯吡唑次甲亚胺)-5-苯基-4H-1,2,4-三唑-3-硫酮(4a)。
用类似的方法合成4b~4g。
2 结果与讨论
2.1 表征
4的实验结果和元素分析数据见表1,1H NMR和IR数据见表2。从表2可见,2a转变为4a后,NH2质子消失,在低场出现亚胺(-N=CH-)质子峰9.78,在高场出现 CH3质子峰2.40,说明发生了反应。苯环上质子峰的化学位移值在7.54 ~7.92,14.22 处的单峰归属 NH 质子峰。

表1 4的实验结果和元素分析数据Table 1 Experimental results and elemental analysis data of 4
以4a为例进行IR分析:3 114 cm-1为N-H吸收峰,3 033 cm-1~2 990 cm-1为Ar-H 的伸缩振动吸收峰,2 962 cm-1和2 935 cm-1为甲基不对称吸收振动吸收峰,1 385 cm-1为CH3的对称变形振动吸收峰,1 608 cm-1为希夫碱C=N特征振动吸收峰,表明希夫碱化合物的生成。在1 545 cm-1~1 448 cm-1有芳环的C=C骨架振动吸收峰,同时,在1 354 cm-1出现C=S键的伸缩振动峰。

表2 4的1H NMR和IR数据Table 2 1H NMR and IR data of 4
2.2 合成
在4的合成中,冰乙酸的加入提高了化合物的溶解性,同时提供了适宜的酸度,使羰基碳电正性更强,更易发生亲核加成反应,使4容易合成。同时3应过量,使溶解性差的2反应完全,便于后处理操作。
2.3 合成4的条件优化
以合成4a为模板,考察溶剂、催化剂、投料比r[n(2a)∶n(3)]、反应时间和反应温度等诸因素对4a收率的影响,筛选最优实验条件。
(1)溶剂
2a 10 mmol,r=1.0,于 25 ℃反应 5 h,其余反应条件同1.2(2),考察溶剂对4a收率的影响,结果见表3。从表3可见,以THF或乙醇为溶剂时收率最高(18%)。较佳的溶剂为THF或乙醇。
(2)催化剂
以乙醇为溶剂,其余反应条件同2.3(1),考察催化剂对4a收率的影响,结果见表4。表4结果表明,以AcOH为催化剂时,收率较高(46%)。较佳的催化剂为AcOH。
(3)温度
以乙醇为溶剂,AcOH为催化剂,其余反应条件同2.3(1),考察温度对4a收率的影响,结果见表5。由表5可见,反应受温度影响较大;在较低温度(15℃)下反应,收率较低;随着温度的升高,收率不断增大;当温度为65℃时,收率达最大(62%);再提高反应温度,收率变化不明显。较佳反应温度为65℃。
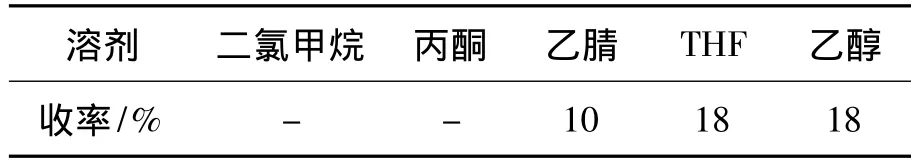
表3 溶剂对4a收率的影响*Table 3 Effect of solvent on yield of 4a

表4 催化剂对4a收率的影响*Table 4 Effect of catalyst on yield of 4a
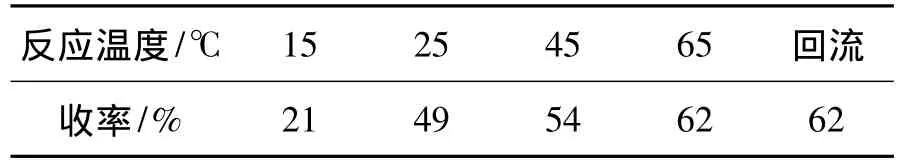
表5 反应温度对4a收率的影响*Table 5 Effect of reaction temperature on yield of 4a
(4)时间
以乙醇为溶剂,AcOH为催化剂,于65℃反应,其余反应条件同2.3(1),考察时间对4a收率的影响,结果见表6。从表6可见,随着时间的增加,收率逐渐提高。当反应时间为4 h时,从TLC看2a已经全部消失,收率达78%;再提高反应时间,收率提高的幅度不大。较佳反应时间为4 h。
(5)r
以乙醇为溶剂,AcOH为催化剂,于65℃反应4 h,其余反应条件同2.3(1),考察r对4a收率的影响,结果见表7。由表7可见,随着r的增大,收率逐渐提高;当r=1.0时,从TLC看有部分2a未反应,后处理操作中需要进行过柱分离。当r=1.2时,2a全部反应,且未反应的3在重结晶过程中溶于母液中,后处理简单;再提高r,收率反而降低。较佳的r=1.2。

表7 r对4a收率的影响*Table 7 Effect of r on yield of 4a
综上所述,合成4a的最佳反应条件为:以乙醇为溶剂,乙酸为催化剂,2a 10 mmol,r=1.2,于65℃反应4 h,收率78%。
[1]魏学,郑玉国,薛伟,等.新型 1,2,4-三唑并[3,4-b]-1,3,4-噻二唑类衍生物合成及抗病毒活性[J].合成化学,2010,18(5):595 -598.
[2]李黔柱,宋宝安,蔡学健,等.N-(1,2,4-三唑)含氟肉桂醛亚胺的合成及生物活性[J].有机化学,2010,30(4):569 -575.
[3]郑玉国,薛伟,郭晴晴,等.三唑席夫碱苯并吡喃酮衍生物合成及其抗病毒活性[J].合成化学,2012,20(3):316-319.
[4]于赛男,李智超,胡英芝,等.含三氟甲基和双希夫碱化合物的合成与表征[J].合成化学,2010,18(2):226-228.
[5]杨金凤,陶晶,李炳奇,等.芳基吡唑腙及其双杂环化合物的合成与抗菌活性[J].合成化学,2009,17(2):151-154.
[6]刘新华,白林山,王世范,等.5-(2-羟基苯基)-3-甲基吡唑酰胺衍生物的合成与杀菌活性[J].合成化学,2006,14(2):147 -149.
[7]闫启东,徐俊,徐峰,等.1-[6-(3,5-二甲基-1H-吡唑-1-基)-1,2,4,5-四嗪-3-基]酰肼及其衍生物的合成与表征[J].合成化学,2011,19(6):709 -713.
[8]廖国辉,张阳,魏宁宁,等.1-甲基-3-二氟甲基-4-吡唑酰胺类衍生物的合成及其抑菌活性[J].合成化学,2011,19(1):19 -23.
[9]杨丽敏,华水波,刘钊杰.含氯羧酸吡唑醛肟酯化合物的合成及生物活性[J].应用化学,2005,22(8):829-834.
[10]2b:白色粉末,收率 68,m.p.161 ℃ ~163 ℃;1H NMR δ:13.95(s,1H,NH),7.48 ~ 7.66(m,4H,PhH),5.52(s,2H,NH2).2c:白色晶体,收率 86%,m.p.191 ℃ ~192 ℃;1H NMR δ:14.00(s,1H,NH),8.05 ~ 8.07(m,2H,PhH),7.62 ~7.59(m,2H,PhH),5.80(s,2H,NH2).2d:白色片状晶体,收率78%,m.p.140℃ ~143℃;1H NMR δ:13.94(s,1H,NH),7.89 ~7.51(m,4H,PhH),5.59(s,2H,NH2).2e:白色粉末,收率79%,m.p.196 ℃ ~198 ℃;1H NMR δ:14.03(s,1H,NH),7.86(s,1H,PhH),7.61 ~7.68(m,2H,PhH),5.53(s,2H,NH2).2f:白色晶体,收率 76%,m.p.197℃ ~199℃;1H NMR δ:13.97(s,1H,NH),7.56 ~ 7.05(m,4H,PhH),5.43(s,2H,NH2),3.81(s,3H,OCH3).2g:白色晶体,收率81%,m.p.165 ℃ ~167 ℃;1H NMR δ:13.88(s,1H,NH),7.32 ~7.50(m,4H,PhH),5.56(s,2H,NH2),2.27(s,3H,CH3).

