光度法测定小麦粉中过氧化苯甲酰研究
田林双 于 伟 吴存兵 顾鹏程 周琳琨 邱 琳
(江苏财经职业技术学院1,淮安 223003)
(江苏省淮安市科技局2,淮安 223001)
过氧化苯甲酰(简称BPO)曾作为小麦粉的改良剂和增白剂[1],在我国批准使用多年。鉴于BPO对小麦粉营养和人体健康产生的危害[2],2011年2月,卫生部等七部门联合发文,禁止在小麦粉生产中添加BPO,但仍有小麦粉生产者或经营者为了追求小麦粉白度,达到以次充好目的,在小麦粉中违法添加BPO。
小麦粉中BPO含量的检测,主要有氧化还原滴定法[3-4]、可见分光光度法[5-7]、荧光分光光度法[2]、气相色谱法[8-9]、高效液相色谱法[10-12]、化学发光法[13-14]和生物传感器法[15]。上述检测方法各有特点,亦存在部分不足。氧化还原滴定法只适用于高含量组分测定;荧光分光光度法、气相色谱法、高效液相色谱法和化学发光法分析时间长,需要价格昂贵的分析仪器,不便于现场检测;生物传感器法中所需要的生物传感器制作过程复杂;可见分光光度法仪器价格低、测定结果准确、分析速度快、适用于现场检测。目前发表的BPO可见分光光度法基于的检测原理,主要有碘 -淀粉光度法[5-6]和铁(Ⅱ)-邻菲啰啉褪色光度法[7]。碘-淀粉光度法中,BPO的提取溶剂乙醇会影响碘-淀粉的显色,降低了方法的灵敏度[6]。铁(Ⅱ)-邻菲啰啉褪色光度法的线性较差(R2<0.94),线性范围小[7]。本研究基于BPO的氧化性,将 Fe2+氧化成 Fe3+,生成的 Fe3+与硫氰酸盐在酸性乙醇介质中发生显色,建立一种BPO检测新方法,以期实现BPO的快速、准确、经济和现场检测,进而有效控制BPO在小麦粉中的违法添加。
1 材料与方法
1.1 S材料与试剂
小麦粉样品(市售):江苏淮安。
无水乙醇、BPO、KSCN、(NH4)2Fe(SO4)2·6H2O、(NH4)Fe(SO4)2·12H2O、HCl(分析纯):国药集团化学试剂有限公司。
1.2 仪器
UV5100分光光度计:天津港东科技发展股份有限公司;HH-8恒温水浴锅:常州国华电器有限公司。
1.3 试验方法
1.3.1 光谱吸收曲线
取4支比色管,试验组1和试验组2加入BPO乙醇溶液,使BPO在比色管中的终浓度分别为5 mg/L和10 mg/L。试验组3和试验组4加入(NH4)Fe(SO4)2·12H2O标准溶液,使 Fe3+终浓度分别为3 mg/L和 6 mg/L。各 试 验 组 均 加 入 (NH4)2Fe(SO4)2·6H2O、KSCN和稀盐酸标准溶液,使 Fe2+、KSCN和HCl在各比色管中的终质量浓度分别为10mg/L、3 g/L和 1 mmol/L。控制反应介质中含乙醇96%。Fe2+质量浓度为10 mg/L、KSCN质量浓度为3 g/L、HCl浓度为 1 mmol/L的乙醇溶液为参比溶液。各比色管置于60℃水浴环境下反应10 min,取出,450~550 nm之间进行光谱扫描。
1.3.2 反应介质对光谱吸收曲线的影响
在试验组和对照组比色管中分别加入适量(NH4)2Fe(SO4)2·12H2O溶液、KSCN溶液和 HCl溶液,使各比色管中 Fe2+终质量浓度为10 mg/L,KSCN终质量浓度为 3 g/L,HCl终浓度为 1 mmol/L。在试验组比色管中加入BPO乙醇溶液,使BPO终质量浓度为4 mg/L。对照组比色管不加入BPO乙醇溶液。设定试验组和对照组比色管乙醇终体积分数分别为 60%、70%、80%、90%、92%、94%、96%、98%。将各比色管置于60℃水浴环境下反应10 min,取出,分别用对应对照组溶液调零,450~550 nm之间进行光谱扫描。
1.3.3 酸含量对显色反应影响
配置BPO标准乙醇溶液,质量浓度为10 mg/L。配置KSCN标准水溶液,质量浓度为300 g/L。配置不同浓度(NH4)2Fe(SO4)2·12H2O和 HCl混合水溶液,Fe2+质量浓度固定为 1 000 mg/L,HCl浓度分别为 0、1、5、10、20、50、100、200、500、1 000、2 000 mmol/L。取5 mL比色管,加入BPO标准乙醇溶液2 mL,KSCN标准水溶液 50μL,不同浓度(NH4)2Fe(SO4)2·12H2O和HCl混合水溶液50μL,无水乙醇定容至5 mL。最终,各试验组比色管中,BPO、Fe2+、KSCN终质量浓度分别为4 mg/L,10 mg/L和3 g/L,乙醇体积分数为98%,HCl终浓度分别为0、0.01、0.05、0.1、0.2、0.5、1、2、5、10、20 mmol/L。将各比色管置于60℃水浴环境下反应10 min,取出,分别用对应对照组溶液调零,505 nm下测定吸光度。
1.3.4显色反应温度对显色反应影响
各比色管中,HCl终浓度为 2 mmol/L,BPO、Fe2+、KSCN终质量浓度分别为4 mg/L,10 mg/L和3 g/L,乙醇体积分数为 98%,溶液配制方法参照1.3.3。将比色管分别置于 20、30、40、50、60、70、80、90、100℃水浴环境下反应10 min,取出,按照1.3.3方法测定吸光度。
1.3.5 显色反应时间对显色反应影响
比色管中各组分浓度同1.3.4,将各比色管置于50℃水浴环境下,分别反应 0、2、5、10、15、20、30、60 min。取出,按照1.3.3方法测定吸光度。
1.3.6 反应介质中Fe2+浓度对显色反应影响
各比色管中,Fe2+终质量浓度分别为 0、1、2、4、6、10、15、20、30、50 mg/L。其余组分浓度同 1.3.4。将比色管置于50℃水浴环境下反应15 min,取出,按照1.3.3方法测定吸光度。
1.3.7 反应介质中KSCN质量浓度对显色反应影响
各比色管中,Fe2+质量终浓度为 15 mg/L,KSCN终质量浓度分别为 0、0.05、0.1、0.25、0.5、1、1.5、3、6、10 g/L。其余组分浓度同1.3.4,按照1.3.3方法测定吸光度。
1.3.8 标准曲线
分别配置 0.1、0.25、0.5、1、2、4、6、8、10、15 mg/L的BPO无水乙醇标准溶液,按照最佳试验条件,用空白试剂做参比,测定各溶液吸光度,绘制标准曲线。
1.3.9 小麦粉中BPO的提取
定量称取0.1~1.0 g小麦粉于表面皿中,干燥器常温干燥12 h后,倒入25 mL离心管中,加入无水乙醇10 mL,超声提取5 min,离心,获得上清液5 mL,按照最佳试验条件,测定BPO含量。
1.3.10 共存物质干扰
向反应体系中,分别加入 Na+、K+、Sr2+、Ag+、Mg2+、NH4+、Ba2+、Cl-、NO3-、Mo(V)和 W(V)标准溶液,控制反应体系中,乙醇体积分数98%,BPO、HCl、Fe2+、KSCN浓度分别为 2 mg/L、2 mmol/L、15 mg/L和3 g/L。按照1.3.8方法,测定BPO含量。
1.3.11 样品分析
取6份市售小麦粉样品,按照1.3.9方法,提取小麦粉中BPO,按照最佳试验条件,进行样品分析及回收率试验。
1.4 数据处理
采用EXCEL 2003及SPSS 13.0对试验数据进行处理。
2 结果与分析
2.1 光谱吸收曲线
光谱吸收试验结果(图1)表明,4个试验组光谱吸收曲线走向相似,说明存在于试验组1和试验组2中的 BPO,的确能够氧化 Fe2+成 Fe3+,Fe3+再与KSCN发生显色反应。试验组1与试验组2较,BPO质量浓度为10 mg/L的试验组2吸光度大于BPO质量浓度为5 mg/L的试验组1吸光度,提示若建立吸光度与BPO浓度的定量关系,则可以通过检测显色反应产物的方法间接测定BPO。
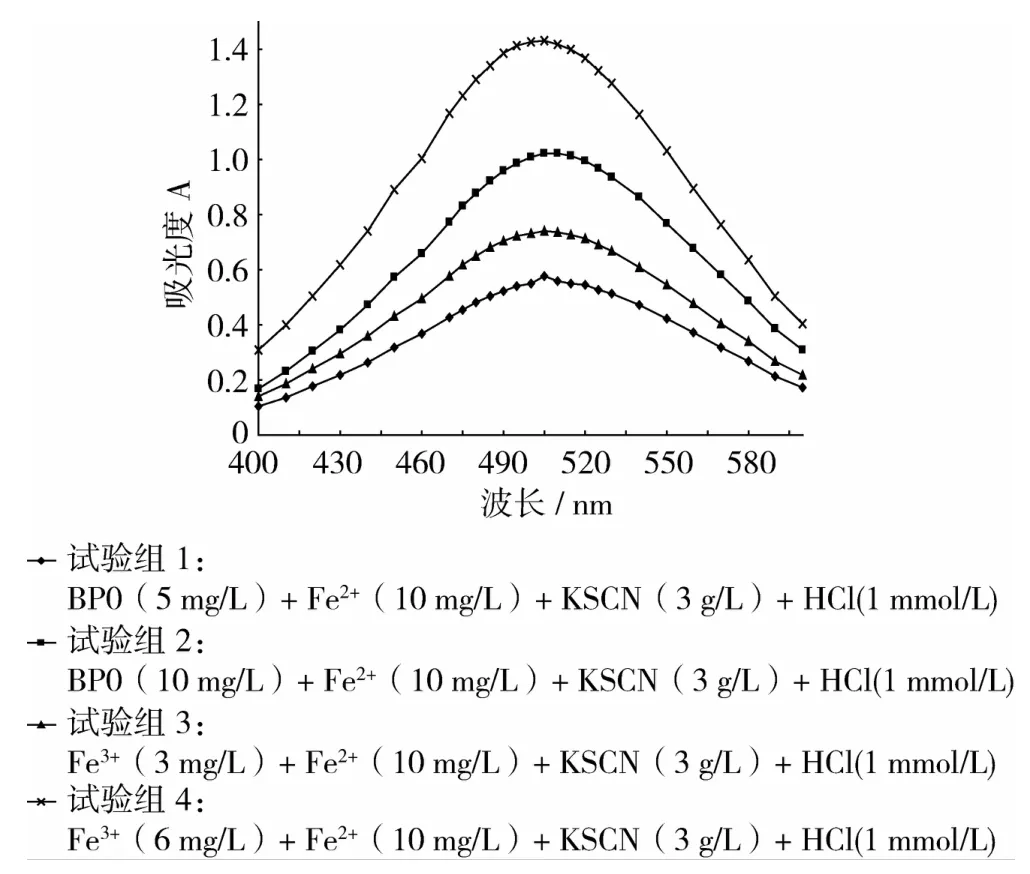
图1 400~600 nm之间各试验组光谱吸收曲线
2.2 反应介质对光谱吸收曲线影响
本研究预试验结果表明,反应介质中,乙醇的含量影响有色配合物的显色行为,有必要设计试验,研究不同乙醇含量对显色反应的影响。试验结果(图2)表明,反应介质中乙醇含量极大的影响配合物的显色,乙醇含量越高,实验组比色管内溶液颜色越深,吸光度越大。张东等[6]在研究碘-淀粉光度法测定BPO时,同样发现乙醇含量影响碘-淀粉配合物的显色,所不同的是碘-淀粉光度法,高含量的乙醇降低BPO检测的灵敏度。而本研究中,高含量的乙醇提高了BPO检测的灵敏度。
本研究确定乙醇最佳体积分数为98%,之所以不研究更高的乙醇含量对光谱吸收曲线的影响,是因为反应体系中Fe2+、KSCN和HCl标准溶液的加入,会带入少量的水。

图2 反应介质中乙醇含量对配合物光谱吸收曲线的影响
2.3 酸含量对显色反应影响
根据2.1,2.2试验结果,研究在98%乙醇作为反应介质、测量波长为505 nm的条件下,反应介质中酸含量对显色反应的影响。试验结果(图3)表明,当反应介质中 HCl浓度从0.2 mmol/L增加到2 mmol/L,吸光度随着酸浓度的增加而增加。当反应体系中酸浓度大于5 mmol/L时,对照组和试验组比色管均出现浑浊,推测原因是高浓度的酸影响了KSCN或Fe2+在反应体系中的溶解,因此确定HCl最佳浓度为 2 mmol/L。

图3 反应介质中酸浓度对吸光度的影响
2.4 显色反应温度对显色反应影响
研究在98%乙醇作为反应介质、测量波长为505 nm、HCl浓度为2 mmol/L的条件下,反应温度对显色反应的影响。试验结果(图4)表明,反应温度从20℃增加到50℃,吸光度随显色反应温度的提高而增加,大于60℃之后,吸光度变化较少。确定最佳显色反应温度为50℃。
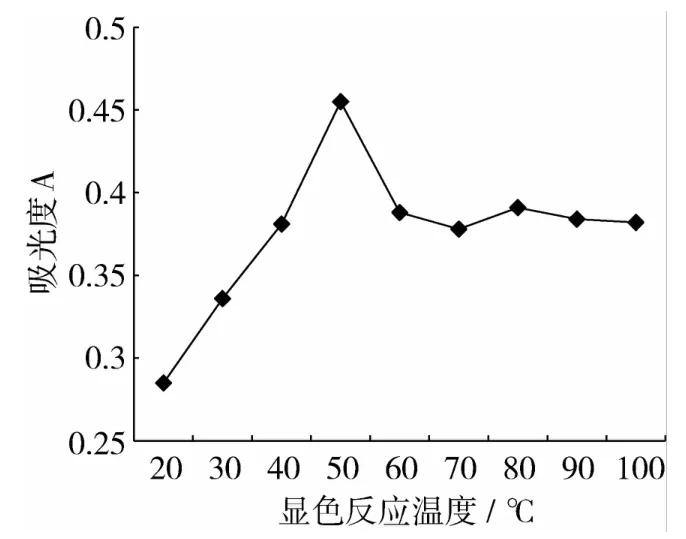
图4 显色反应温度对显色反应影响
2.5 显色反应时间对显色反应影响
研究在98%乙醇作为反应介质、测量波长为505 nm、HCl浓度为2 mmol/L、反应温度为50℃的条件下,显色反应时间对显色反应的影响。试验结果(图5)表明,反应时间从0 min增加到10 min时,吸光度随反应时间的延长而增加,大于10 min之后,吸光度变化趋于平缓。确定最佳显色反应时间为15 min。

图5 显色反应时间对显色反应影响
2.6 反应介质中Fe2+浓度对显色反应影响
研究在98%乙醇作为反应介质、测量波长为505 nm、HCl浓度为2 mmol/L、反应温度为50℃、反应时间为15 min的条件下,Fe2+浓度对显色反应的影响。试验结果(图6)表明,反应介质中Fe2+质量浓度从0 mg/L增加到10 mg/L,吸光度随着 Fe2+浓度增加而增加,当Fe2+质量浓度大于10 mg/L时,吸光度变化不大,说明此时Fe2+浓度对显色反应影响较小。确定反应介质中Fe2+最佳浓度为15 mg/L。
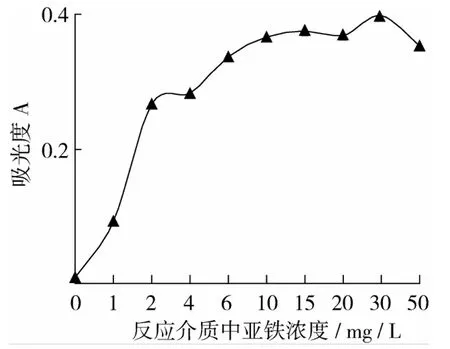
图6 反应介质中Fe2+浓度对显色反应影响
2.7 反应介质中KSCN浓度对显色反应影响
研究在98%乙醇作为反应介质、测量波长为505 nm、HCl浓度为2 mmol/L、反应温度为50℃、反应时间为15 min、Fe2+质量浓度为 15 mg/L的条件下,KSCN浓度对显色反应的影响。试验结果(图7)表明,反应介质中KSCN质量浓度从0 g/L增加到1 g/L,吸光度随着KSCN浓度增加而增加,当KSCN质量浓度大于1 g/L时,吸光度变化不大,说明此时KSCN浓度对显色反应影响较小。确定反应介质中KSCN最佳质量浓度为3 g/L。
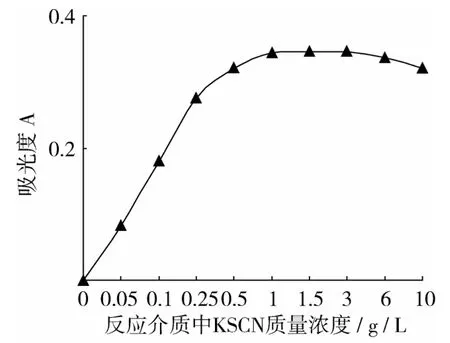
图7 反应介质中KSCN浓度对显色反应影响
2.8 共存物质干扰试验
试验结果表明,BPO含量相对误差在5%之内时,十倍的 Na+、K+、Sr2+、Ag+、Mg2+、NH4+、Ba2+、Cl-、NO3-对测定结果无干扰,等量的 Mo(V),W(V)干扰测定。而小麦粉中Mo(V)、W(V)天然含量
较少,所以此方法抗干扰能力强。
2.9 标准曲线与检出限
根据上述试验结果,确定最佳的试验条件为:显色反应在乙醇介质中进行,乙醇含量为98%,测量波长为505 nm,反应温度为50℃,反应时间为15 min。反应介质中 HCl、Fe2+和 KSCN的浓度为别为 2 mmol/L、15 mg/L和 3 g/L。标准曲线试验结果(图8)表明,标准曲线相关系数R2=0.999 4,高于其他已发表的、利用可见分光光度计的 BPO检测方法[6-7]。经过换算,BPO表观摩尔吸光系数 ε=2.136 5×104L·mol-1·cm-1,检出限为 0.025 mg/L。BPO浓度在0.1~15 mg/L范围内符合朗伯-比尔定律,BPO最大浓度为最小浓度的150倍,线性范围大于其他已发表的、利用可见分光光度计的BPO检测方法[6-7]。
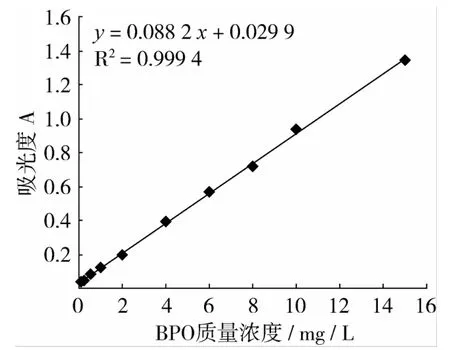
图8 BPO标准曲线
2.10 样品分析及回收试验
最佳试验条件下,进行BPO样品分析和回收率试验,结果(表1)表明,本方法样品测定回收率在97.2%~104.4%之间。
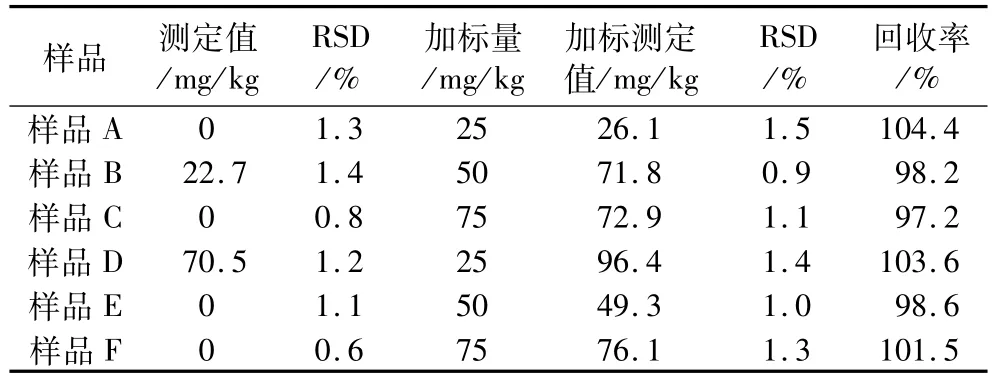
表1 市售小麦粉样品分析结果及回收率(n=6)
3 结论
本研究建立一种BPO检测方法,并对该方法进行试验条件研究,包括光谱吸收曲线、反应介质、酸含量、反应温度、反应时间、Fe2+浓度、KSCN浓度、共存干扰物质等因素对检测结果的影响。确定的最佳试验条件为:显色反应在乙醇介质中进行,乙醇含量为98%,测量波长为505 nm,反应温度为50℃,反应时间为15 min。反应介质中HCl、Fe2+和KSCN的浓度为别为2 mmol/L、15 mg/L和3 g/L。最佳试验条件下,本方法测定BPO的线性范围为0.1~15 mg/L,标准曲线为y=0.088 2x+0.029 9,相关系数 R2=0.999 4,505 nm处表观摩尔吸光系数 ε=2.136 5×104L·mol-1·cm-1,检出限0.025 mg/L。利用该方法对市售小麦粉样品进行测定,回收率在97.2%~104.4%之间。
[1]Fennema O R.Food chemistry[M].New York:Marcel Dekker Inc.,1985
[2]Wei C,Wen S,Zhao L,et al.Simple and fast fluorescence detection of benzoyl peroxide in wheat flour by N-methoxy rhodamine-6G spirolactam based on consecutive chemical reactions[J].Food Chemistry,2006,95:693-698
[3]王永勤,许桂萍.碘量法测定面粉中过氧化苯甲酰[J].中国公共卫生,2002,18(2):170-170
[4]刘晓庚.倍数滴定法快速测定面粉增白剂过氧化苯甲酰[J].粮食与饲料工业,2005(11):42-43
[5]张建夫,任凯,赵小萍,等.分光光度法测定小麦面粉中过氧化苯甲酰含量[J].安徽农业科学,2011,39(33):20560-20561
[6]张东,余萍,高俊杰,等.光度法测定小麦面粉中过氧化苯甲酰[J].理化检验 -化学分册,2008,44(5):436-437,440
[7]宋悦,侯彩云.过氧化苯甲酰检测方法的试验研究[J].中国粮油学报,2005,20(5):124-126
[8]杨玉帅,郗德凤,王淑娥,等.小麦粉中过氧化苯甲酰的毛细管气相色谱测定法[J].环境与健康杂志,2010,27(5):443-445
[9]林秋萍.气相色谱法测定面粉中过氧化苯甲酰[J].食品科学,2002,23(4):97-98
[10]Mu G,Liu H,Gao Y,et al.Determination of benzoyl peroxide,as benzoic acid,in wheat flour by capillary electrophoresis compared with HPLC[J].Journal of the science of food and agriculture,2012,92(4):960-964
[11]郑云峰,诸葛庆,葛乐勇,等.高效液相色谱法同时测定小麦粉及其制品中的苯甲酸和过氧化苯甲酰[J].粮食与饲料工业,2010(5):58-60
[12]Yukiko A O,Chikako Y,Naoki S,et al.Determination of benzoyl peroxide and benzoic acid in wheat flour by highperformance liquid chromatography and its identification by high-performance liquid chromatography-mass spectrometry[J].Journal of Chromatography A,2004,1040:209-214
[13]Liu W,Zhang Z J,Yang L.Chemiluminescence microfluidic chip fabricated in PMMA for determination of benzoyl peroxide in flour[J].Food Chemistry,2006,95:693-698
[14]Yang W P,Zhang Z J,Xu H.A novel capillary microliter droplet sample injection-chemiluminescence detector and its application to the determination of benzoyl peroxide in wheat flour[J].Talanta,2004,62:661-666
[15]李榕生,王峰,干宁.小麦粉中过氧化苯甲酰现场测定的肌红蛋白凝胶膜生物传感器研究[J].中国粮油学报,2009(6):157-160.

