雷公藤内酯醇对AD细胞模型核因子κB表达的影响
方 圆,胡晨阳,王 迪,李子平,孙逸达,王会玲
(1.承德医学院中医系2009级,河北承德 067000;2.承德医学院基础部2010级;3.承德医学院临床学院2009级;4.承德医学院心理系2011级;5.指导教师)
雷公藤内酯醇对AD细胞模型核因子κB表达的影响
方 圆1,胡晨阳2,王 迪3,李子平4,孙逸达4,王会玲5
(1.承德医学院中医系2009级,河北承德 067000;2.承德医学院基础部2010级;3.承德医学院临床学院2009级;4.承德医学院心理系2011级;5.指导教师)
阿尔茨海默病;雷公藤内酯醇;小胶质细胞;核因子κB
阿尔茨海默病(Alzheimer’s disease,AD) 是一种以记忆减退、认知障碍、人格改变为临床特征的中老年中枢神经系统退变性疾病,发病机制至今尚未完全阐明。β-淀粉样蛋白(β-amyloid peptide,Aβ)沉积激活胶质细胞引发脑内炎症反应在AD的发生发展中扮演着重要角色,而抑制胶质细胞活化的药物具有神经保护作用。雷公藤内酯醇(T10)是从雷公藤中提取的小分子单体活性成分,主要药理活性为抗炎和免疫抑制。本研究观察了Aβ作用后,小胶质细胞核因子(nuclear factor,NF-κB)表达的变化,并应用T10进行干预,以进一步阐明T10的作用机制。
1 材料与方法
1.1 材料
1.1.1 药物与试剂: T10由北京大学药学院屠鹏飞教授提供。兔抗NF-κB p65抗体为Santa Cruz公司产品,BCA蛋白定量试剂盒、ECL化学发光试剂盒为美国PIERCE公司产品,Aβ1-42由美国多肽公司生产。
1.1.2 主要仪器:超净工作台(北京半导体设备厂)、恒温摇床(德国HEIDOLPH)、台式高速冷冻离心机(德国HETTICH)、超低温冰箱(德国NUAIR)、CO2孵箱(SANYO)、酶标仪(美国BIO-RAD)。
1.2 方法
1.2.1 小胶质细胞培养:出生24h内SD乳鼠,断头取脑,剥离软脑膜和血管,吹打至组织块完全消散,离心5min(1000r/min),按1.5只脑/瓶(10ml)的密度将细胞悬液接种到75cm2细胞培养瓶中,置于37℃、5%CO2孵箱中培养,24h后更换含血清培养基,每3d半量换液一次。细胞培养到第14d时,将细胞培养瓶置于37℃恒温摇床,180转/min震摇2h,取上清液,离心10min(1000r/min),细胞用含血清培养基重悬,调整细胞密度至5×105/ml。
1.2.2 细胞处理:将细胞接种于六孔板,稳定24h后更换培养基。用无血清培养基培养24h作为对照组。Aβ组用无血清培养基培养12h,然后加入10μmol/L Aβ1-42孵育12h。T10组分别加入用不同浓度的T10(10-11、10-10、10-9、10-8mol/L)预 孵 育12h,然 后 加 入10μmol/L Aβ1-42共孵育12 h。给予相应处理后,收集细胞于-80℃冰箱冻存,用于检测NF-κB蛋白表达。
1.2.3 细胞存活率测定:药物处理至相应时间后,移去培养液,加入0.5mg/ml MTT溶液,100☒l/孔,孵育4-6h;加入助溶剂100☒l/孔,孵育6h,用酶标仪检测蓝色甲瓒的生成量,检测波长为570nm。
1.2.4 NF-κB表达的测定:加入冷的0.1mol/L PBS洗2次,加入100μl A液(10mmol/L Hepes pH7.9,10mmol/L KCL,0.1mmol/L EDTA,1mmol/L DTT,0.5 mmol/L PMSF),震荡15s,冰浴10min。加入5μl NP-40,震荡5s,4℃1min,震荡5s,16000r/min离心5min,弃上清。50μl B液(20mmol/L Hepes pH7.9,0.4mol/L NaCl,1mmol/L EDTA,1mmol/L DTT, 1mmol/L PMSF)重悬沉淀,震荡15s,冰浴10min,每10min震荡15s,共40min。16000r/min离心10min,收集上清-80℃保存,Western blot检测NF-κB的表达。一抗为兔NF-κB p65多克隆抗体,二抗为辣根过氧化物酶(horse radish per oxidase,HRP)标记的羊抗兔IgG,ECL显色,用凝胶成像分析系统进行光密度扫描,读取OD值。
1.3 统计学方法 统计分析采用Prism4.0版软件进行,多组计量数据间均数比较用单因素方差分析(ANOVAs)和Newman-Keuls检验, 以P <0.05为差异有统计学意义。
2 结果
2.1 T10对小胶质细胞存活率的影响 不同浓度的T10分别与小胶质细胞共孵育24 h,MTT法检测细胞存活率,结果见图1: 10-11-10-8mol/L T10对小胶质细胞均无毒性作用,而10-7mol/L T10可使小胶质细胞存活率明显下降。
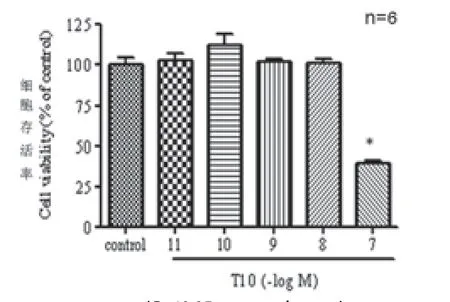
图1 T10对小胶质细胞存活率的影响
2.2 T10对Aβ1-42刺激小胶质细胞NF-κB表达的影响Western blot结果显示,Aβ作用后,NF-κB的表达明显升高增加(P<0.01),10-10-10-8mol/L的T10能够明显抑制Aβ1-42诱导的小胶质细胞核内NF-κB的表达(P<0.05),并呈较好的剂量依赖关系,见图2-3。
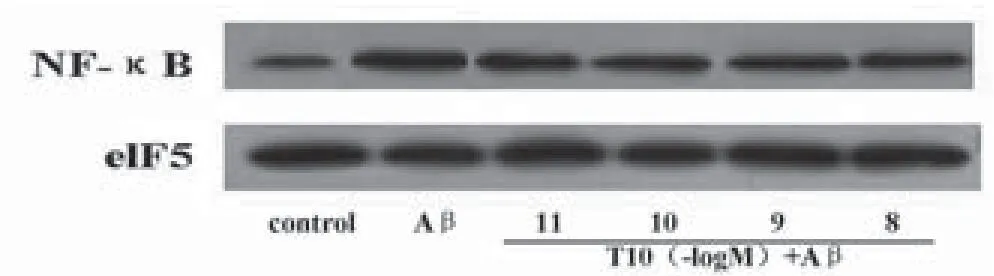
图2 Western blot 检测结果
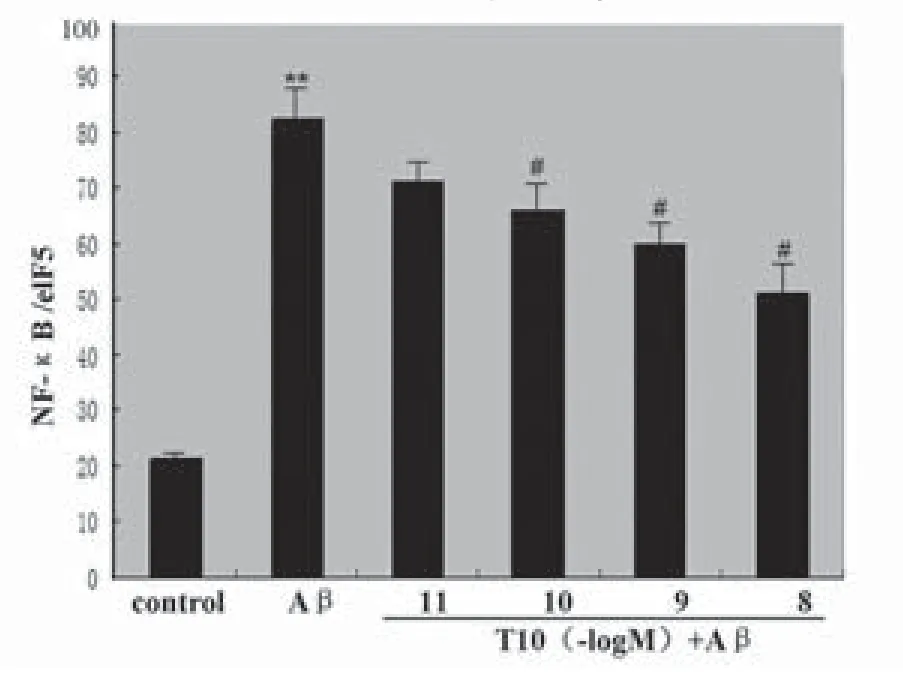
图3 T10对Aβ1-42刺激小胶质细胞NF-κB表达的影响
3 讨论
近年来,AD的免疫炎症学说得到了许多实验的支持[1],NF-κB在促进AD脑内慢性炎症反应的形成和炎性介质释放增加的过程中发挥着重要作用[2]。Aβ代谢异常和沉积是AD发生发展的关键因素,引起的脑内炎症反应是AD最重要的致病原因之一。[3]栖居于脑内的免疫细胞,特别是小胶质细胞在脑内炎症的过程中发挥了关键作用[4]。在AD的早期阶段,即认知功能剧烈下降之前,就出现了小胶质细胞的大量激活,成簇激活的小胶质细胞出现在淀粉样斑块上或环绕在受损组织外,活化的胶质细胞可分泌大量细胞毒性物质,如一氧化氮、炎性因子、兴奋性氨基酸、活性氧自由基等,参与了神经元的退变过程[5-7]。小胶质细胞激活后表达的免疫活性因子在介导AD的炎症反应中扮演着重要角色,而抑制胶质细胞活化的药物可能具有神经保护作用。
NF-κB是调控炎症反应的重要转录因子之一。小胶质细胞处于静息状态时,NF-κB主要位于胞浆,与抑制性蛋白IκB结合呈非活性状态。在外界刺激信号作用下,IκB发生磷酸化、泛素化,并被蛋白酶降解,NF-κB释放出来,迅速移位入细胞核,与靶基因上启动子区κB位点发生特异性结合,从而启动基因转录,调节一系列参与免疫、炎症反应及凋亡的基因表达。Aβ可激活体外培养神经元中的NF-κB[8]。Aβ可诱导原代培养的星形胶质细胞iNOS表达和NO的释放增加,而且是通过依赖NF-κB激活的机制来实现的[9]。尸检发现AD患者脑组织中NF-κB活性升高,在退变神经元和老年斑附近的神经元及胶质细胞内检测出p65的免疫活性[10]。这些研究从不同的角度说明NF-κB可能参与了Aβ的损伤机制。
本实验结果表明,10μmol/L Aβ1-42作用12h可有效地诱导NF-κB的核转位,使小胶质细胞核内NF-κB蛋白的表达明显增加,而10-11-10-8mol/L T10预孵育细胞12h,可使Aβ1-42诱导的小胶质细胞NF-κB表达减少,提示NF-κB很可能是T10发挥抗炎特性的一个药物作用靶点。NF-κB信号转导系统及其激活过程非常复杂,T10究竟干预了哪个具体环节有待进一步研究。
[1]Rojo LE,Fernandez JA,Maccioni AA,et al. Neuroin fl ammation:implications for the pathogenesis and molecular diagnosis of Alzheimer’s disease[J].Arch Med Res, 2008,39 (1):1-16.
[2]Samuelsson M, Fisher L, Iverfeldt K. Beta-amyloid and interleukin-1 beta induce persistent NF-kappaB activation in rat primary glial cells[J].Int J Mol Med,2005,16(3): 449-453.
[3]Sastre M,Walter J,Gentleman SM.Interactions between APP secretases and in fl ammatory mediators[J].J Neuroin fl ammation, 2008,5:25.
[4]Liu B, Hong JS. Role of microglia in in fl ammation-mediated neurodegenerative diseases:mechanisms and strategies for therapeutic intervention[J].J Pharmacol Exp Ther,2003,304 (1):1-7.
[5]Vehmas AK, Kawas CH, Stewart WF, et al. Immune reactive cells in senile plaques and cognitive decline in Alzheimer’s disease[J].Neurobiol Aging,2003,24(2): 321-331.
[6]Luber-Narod J,Rogers J.Immune system associated antigens expressed by cells of the human central nervous system[J]. Neurosci Lett,1988,94(1-2): 17-22.
[7]Mc Geer EG, Mc Geer PL. Inflammatory processes in Alzheimer’s disease [J].Prog Neuropsychopharmacol Biol Psychiatry,2003,27(5): 741-749.
[8]Kaltschmidt B, Uherek M,Volk B,et al.Transcription factor NF-kappaB is activated in primary neurons by amyloid beta peptides and in neurons surrounding early plaques from patients with Alzheimer disease[J].Proc Natl Acad Sci USA, 1997,94(6):2642-2647.
[9]Akama KT, Albanese C, Pestell RG, et al. Amyloid betapeptide stimulates nitric oxide production in astrocytes through an NFkappaB-dependent mechanism[J]. Proc Natl Acad Sci USA,1998,95(10):5795-5800.
[10]O’Neill LA,Kaltschmidt C.NF-kappa B:a crucial transcription factor for glial and neuronal cell function[J]. Trends Neurosci,1997,20(6): 252-258.
R965
A
1004-6879(2013)01-0076-03
2012-10-30)

