大连地区母胎铀暴露水平及其对胎儿发育的影响
李小薇,关 怀,朴丰源,张晶鑫
(1. 解放军第210 医院 妇产科,辽宁 大连116021;2. 大连医科大学 劳动卫生与环境卫生教研室,辽宁 大连116044;3.大连大学 附属中山医院 妇产科,辽宁 大连116001)
铀是自然发生最重的金属元素,具有放射性,是核工业的主要原料,天然产生的铀存在于地壳和地下水中[1]。普通人群可以通过吞咽被污染的食物和饮用被污染的水暴露于较低水平的环境铀,也可以通过铀污染的大气长期、持续地吸入铀[2-3]。慢性铀暴露可能与许多健康疾患相关,如恶性和非恶性呼吸系统疾病,胃癌,肾癌,肾衰和白血病等[2,4]。动物实验证实,小鼠暴露于低于饮用水标准的铀即可产生生殖和发育毒性[5-6]。然而,有关孕期环境水平铀暴露对胚胎/胎儿毒性的人群研究罕见。本研究对大连地区普通孕妇人群进行母胎全血铀浓度测定,并对脐血铀浓度与胎儿生长发育间关系进行统计分析,旨在了解当地普通城市居民母儿铀暴露现状,并为评价宫内铀暴露对胎儿生长发育的影响提供依据。
1 资料与方法
1.1 研究对象
选择2006年10月—2007年3月在解放军第210 医院妇产科住院的86 对母儿。母亲-新生儿配对是在办理住院和分娩时筛选而得。排除条件包括:(1)多胎妊娠;(2)母亲怀孕前或怀孕期间有重大病史;(3)极早产(分娩孕周<32 足周,或出生体重<1 500 g);(4)新生儿具有明显的出生缺陷[7]。全部孕妇均被告知本研究的目的及流程,并签署知情同意书。
1.2 方法
1.2.1 血样采集:征得孕妇及家属同意后,在孕妇常规住院检查时留取3 mL 静脉血(Mother whole blood,MWB),置于加有乙二胺四乙酸抗凝的专用真空采血管中,颠倒混匀,低温保存。待胎儿娩出时同法留取3 mL 脐血(umbilical cord blood,UCB)并保存[7]。
1.2.2 样品处理和检测分析:从每个全血样品中准确抽取200 μL 全血,加入400 μL 浓度为69%的硝酸,使用Mars-5 型微波消解仪(美国CEM,Inc)进行消解,将消解后的原液用纯水稀释至4.5 mL。使用Agilent7500CE 电感耦合等离子质谱系统(ICP -MS),美国Agilent,Inc,对全血铀(u)含量进行测定。为了保证ICP-MS 检测的准确性,使用COR -TOX质控品(批号HMB59311),美国Kaulson Laboratories,Inc 进行质量控制。同时抽取10%的样本进行重复测量[7]。
1.2.3 胎儿发育指标测量:以新生儿出生体重、身长、头围和胸围作为衡量胎儿发育的指标,其测量数据来自医院分娩记录。
1.3 统计学方法
使用SPSS11.5 软件进行统计分析。铀检出限为0.005 μg/L,测值低于检出限的样本赋值检出限的1/2[8]。经检验,母血及脐血铀浓度的原始值以及其对数值均不服从正态分布,故采用Mann -Whitney U 检验对母胎血铀浓度进行比较,采用Spearman 相关分析进行母胎血铀浓度间相关性分析。由于低于检出限的样本被赋予了相同的数值(1/2 检出限),而这部分样本大约占了全部样本的1/3 (86 份脐血,低于检出限的标本27 份,约占31.4%),因此,用全部脐血数据来分析胎儿铀负荷与发育指标间的相关性是不客观的。而且,低于检出限的观察对象铀暴露水平可忽略不计。因此,进一步分析中脐血铀浓度低于检出限的病例被去除,本研究定义这部分胎儿为非暴露胎儿。经检验,高于检出限的脐血样本铀浓度的对数值符合正态分布,本研究定义这部分胎儿为铀暴露胎儿。其后,采用脐血对数值对铀暴露胎儿的统计分析进行参数统计。采用Pearson 相关分析进行脐血铀浓度与胎儿发育指标间的相关性,采用散点图直观地显示它们之间的关系,采用直线回归验证胎儿铀暴露对胎儿生长发育的影响。P <0.05 为差异有统计学意义。
2 结 果
2.1 母血和脐血铀含量
母血铀检出率为61.63%(53/86)。母血铀浓度分布:低于检出限~0.623 μg/L,浓度中值和均值分别为0.042 μg/L 和0.074 μg/L。脐血检出率为68.60%(59/86)。脐血铀浓度分布:低于检出限~0.834 μg/L,浓度中值和均值分别为0.057 μg/L 和0.104 μg/L。
母、脐血铀浓度比较,差异无显著性意义。母血和脐血铀浓度间呈显著正相关(P <0.01)。
2.2 脐血铀含量对胎儿生长发育的影响
2.2.1 胎儿发育指标测量结果:86 例胎儿出生体重分布范围:2.20 ~5.20 kg,均值3.52 kg;出生身长分布范围:45.0 ~58.0 cm,均值52.7 cm;头围分布范围:30. 0 ~38. 0 cm,均值为34. 0cm;胸围30.0 ~40.0 cm,均值为34.1 cm。
2.2.2 胎儿发育指标与脐血铀浓度(对数值)间的相关性分析:Pearson 相关分析显示,胎儿发育指标(体重,身长,头围和胸围)与脐血铀浓度(对数值)间均呈显著负相关关系(P <0.05)。见图1。
2.2.3 胎儿发育指标与脐血铀浓度(对数值)间的线性回归分析:表1显示了胎儿发育指标与脐血铀浓度(对数值)间的直线回归方程。结果显示,胎儿发育指标与脐血铀浓度(对数值)间存在线性关系。回归方程如下:胎儿出生体重= -0.149 -0.255 ×脐血铀浓度(对数值);胎儿出生身长=2. 140 -0.060 × 脐血铀浓度(对数值);胎儿出生头围=2.695 -0.110 ×脐血铀浓度(对数值);胎儿出生腹围=1.600 -0.078 ×脐血铀浓度(对数值)。

图1 胎儿发育指标与脐血铀浓度(对数值)间的相关性分析Fig 1 Relationship between log-transformed cord u levels and the fetal developmental indicators
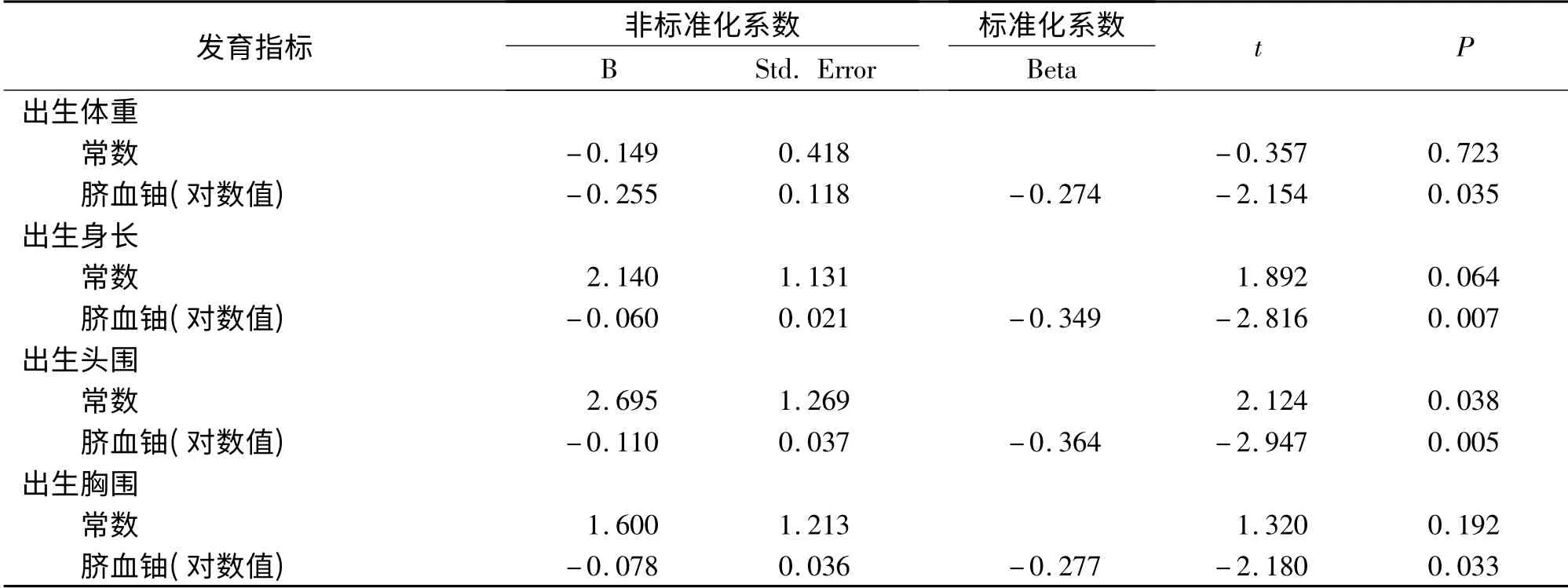
表1 胎儿各发育指标与脐血铀浓度(对数值)间的线性回归方程Tab 1 Linear regression equation of fetal developmental indicator and log-transformed values of fetal cord u
3 讨 论
近些年,核武器的开发利用导致世界各地铀矿采掘持续增加,环境铀暴露不断加重[5]。调查显示,中国土壤中铀含量高于世界平均水平,中国居民的特定膳食结构也是导致环境铀暴露的高危因素。Zhu H 等[9]的研究表明,中国主要城市大气尘埃中铀浓度高于世界平均水平,中国成人的主要食物,谷物、大米、肉类、叶状蔬菜、根茎蔬菜以及饮料和饮水中的铀含量达世界参考值的几倍到几十倍[10]。经测定,中国成年男子238铀系所致内照射剂量估算值(2.70 ×10-4Sv·a-1)约为世界估算值(1. 04 ×10-4Sv·a-1)的3 倍,235铀系所致内照射剂量估算值(3.76 ×10-7Sv·a-1)约为世界估算值(1.3 ×10-8Sv·a-1)的30 倍[10]。由此可见,中国居民面临环境铀暴露的形势比较严峻。本研究中,大连地区普通人群母脐血铀检出率均超过60%,提示母胎人群通过日常工作和生活暴露于环境中铀的情况较为普遍。本研究采用ICP-MS 法检测,铀检出限为0.005 μg/L。经测定,母血铀浓度范围从低于检出限至0.623 μg/L,脐血铀浓度范围从低于检出限至0.834 μg/L。可见,母脐血铀浓度在不同个体间差异较大。因该研究人群来自同一城市中心,地域跨度小,故推测如此大的浓度差别不能用地域和空气暴露来解释,作者推测经饮食摄入和工作环境暴露可能是造成铀暴露差异较大的主要因素。
本研究中,母脐血铀浓度比较无显著差异,提示胎盘对铀没有产生有效的屏障作用,铀容易经过胎盘到达胎儿,故胎儿完全暴露于母亲的铀负荷之下。母脐血铀浓度间呈显著正相关,提示,随母体铀负荷增加,胎儿面临铀暴露的风险也增加。因此,产前保健的第一步是避免或减少母亲对这种环境毒素的暴露。
发育中机体对环境毒素格外敏感,因为他们正处于快速的细胞增殖和广泛的生长分化过程中[11]。铀可能具有生殖和发育毒性,这在动物实验得到充分证实。Raymond-Whish S 等发现在低于美国环境保护机构规定的安全饮用水标准(元素铀浓度30 μg/L)时,通过饮水暴露于铀即可对雌鼠造成雌激素受体依赖性反应,如选择性初始卵泡减少,子宫重量增加等反应[5]。Domingo JL 等[6]对怀孕6 ~15 d 的Swiss 小鼠皮下注射醋酸双氧铀,观察到仔代出生体重、身长降低和骨骼畸形率增高等胚胎/胎儿毒性。其他的一些动物实验也观察到在怀孕的不同时期母兽暴露于铀均可造成胎儿生长受限和胚胎/胎儿畸形[12-14]。本研究中,对铀暴露组胎儿进行统计分析,发现胎儿各发育指标(体重,身长,头围,胸围)与脐血铀浓度(对数值)间均呈显著负相关关系,提示脐血铀浓度越高,胎儿各发育指标越低。直线回归分析显示,胎儿各发育指标(体重,身长,头围,胸围)与脐血铀浓度(对数值)间均可构建直线归回方程,方程中脐血铀浓度(对数值)的系数均为负数,提示宫内铀暴露对胎儿的生长发育具有负面影响。
总之,本研究结果显示,大连地区母胎人群可能已经暴露于环境铀,胎儿的暴露水平随母亲体内铀负荷升高而升高。即便是环境水平暴露,铀仍能对宫内生长的胎儿造成潜在负面影响。因本研究样例数少,尚需大样本流行病学调查进行相关研究。
[1] Kurttio P,Auvinen A,Salonen L,et al.Renal effects of uranium in drinking water [J]. Environ Health Perspect,2002,110(4):337 -342.
[2] Brugge D,de Lemos JL,Oldmixon B. Exposure pathways and health effects associated with chemical and radiological toxicity of natural uranium:a review [J]. Rev Environ Health,2005,20(3):177 -193.
[3] Mao Y,Desmeules M,Schaubel D,et al.Inorganic components of drinking water and microalbuminuria[J]. Environ Res,1995,71(2):135 -140.
[4] Roscoe RJ,Deddens JA,Salvan A,et al.Mortality among Navajo uranium miners[J]. Am J Public Health,1995,85(4):535 -540.
[5] Raymond-Whish S,Mayer LP,O'Neal T,et al. Drinking water with uranium below the U. S. EPA water standard causes estrogen receptor - dependent responses in female mice [J]. Environ Health Perspect,2007,115(12):1711 -1716.
[6] Domingo JL,Paternain JL,Llobet JM,et al. The developmental toxicity of uranium in mice[J]. Toxicology,1989,55(1 -2):143 -152.
[7] Guan H,Piao F,Zhang X,et al. Prenatal Exposure to Arsenic and Its Effects on Fetal Development in the General Population of Dalian [J]. Biol Trace Elem Res,2012,149(1):10 -15.
[8] Butler Walker J,Houseman J,Seddon L,et al. Maternal and umbilical cord blood levels of mercury,lead,cadmium,and essential trace elements in Arctic Canada [J].Environ Res,2006,100(3):295 -318.
[9] Zhu H,Wang N,Zhang Y,et al. Element contents in organs and tissues of Chinese adult men[J]. Health Phys,2010,98(1):61 -73.
[10] 诸洪达,刘庆芬. 中国成年男子摄入原生放射性核素所致内照射剂量估算[J]. 辐射防护,2005,25(2):91 -101,108.
[11] Anderson LM,Diwan BA,Fear NT,et al. Critical windows of exposure for children's health:cancer in human epidemiological studies and neoplasms in experimental animal models [J]. Environ Health Perspect,2000,108(Suppl 3):573 -594.
[12] Bosque MA,Domingo JL,Corbella J. Embryofetotoxicity of uranium in mice:Variability with the day of exposure[J]. Rev Toxicol,1992,9:107 -110[in Spanish].
[13] Bosque MA,Domingo JL,Llobet JM,et al.Embryotoxicity and teratogenicity of uranium in mice following SC administration of uranyl acetate[J]. Biol Trace Elem Res,1993,36(2):109 -118.
[14] Domingo JL. Reproductive and developmental toxicity of natural and depleted uranium:a review[J]. Reproduct Toxicol,2001,15(6):603 -609.

