慢性酒精中毒性肌病伴随免疫状态变化的实验研究
程学英,刘 奔,钟丽珍,赵 华,刘艳丽,张大伟,王剑锋
(1.大连医科大学 附属大连中心医院神经内二科,辽宁大连116033;2.大连医科大学诊断学实验中心,辽宁大连116044)
慢性酒精中毒在国内外均是一个社会性健康问题,可引起机体多系统发生病变[1]。目前对酒精中毒性肝病、脑病及周围神经病已有较多研究,但对酒精中毒性肌病报道较少。慢性酒精中毒性肌病是由于长期酗酒引起的一种肌肉病变,随着社会的进步和发展,中国的慢性酒精中毒性肌病发病率也呈现出增长的趋势,但是目前国内对于其发病机制等相关学科的研究尚处于起步阶段[2]。与此同时,机体免疫系统的状态能反应机体整体的健康水平,研究慢性酒精中毒性肌病发生时体内免疫状态的变化对此病的发病机制研究及临床治疗具有双重意义。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康雄性清洁级Sprague Dawley(SD)大鼠50 只,体重(200 ±20)g,由大连医科大学实验动物中心提供,自由食水,置于温度:20 ~25 ℃,湿度:50% ~60%,12 h 光照、12 h 黑暗条件下饲养,每5 ~6 只为一小组分养在笼中。实验动物许可证号:SCXK(辽)2008—0002。实验过程符合实验动物伦理学标准。
1.1.2 实验试剂
饲料:在标准全价饲料的配方基础上,每公斤再加入鸡蛋2 个,玉米油170 mL,蒸熟后外加一定量鱼肝油、多维素,混合制成改良的全营养高脂饲料,每天现做。该饲料中蛋白∶脂肪∶碳水化合物(能量比)=17%∶31%∶52%,与国外Lieber -Decarli 液体饲料中各成分能量比相同[2]。
灌胃液:56°红星牌二锅头(北京酿酒总厂),蔗糖水溶液。
实验仪器:721 分光光度计(精科,中国),MK3型酶标仪(Thermo,美国),流式细胞仪(BD,美国),RM2255 型切片机(Leica,瑞士),120 kV 透射电子显微镜(中国香港)。
1.2 方法
1.2.1 慢性酒精中毒性肌病(chronic alcoholic myopathy,CAM)模型的建立:按照国内改良的慢性酒精中毒性肌病模型建立方法[2]建立模型:实验开始前每只大鼠进行称重,按随机表法编号分组,分为实验组30 只,对照组20 只。前1 个月每10 天称重1次,以后每5 天称重1 次。每天清晨定时(9 点)给大鼠用56°红星牌二锅头灌胃,对照组给予含与酒精热量相等的蔗糖灌胃,同时喂饲相同的全营养高脂饲料。实验过程中注意观察大鼠的鼻尖湿润度、粪便成形度、皮毛光滑度等健康状况,以及灌胃后酒醉程度。于第10 周成模后取两组大鼠跖肌进行苏木素—伊红(HE)染色与透射电镜观察,其余操作按照实验要求分别进行处理。
1.2.2 透射电镜观察肌肉亚显微结构:加入3%戊二醛固定两组大鼠跖肌,4 ℃过夜。之后进行如下操作:于4 ℃用1% 四氧化锇固定1 h;漂洗后用1%锇酸固定液固定3 h;依次进行梯度脱水、包埋、固化及超薄切片;最后用3%醋酸铀-枸橼酸铅双染色,于透射电镜下观察肌肉超微结构的特征。
1.2.3 抗原免疫与采血:实验组与对照组大鼠均于第6 周灌胃前腹腔注射30% 卵清蛋白抗原,1.5 mL/只[3],并于第7 周、8 周同样方法加强免疫两次。于第9 周开始尾静脉采血,20 μL/只,连续采集7 d,直至第10 周成模。
1.2.4 抗卵清抗体的检测:取卵白抗原液,用包被液20 倍稀释,作为包被抗原。向聚苯乙烯微孔反应板中每孔加入100 μL 包被抗原,置于4 ℃冰箱过夜后,用洗涤液洗涤3 次,5 min/次,最后在滤纸上拍干,待用。20 μL 全血加于180 μL 标本稀释液中,每个标本用三复孔法加于ELISA 检测板。每个反应板预留30 孔,加入各浓度的标准血清,置于37 ℃孵育箱30 min,弃去拍干,洗涤液洗涤3 次,3 min/次,弃去拍干。取1 mL 辣根过氧化物酶标记的葡萄球菌A 蛋白(SPA-HRP)溶液,用标本稀释液40 倍稀释后,每孔加入100 μL,37 ℃孵育30 min 后取出,用洗涤液洗涤3 次,3 min/次。在滤纸上拍干后,每孔依次滴加底物液A 和B 各1 滴,于避光处反应15 min 后,每孔加入终止液1 滴,于450 nm 处比色,测定OD 值。取3 个平行孔结果的中位值为最终结果。其中,以标本稀释液代替待检血清,设为空白对照。根据标准血清的效价及所测OD 值,用SPSS10.0 统计软件,绘出标准曲线,得出线性回归方程,将所测OD 值通过线性方程换算成标准单位。标准血清及待检血清OD 值在计算时均先减去空白对照OD 值。
1.2.5 流式细胞仪CD19 阳性B 细胞检测:取大鼠新鲜全血200 μL 加于EDTA 抗凝管,轻摇混合。检测过程严格按照说明书进行。主要操作如下:将混合均匀的抗凝全血100 μL 加于装有4 μL 鼠抗鼠CD19/CD3 荧光抗体的试管,漩涡振荡5 s,混合均匀,室温避光孵育30 min。另取100 μL 抗凝血加于装有同型对照抗体的试管,同样方法标记30 min。30 min 后,加入红细胞溶血素室温避光孵育完全破坏红细胞,将两组试管2 000 r/min 离心5min,小心弃去上清,生理盐水洗涤2 次后,加0.5 mL 生理盐水稀释细胞,轻摇混合均匀,流式细胞仪定量检测。以阳性百分率为测量指标,用平均值±标准差表示。
1.3 统计学方法
采用SPSS 统计软件(10.0 版)完成,实验结果进行比较时均采用组间t 检验,P <0.05 为有统计学意义。
2 结 果
2.1 慢性酒精中毒性肌病模型大鼠与对照组大鼠体重的比较
实验组与对照组大鼠初始体重(g)无明显差异(198.36±2.38 与200.32 ±3.01,P=0.561),而在造模进行至第7 周时(第8 次称重),实验组大鼠体重与对照组比较差异开始出现显著性意义(326.03 ±6.63与360.88±8.28,P=0.006),在实验结束时,实验组大鼠体重已明显低于对照组,差异有显著性意义(343.26 ±7.56 与411.23 ±9.00,P =0.000)。两组大鼠各测量点的体重变化趋势见图1。
2.2 大鼠肌肉组织形态学观察
对照组大鼠肌纤维结构形态正常;实验组大鼠II 型肌纤维明显萎缩,呈多边形、三角形等不规则形状;细胞核与胞浆也出现相应病理改变,如空泡样变性等,这些变化与文献[2,4-5]报道相一致,证明慢性酒精中毒性肌病模型大鼠造模成功。两组大鼠肌肉组织形态学观察见图2。

图1 慢性酒精中毒性肌病模型大鼠与对照组大鼠体重的变化趋势Fig 1 The weight comparison between the chronic alcoholic myopathy model group rats and the control group rats
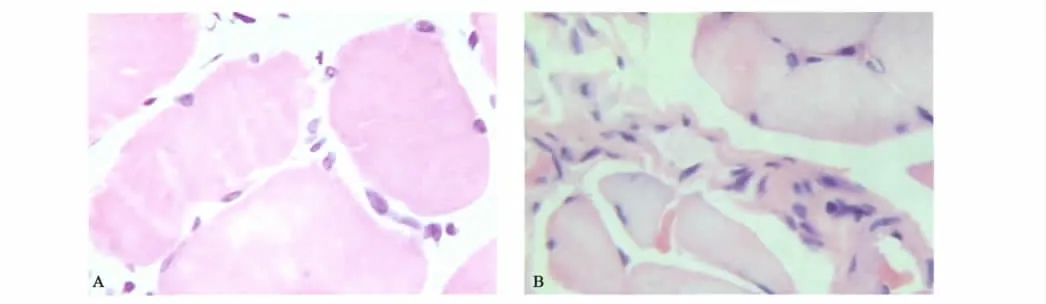
图2 两组大鼠肌肉组织形态学观察(HE ×1 600)Fig 2 Two muscle tissue morphology observation of the two group rats (HE ×1 600)
2.3 大鼠肌肉组织电镜观察
对照组大鼠肌原纤维中每两条Z 线间距离相等,Z 线规整、连续;实验组大鼠肌原纤维中Z 线不规则,呈现断裂或不连续状态,肌原纤维呈现明显萎缩,细胞核和线粒体也出现相应病理变化,见图3。
2.4 大鼠体内抗卵清抗体的检测
不同采血天数时两组大鼠抗卵清蛋白抗体的组间检验结果(通过标准曲线计算的抗体单位平均值)见图4,在不同采血时间,实验组大鼠抗卵清蛋白抗体单位与对照组大鼠比较差异均有显著性意义(P <0.05)。
2.5 两组大鼠CD19 阳性B 细胞的流式细胞仪检测
流式细胞仪检测结果表明,实验组大鼠CD19阳性B 细胞低于对照组,差异有显著性意义(23.68 ±2.63 与14.23 ±0.40,P=0.000),见图5。
3 讨 论

图3 两组大鼠肌肉组织电镜观察(×15 000)Fig 3 The muscle tissue electron microscopy observation of the two group rats (×15 000)


国外有资料显示约1/3 ~2/3 的慢性嗜酒者出现肌肉病变,慢性酒精中毒性肌病要比酒精性肝硬化、酒精性脑病、酒精性周围神经病以及酒精性胃肠病变更多见[6]。一项研究显示在250 个慢性嗜酒者中,只有20 人诊断为酒精性肝硬化,与之相比,有117 人诊断为酒精中毒性肌病[7]。这种病变已成为北美、欧洲等地区嗜酒者中最常见的肌肉病变[8]。与此同时,机体免疫系统的状态能反应机体整体的健康水平,研究慢性酒精中毒性肌病发生时体内免疫功能的状态对此病的发病机制研究及临床治疗具有双重意义。
本研究采用酒精灌胃方法造模,为接近临床实际病例,采用成品市售二锅头酒为灌胃液。为保证其纯度,购买后,双倍稀释,用分光光度法[11]验证其酒精含量。实验中去除了酒精性肝病造模饲料中促进肝损伤的吡唑,保留了可延缓酒精代谢、维持血液中酒精浓度的玉米油,并调整了灌胃液中的酒精浓度,以减轻酒精对肝脏的损害。本实验在成功构建大鼠慢性酒精中毒性肌病模型的同时,对其体液免疫功能的变化进行了探索性研究。实验结果表明,当慢性酒精中毒性肌病发生的时候,大鼠机体的直观健康状态会发生改变,如实验组大鼠进食量明显减少,体重不增,甚至下降,精神状态差,皮毛无光泽,与文献[2]报道相一致。与此同时,大鼠机体的免疫功能也发生变化。现代免疫学认为,高等动物体内的免疫应答是由多细胞系完成的,其中B 细胞主要介导体液免疫。当发生初次免疫应答的时候,机体产生的抗体主要是IgM 分子,对抗原结合力低;而再次应答的时候则主要为IgG 分子,为高亲和性抗体[9]。ELISA 法可以用来测定动物血清中待测分子的表达水平[10],本研究在实验组大鼠第6 周时给予初次免疫,并于第7、8 周时进行加强免疫,当造模成功时,ELISA 法检测的大鼠体内产生的抗体主要为IgG 分子,对其进行连续检测,可以反映出机体的体液免疫功能。同时,流式细胞仪检测的结果显示作为B 细胞主要的表面标志之一,CD19 阳性的B细胞在实验组中也呈现显著下降的趋势,说明介导抗体产生的主要细胞群——B 细胞的功能在慢性酒精中毒性肌病发生的时候同时呈现下降趋势。
长期过量饮酒可致机体多个器官、系统同时出现损害,本研究对慢性酒精中毒性肌病发生时伴随的体液免疫功能变化所进行的初步探索,为慢性酒精中毒性肌病的发病机制研究及治疗、预后提供了一定的参考。与遗传性肌病相比,慢性酒精中毒性肌病是一种经治疗病情可有不同程度缓解,甚至治愈的疾病,越来越多的学者开始关注其分子水平的作用机制[12],对慢性酒精中毒性肌病细胞分子水平的免疫学研究可以为其他代谢性肌病的研究奠定基础。
[1] Fernandez SJ,Preedy VR,Lang CH,et al. Molecular and cellular events in alcohol-induced muscle disease[J]. Alcoholism:Clinical and Experimental Research,2007,12(31):1953 -1962.
[2] 王剑锋,程学英,初海鹰,等.慢性酒精中毒性肌病模型的建立[J].中国神经医学杂志,2006,5(4):382 -385.
[3] 刘辉.临床免疫学和免疫学检验实验指导[M].第2 版.北京:人民卫生出版社,1999:19 -21.
[4] Adachi J,Asano M,Ueno Y,et al. Alcoholic muscle disease and biomembrane perturbations (review)[J]. Journal of Nutritional Biochemistry,2003,14(11):616 -625.
[5] Gonzalez RE,Duran CMC,Lopez LA,et al.Alcoholic Myopathy:Vitamin D Deficiency is Related to Muscle Fibre Atrophy in a Murine Model[J]. Alcohol & Alcoholism,2010,45(3):223 -230.
[6] Junko A,Risa K,Hideyuki N,et al. Fatty acid profile in skeletal muscle of the rat in response to acute (2.5 hours)and prolonged (6 weeks)ethanol -dosage[J]. Addiction Biology,2003,8:181 -189.
[7] Maximilian L,Kris VK. Alcohol's Effect on Other Chronic Liver Diseases[J]. Clinics in Liver Disease,2012,16(4):827 -837.
[8] Jung MK,Callaci JJ,Lauing KL,et al. Alcohol Exposure and Mechanisms of Tissue Injury and Repair[J]. Alcoholism Clinical and Experimental Research,2011,35(3):392 -399.
[9] 刘春英,弓晓峰,张振辉,等.刚果红吸光度法测定酒中乙醇含量[J]. 理化检验- 化学分册,2006,42(10):855 -856.
[10] 何维,曹雪涛,熊思东,等. 医学免疫学[M]. 第2 版.北京:人民卫生出版社,2010:281 -283.
[11] 刘宇,刘基巍,崔秀云,等.间接ELISA 法测定转基因小鼠血清中核糖核酸酶抑制因子的表达[J].大连医科大学学报,2006,28(6):450 -453.
[12] Van AN,Tran L,Ming T,et al. Impaired Insulin/IGF Signaling in Experimental Alcohol - Related Myopathy[J]. Nutrients,2012,4(8):1058 -1075.

