纳米银对小鼠流感治疗作用的研究
李秀景,尹俭俭,郑丛龙
(大连大学医学院 病原生物学教研室,辽宁 大连116622)
流感病毒能够引起个体的严重感染甚至导致死亡,对人类的健康造成威胁。流感病毒曾多次引起全球流感大流行,每次流行都造成了严重的人力和物力的损失[1-2]。据世界卫生组织报道:每年流感全球流行可引起300 万至500 万人发病,导致2万~5 万人死亡[3],受到流感感染的人口约20% ~40%,且流感导致的死亡率也在增加[4]。2009年3月在墨西哥暴发的甲型H1N1 流感,传播迅速,世界卫生组织于2009年6月11日便将全球流感疫情警戒等级提高到了第6 级,虽然流感病毒H1N1 的致病性低,但仍对全球的经济造成了严重的损失。
目前,临床上常用的流感治疗方法是药物治疗,但由于单链RNA 病毒缺乏自我校正的机制,在药物的作用下,其突变频率会明显增高[5],对药物产生耐药性,2008 -2009年在美国几乎100%的季节性H1N1 病毒对奥司他韦具有了耐药性,以及几乎所有的H3N2 病毒对金刚烷胺也产生了耐药性[6]。因此,研发安全有效的非特异的抗流感的药物或材料具有重要意义。本论文旨在通过鼻腔给药的方式,探讨纳米银在小鼠体内是否对流感病毒H1N1 感染有治疗作用,为纳米银治疗和预防流感病毒感染提供实验数据。
1 材料和方法
1.1 实验材料
清洁级昆明小鼠,体重18 ~22 g,雌雄各半,由大连医科大学实验动物中心提供[动物生产许可证号:SCXK(辽)2008 -0002]。流感病毒A/PR/8/34 H1N1(简称PR8 H1N1),血凝滴度为1∶2048,购自中科院武汉病毒研究所,经本实验室接种后冻存。纳米银溶液为本实验室研制,浓度为400 μg/mL。
1.2 实验方法
1.2.1 动物模型的建立:选择18 ~22 g 健康小鼠48 只,将其随机分成6 组:正常对照组、治疗阳性对照组、模型组、高剂量组(纳米银400 μg/mL)、中剂量组(纳米银100 μg/mL)和低剂量组(纳米银25 μg/mL),每组8 只,雌雄各半,分笼饲养。
将实验小鼠经乙醚麻醉,当小鼠进入麻醉状态且用鼻呼吸急促时,迅速进行滴鼻。正常对照组麻醉后滴鼻25 μL 生理盐水,模型组、治疗阳性对照组、高剂量组、中剂量组和低剂量组麻醉后滴鼻25 μL H1N1 病毒液。滴病毒液4 h 后进行治疗:模型组和正常对照组滴生理盐水30 μL,高剂量组、中剂量组和低剂量组滴相应浓度纳米银30 μL,治疗阳性对照组小鼠灌胃达菲20 mg/kg,至此为第1 次治疗。此后每隔24 h 进行1 次治疗,治疗总计3 次。
1.2.2 小鼠的一般生理指标:滴病毒之日记为第1天,连续观察14 d。每天称量小鼠体重,观察并记录小鼠的一般生理指标包括小鼠的活动情况、毛色、饮水与饮食等。
1.2.3 死亡率和生存天数:自滴病毒之日起,连续观察14 d,记录各组小鼠的生存天数,第14 天仍存活的小鼠,颈椎脱臼处死,其生存天数记录为14 d,数据整理,计算出各组小鼠的死亡率、平均生存天数和生命延长率,并绘制出各组的生存曲线。

1.2.4 肺指数:肺指数常被用来表示脚部炎性病变的严重程度,肺指数越大,肺部炎性病变程度越严重。小鼠滴病毒后,实时观察小鼠情况,小鼠死亡后称取死亡时小鼠体重,立即无菌解剖取肺用分析天平称量小鼠肺重;实验第14 天,未死亡的小鼠颈椎脱臼处死,无菌解剖取肺称重;计算各组小鼠的肺指数和肺指数抑制率,其计算公式:

1.2.5 肺病毒滴度的测定:将无菌取得的肺组织,用无菌研磨器充分研磨后,用无菌PBS 稀释肺组织研磨液,其稀释比例为肺重:PBS =1 kg:2 mL,将获得的稀释液在4 ℃离心机3000 rmp 离心15 min。通过血凝试验测定肺病毒的滴度。
1.2.6 肺组织病理学检查:将无菌取得的鼠肺用10%甲醛固定,洗涤,脱水,透明,浸蜡与包埋,切片,贴片与烤片,切片脱蜡及水化,染色:苏木精(Hematoxylin)和伊红(Eosin)染色法简称HE 染色,切片脱水、透明与封片,在光学显微镜下观察各实验组肺组织与正常肺组织相比,其病理学变化。
1.2.7 肺组织细菌的感染情况:将无菌取得的肺组织,用无菌研磨器充分研磨后,用无菌PBS 稀释肺组织研磨液,其稀释比例为肺重:PBS =1 kg:2 mL,吸取混匀的研磨稀释液50 μL 均匀涂布于血平板上,置37 ℃恒温箱中培养20 h,计数每个血平板上的菌落数。
1.3 统计学方法
采用SPSS17.0 统计学软件处理数据,计量资料用平均值()或平均值±标准差(±s)表示,组间差异比较用t 检验或单因素方差分析或非参数检验。P <0.05 为差异有显著性意义,P <0.01 为差异有非常显著性意义。
2 结 果
2.1 一般生理状况
正常对照组小鼠毛发光滑,活动敏捷,饮水、进食正常,体重持续增加;模型组小鼠滴病毒后第5天,活动减少,反应迟钝,毛色不光泽,开始出现战栗,饮食和饮水骤减,体重减轻,第6 天小鼠怂毛,脱毛,弓背,走路摇摆,呼吸急促并开始死亡,体重与正常对照组小鼠比较明显有差异;低剂量组和中剂量组在滴病毒5 天时,与正常对照组比较,活动减少,毛色略显暗淡,体重减轻或未改变,与模型组比较,症状较轻,未出现战栗,在第10 天时,这两组大部分小鼠活动开始增加,体重开始增加,饮食饮水开始增加;高剂量组和治疗阳性对照组小鼠在滴病毒5 天时,与正常对照组比较,活动略少,毛色变化不大,体重不变或减轻,在第8 天时,其大部分小鼠体重开始出现增加的趋势,活动增多,饮食饮水开始增加。
2.2 死亡率和生存天数
模型组14 天内的死亡率为100%,其实验小鼠第6 天开始死亡并于第6、7、8 三天集中死亡,其平均生存天数为7.13 d;治疗阳性对照组的死亡率为12.5%,其实验小鼠的平均生存天数为13.75 d,与模型组相比差异有显著性意义,P <0.01,其生命延长率为92.85%;高剂量组死亡率为0,其实验小鼠平均生存天数为14 d,与模型组相比差异有显著性意义,P <0.01,其生命延长率为96.35%;中剂量组死亡率为12. 5%,其实验小鼠平均生存天数为13.13 d,与模型组相比差异有显著性意义,P <0.01,其生命延长率为84.15%;低剂量组死亡率为37.5%,其实验小鼠平均生存天数为12.22 d,与模型组相比差异有显著性意义,P <0.01,其生命延长率为71.39%,见图1。

图1 生存曲线Fig 1 Survivorship curve
2.3 肺指数
用H1N1 病毒感染后,模型组小鼠的肺脏重量明显增加,肺指数明显增高,与正常对照组相比差异有显著性意义,P <0.01;感染病毒4 h 后给予不同浓度的纳米银和达菲治疗,连续治疗3 d,治疗阳性对照组、高剂量组和中剂量组的肺指数均有所降低,且3 组分别与模型组相比差异有显著性意义,P <0. 01,这3 组的肺指数抑制率分别为87.40%、90.55%、74.41%;低剂量组与模型组比较,差异无显著性意义,P >0.05。各组肺指数均值见表1。

表1 肺指数和肺指数抑制率Tab 1 Lung index and lung index inhibition rate
2.4 肺病毒滴度
模型组75%小鼠的肺组织病毒滴度为1∶512,25%的小鼠高达1∶1024;治疗阳性对照组75%小鼠的肺组织病毒滴度为<1∶2,12.5%为1∶4,12.5%为1∶8,与模型组相比差异有显著性意义,P <0.01;高剂量组小鼠的肺组织病毒滴度均为<1∶2,与模型组相比差异有显著性意义,P <0.01;中剂量组75%小鼠的肺组织病毒滴度为<1 ∶2,12.5% 为1 ∶4,12.5%为1∶8,与模型组相比差异有显著性意义,P <0.01;低剂量组50%小鼠的肺组织病毒滴度为<1∶2,37.5%为1∶8,12.5%为1∶4,与模型组相比差异有显著性意义,P <0.01。
2.5 肺组织病理学检查
无菌剖取鼠肺,正常对照组鼠肺呈粉红色,体积较小;模型组鼠肺充血水肿,呈暗红色,体积增大;治疗阳性对照组鼠肺颜色比正常鼠肺浅,部分部位充血,体积大小比正常鼠肺大,比模型组小;高剂量组鼠肺颜色与正常鼠肺相近,但部分部位有充血现象,体积大小与正常鼠肺相近。中剂量组和低剂量组鼠肺的左肺1/3 ~1/2 有充血现象,且低剂量组比中剂量组充血现象严重,体积大小比正常鼠肺大。光学显微镜下观察(见图2),正常对照组小鼠肺组织的形态结构完整,肺泡大小均一,肺泡壁厚度正常,外周未见有炎性细胞浸润;模型组小鼠肺组织的形态结构消失,肺泡壁增厚,组织间可见大量红细胞,肺泡间隔的毛细血管扩张、淤血,肺泡腔缩小,且肺泡腔见水肿液;治疗阳性对照组肺组织病变比模型组减轻,可见部分肺组织形态结构趋于完整,肺泡壁比模型组薄但仍然比正常鼠肺厚;高剂量组小鼠肺组织的病变明显减轻,肺组织形态结构较为完整,但仍见肺部瘀血现象,肺泡壁明显薄于模型组,肺泡壁肺泡腔中无水肿液。中剂量组肺组织病变比模型组轻,肺部淤血,只有部分肺泡腔完整,其肺泡壁比高剂量组厚;低剂量组只有少部分肺泡腔完整但肺泡腔减小,瘀血现象比较严重。
2.6 肺组织细菌的感染情况
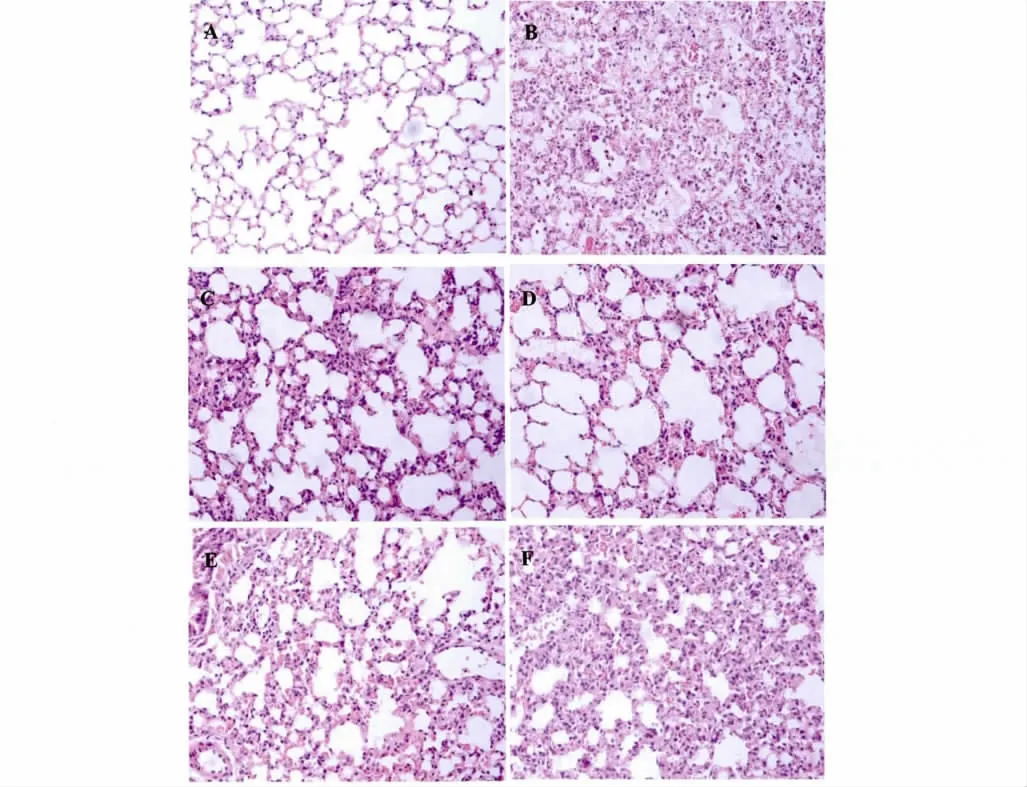
图2 肺组织病理检查(×200)Fig 2 Lung histopathological examination (×200)
将研磨稀释液50 μL 均匀涂布于血平板,37 ℃恒温箱中培养20 h 后,在平板上观察到两种不同的菌落:一种含量较多为白色不透明,表面光滑,直径2 ~3 mm,经革兰染色为革兰阳性球菌,触酶试验为阳性,判断为葡萄菌属;将该种菌接种至BIO -KONT Rap. S -16 葡萄球菌及微球菌鉴定试验条中,用BIO-KONT 鉴定软件分析知该细菌为木糖葡萄球菌,其鉴定概率为99.97%。另一种相对少为溶血性细菌,黄色不透明,直径约为1 mm,经革兰染色为革兰阳性球菌,触酶试验为弱阳性,判断为葡萄菌属;将该种菌接种至BIO -KONT Rap. S -16葡萄球菌及微球菌鉴定试验条中,用BIO - KONT鉴定软件分析知该细菌为溶血葡萄球菌,其鉴定概率为99.96%。模型组的平板上可见木糖葡萄球菌和溶血葡萄球菌两种细菌,其菌落总数为4197.02 cfu/肺。高剂量组和中剂量组的平板上仅见木糖葡萄球菌,其菌落数分别为426. 63 cfu/肺、635. 43 cfu/肺,与模型组相比差异有显著性意义,P <0.01。治疗阳性对照组和低剂量组的平板上可见木糖葡萄球菌和溶血葡萄球菌两种细菌,其菌落数分别为1335.77 cfu/肺、1638.03 cfu/肺,与模型组相比差异有显著性意义,P <0.01。
3 讨 论
本次实验研究结果显示:经纳米银治疗后,小鼠的死亡率降低,生存时间延长,肺指数降低,肺组织病变减轻,说明纳米银对小鼠流感有治疗作用;纳米银治疗后,小鼠肺组织病毒滴度降低,肺组织细菌感染情况减轻,说明纳米银在抗病毒的同时也对细菌有抑制作用。
病毒感染细胞的全过程包括:病毒对细胞的吸附和侵入、脱壳、病毒遗传物质的转录与复制、子代病毒颗粒的组装、出芽和释放。病毒繁殖的每个环节都有可能成为抗病毒药物的作用靶点,通过干扰其中的一个或多个环节可阻断病毒的复制和繁殖。在病毒感染和复制的过程中,血凝素(Hemagglutinin,HA)蛋白和神经氨酸酶(Neuraminidase,NA)起着重要的作用[7]。本课题组曾研究[8]:纳米银处理流感病毒后,病毒的血凝滴度明显降低;纳米银对流感病毒NA 活性的抑制率均高于50%,能够有效地抑制NA 的活性,从而阻断病毒对细胞的感染。本次实验证实纳米银能够治疗小鼠流感,故推测纳米银对流感病毒的作用机制可能是纳米银结合病毒表面的HA 空间保守结构,从而影响病毒表面蛋白与上皮细胞HA 受体的识别;也可能是纳米银结合和破坏NA,或封闭上皮细胞上的NA 受体,抑制子代病毒体的成熟或干扰成熟的病毒体的释放,从而阻断病毒对细胞的感染。
本实验通过鼻腔给药的方法进行探讨,其治疗作用除与纳米银对流感病毒直接作用外,可能还与小鼠本身的免疫反应尤其是黏膜免疫有关。流感病毒入侵机体的主要门户是呼吸道黏膜,其具有黏膜免疫作用,因此呼吸道黏膜是机体防御的重要屏障。有报道称,呼吸道上皮细胞与多种呼吸道疾病有密切的关系[9]。覆盖着一层假复层纤毛柱状上皮细胞,纤毛不停地摆动,具有机械的屏障作用,且呼吸道黏膜上皮地杯状细胞和粘液腺的上皮细胞能分泌粘液,当病毒感染机体时,纤毛活动和分泌粘液可以阻挡病毒对机体的感染;呼吸道黏膜部位有游走的或固定的吞噬细胞,其能够吞噬病毒,减少病毒对机体的感染;黏膜下层有丰富的淋巴网,能够阻留和破坏病毒;正常人的呼吸道黏膜上皮细胞由于接受某些病毒的隐性感染,常含有一定量的干扰素,可对病毒发生干扰作用。纳米银对流感病毒的直接作用和小鼠的黏膜免疫作用,使得纳米银对小鼠流感有治疗作用。
但是流感病毒一旦感染细胞,就会分泌一些有利于病原体繁殖的蛋白酶和细胞因子,对呼吸道黏膜产生破坏,容易继发细菌感染[10]。有研究显示,流感病毒感染后容易引起细菌感染如金黄色葡萄球菌、肺炎链球菌和流感嗜血杆菌等[11-14];细菌感染后能够促进流感病毒的感染,如金黄色葡萄球菌具有的细菌性蛋白酶能够促进流感病毒表面的HA 开裂,从而促进病毒的活化和复制,增强其感染性和致病力[15-16],增加了流感病毒感染后的病死率[17-18]。对于流感病毒感染继发细菌感染,大家认为出现细菌性肺炎后病毒的感染就基本结束,只进行抗菌感染忽视了抗病毒的治疗,使流感的病死率增加;有研究发现小鼠感染流感病毒第5 天用奥司他韦治疗,可明显减轻流感病毒肺炎的并发症并降低其病死率[19]。本实验对小鼠肺组织病毒滴度和细菌感染情况进行了研究,结果显示,经纳米银治疗后小鼠肺组织病毒滴度降低,细菌感染情况减轻,说明纳米银具有抗病毒和抗菌的双重作用,从而降低实验小鼠的死亡率。
目前临床上常用的抗流感病毒药物有两种,干扰病毒M2 蛋白功能的药物即离子通道抑制剂(金刚烷胺和金刚乙胺),以及神经氨酸酶抑制剂(奥司他韦和扎那米韦)。金刚烷胺和金刚乙胺作用靶点为M2 蛋白四聚体形成的离子通道,通过阻碍H+流向病毒粒子内部,使病毒粒子内部pH 值居高不下,从而阻碍病毒HA 构象的改变,使HA1 和HA2 不能分离,阻碍了病毒膜和内体膜的融合,使病毒脱衣壳受阻。奥司他韦和扎那米韦通过与流感病毒神经氨酸酶活性点的保守残基段的不同部位特异性结合,从而造成酶活性丧失,使依附在糖蛋白和糖脂上的末端唾液酸不能裂解,从而导致流感病毒子代毒粒不能从感染细胞表面释放和阻断病毒的播散[20-21]。纳米银颗粒具有小尺寸效应、表面效应、宏观量子隧道效应等,可以轻易地进入病原体[22]。纳米银可以与菌体酶蛋白的巯基结合,使酶失活,从而达到杀菌的作用;纳米银可以与DNA 的碱基结合,使DNA 变性,导致细菌失活[23];纳米银的抗菌效能与纳米粒子的总面积有关。纳米银多靶点的非特异性抗菌和抗病毒作用,使其在应用过程中不易产生耐药性[24]。纳米银对小鼠和细胞无明显的毒性作用[25],其用于黏膜局部抗病毒将成为一种新的研究方向。本研究通过鼻腔给药的治疗方法,证实纳米银对小鼠流感有很好的治疗效果,为纳米银临床黏膜局部抗流感病毒提供了实验数据。
[1] Fedson DS. Vaccine development for an imminent pandemic:why we should worry,what we must do[J]. Hum Vaccine,2006,2(1):38 -42.
[2] Hampson AW. Vaccines for pandemic Influenza. The history of our current vaccines,their limitations and the requirements to deal with a pandemic threat[J]. Ann Acad Med Singapore,2008,37(6):510 -517.
[3] Taia TW,Gene ST,Rong H,et al. Broadly Protective Monoclonal Antibodies against H3 Influenza Viruses following Sequential Immunization with Different Hemagglutinins[J].PLoS Pathog,2010,6(2):e1000796.
[4] Kamol S,Thaweesak C,Chitima T,et al. Molecular Evolution of Human H1N1 and H3N2 Influenza A Virus in Thailand,2006 - 2009[J]. PLoS One,2010,5(3):e9717.
[5] 陈鸿珊,张兴权. 抗病毒药物及其研究方法[M].北京:化学工业出版社,2006:113 -122.
[6] Dharan NJ,Gubareva LV,Meyer JJ,et al. Infections with oseltamivir-resistant influenza A(H1N1)virus in the United States[J]. JAMA,2009,301(10):1034 -1041.
[7] 朱广蕊,潘耀谦,夏银可,等.甲型H1N1 流感病毒致病机理研究进展[J]. 动物医学进展,2011,32(8):70 -74.
[8] Xiang DX,Chen Q,Pang L,et al. Inhibitory effects of silver nanoparticles on H1N1 influenza A virus in vitro[J]. J Virol Methods,2011,178(1 -2):137 -142.
[9] Proud D,Leigh R. Epithelial cells and airway diseases[J]. Immunological Reviews,2011,242:186 -204.
[10] Hers JF,Mulder J. Broad aspects of the pathology and pathogenesis of human influenza[J]. Am Rev Respir Dis,1961,83:84 -94.
[11] Mandell LA,Wunderink RG,Anzueto A,et al. Infectious Diseases Society of America /American Thoracic Society consensus guidelines on the management of community -acquired pneumoniaina-dults[J]. Clin Infect Dis,2007,44:S27 -S72.
[12] Zeller V,Bricaire F. In fluenza pneumonia[J]. Rev Prat,2003,53(13):1442 -1445.
[13] Fujita J. Clinical features of pneumonia associated with influenza virus infection[J]. Nippon Rinsho,2003,61(11):1936 -1944.
[14] Allard R,Couillard M,Pilon P,et al. Invasive bacterial infections following influenza:a time - series analysis in Montréal,Canada,1996 -2008[J]. Influenza Other Respi Viruses,2012,6(4):268 -275.
[15] Tashiro M,Ciborowski P,Klenk H,et al. Role of Staphylococcus protease in the development of influenza pneumonia[J]. Nature,1987,325(6104):536 -537.
[16] Scheiblauer H,Reinacher M,Tashiro M,et al. Interactions between bacteria and influenza A virus in the development of influenza pneumonia[J]. J Infect Dis,1992,166(4):783 -791.
[17] McCullers JA. Insights into the interaction between influenza virus and pneumococcus[J]. Clin Microbiol Rev,2006,19(3):571 -582.
[18] Sun K,Metzger DW. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection[J]. Nat Med,2008,14(5):558 -564.
[19] McCullers JA. Effect of antiviral treatment on the outcome of secondary bacterial pneumonia after influenza [J]. J Infect Dis,2004,190(3):519 -526.
[20] Yu K,Luo C,Qin G. Why are oseltamivir and zanamivir effective against the newly emerged influenza A virus (A/H1N1)?[J]. Cell Res,2009,19(10):1221 -1224.
[21] Matrosovich MN,Matrosovich T Y,Gray T,et al. Neuraminidase is important for the initiation of influenza virus infection in human airway epithelium[J]. J Virol,2004,78(22):12665 -12667.
[22] 张媛媛,孙皎. 纳米银作为抗菌材料的生物安全性研究进展[J]. 中国医疗器械杂志,2007,31(1):36 -38.
[23] Feng QL,Wu J,Chen GQ,et al. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J]. J Biomed Mater Res,2000,52(4):662 -668.
[24] Demling RH,De Santi L. Effects of sliver on wound management[J]. Wounds,2001,13(1supplA):1 -15.
[25] 向冬喜,陈娜娜,裘红梅,等. 纳米银毒理学安全性研究[J]. 实用医学杂志,2010,26(11):1906 -1908.

