体外定点突变PCR法构建abl T315I突变的重组质粒标准品
石淙,张长林,简正伟,江梅,闻芳,万腊根
(南昌大学第一附属医院检验科,江西南昌330006)
·论著·
体外定点突变PCR法构建abl T315I突变的重组质粒标准品
石淙,张长林,简正伟,江梅,闻芳,万腊根
(南昌大学第一附属医院检验科,江西南昌330006)
目的利用聚合酶链反应(PCR)定点突变技术构建含人类abl基因第6号外显子片段的野生型及含T315I突变型重组质粒,作为检测abl T315I基因突变的阳性对照和阴性对照标准品。方法先设计包括突变位点的两对引物,以健康人外周血基因组DNA为模板,扩增获得野生型和突变型abl基因第6号外显子片段,将其插入pSG5M-flag载体质粒中,并将所获重组质粒分别进行酶切与测序鉴定,通过紫外分光光度计检测标本的浓度和纯度。结果DNA测序表明在预期位点上发生突变,abl基因第315位氨基酸密码子由苏氨酸(Thr)残基突变为异亮氨酸(Ile)残基,所构建abl基因野生型和突变型质粒,经酶切和测序鉴定与目的片段完全一致。结论PCR技术诱导定点突变准确、高效。所构建含野生型和T315I突变的abl基因重组质粒,可为检测abl基因T315I突变提供阴性和阳性对照以及质控品,同时也为T315I突变的相关研究奠定了基础。
定点突变;abl基因;T315I;阳性对照
慢性粒细胞白血病(CML)属造血干细胞克隆性血液肿瘤,主要累及粒细胞系,90%以上患者可检测到特异性Ph染色体及bcr/abl融合基因。Ph染色体是9号染色体长臂和22号染色体长臂易位的结果,使得9q34的abl原癌基因断裂并易位到22q11的断裂点集簇区(BCR),并在断点处重新组合形成BCR/ABL融合基因。研究显示,bcr/abl融合基因及其突变在CML发生与预后中起着重要的作用。T315I点突变时,abl基因第6号外显子的第315位苏氨酸(Thr)被异亮氨酸(Ile)替代,碱基由ACT变为ATT。迄今为止,该点突变是CML患者最难以克服且预后最差的类型。因此,检测abl T315I突变有助于判断CML疗效与预后。目前常用的检测abl基因突变的方法为等位基因特异性PCR法(AS-PCR),为了保证检测结果的准确性,需设立阳性对照、阴性对照和空白对照。因此获得此突变的基因片段的重组质粒作为阳性对照和阴性对照非常重要,而采用普通的PCR方法难以获得T315I突变的abl cDNA片段。本研究采用体外定点突变的方法,从健康人基因组中通过PCR获得突变的abl cDNA片段,并构建野生型和突变型abl基因重组质粒,作为后续检测的标准品和对照。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株工程菌E.coli DH5α、pSG5M-
Flag质粒载体均为本实验室保存。
1.1.2 主要试剂限制性内切酶EcoRⅠ、PstⅠ和T4DNA连接酶均购自TaKaRa公司;琼脂糖购自GENE TECH公司;2×Taq Master Mix购自康为世纪公司;PCR引物由上海英潍捷基贸易有限公司合成;琼脂糖凝胶电泳DNA回收试剂盒、DNA Marker、普通质粒小提试剂盒均购自TIANGEN公司。
1.1.3 主要器材超净工作台(苏州苏洁净化设备有限公司),电子天平(上海赛多利斯天平有限公司),热循环扩增仪(ABI2720),电泳仪、电泳槽(北京君意东方电泳设备有限公司),凝胶成像仪(上海培清科技有限公司),高速离心机(中科中佳科学仪器有限公司),电热恒温干燥箱(上海跃进医疗器械厂),电热恒温培养箱(黄石市恒丰医疗器械有限公司),HZ-9211K恒温振荡器(太仓市科教器材厂)。
1.2 方法
1.2.1 引物的设计按照引物设计原则,采用引物定点突变的方法[2],根据GenBank中正常abl基因序列设计3条引物,野生型下游引物(A1),突变型下游引物(A3),以及共同的上游引物(A2)。其中A1和A3引入EcoRⅠ酶切位点,且A3中带有一个突变位点,即在第6号外显子第315位密码子的点突变(ACT→ATT);A2引入PstⅠ酶切位点。3条引物分别是:A1:5'-atcGAATTCgttcccgtaggtcatg-3'(内含EcoRⅠ限制性内切酶位点);A3:5'-atc-GAATTCgttcccgtaggtcatgaactcaatgatgat-3'(内含EcoRⅠ限制性内切酶位点,同时引入突变位点) A2:5'-ccCTGCAGaaattcaagttcactggc-3'(内含PstⅠ限制性内切酶位点)。划线部分为酶切位点,方框内为突变碱基。引物由上海英潍捷基贸易有限公司合成,用高压灭菌水配制成10μmol/L。
1.2.2 目的基因的扩增分别执行下列2个反应,反应体系均为50μl,依次加入25μl 2×Taq Master Mix;2μl引物A1(另一反应体系为A3);2μl引物A2;5μl健康人淋巴细胞基因组为模板;16μl高压灭菌水。反应条件为:95℃5min;95℃30s,55℃30s,72℃30s,30个循环;72℃再延伸10 min。扩增产物用1.5%琼脂糖凝胶电泳鉴定。引物A1/A2扩增的产物命名为wild;引物A3/A2扩增的产物命名为T315I。
1.2.3 野生型和T315I突变的abl重组质粒的构建将扩增得到的野生型和突变型abl基因片段以及pSG5M-flag质粒载体通过限制性内切酶EcoRⅠ和PstⅠ均经37℃双酶切过夜,基因片段酶切反应体系为50μl,2μl EcoRⅠ,2μl PstⅠ,30μl abl基因片段,5μl 10×H buffer,11μl灭菌水。载体质粒酶切反应体系为50μl,2μl EcoRⅠ,2μl PstⅠ,15μl载体质粒pSG5M-flag,5μl 10×H buffer,26μl灭菌水。次日,1.5%琼脂糖凝胶电泳,经割胶回收后,在T4DNA连接酶作用下16℃连接过夜。连接反应体系为10μl,4μl野生型/突变型基因片段酶切产物,1μl载体质粒pSG5M-flag酶切产物,5μl T4DNA连接酶。次日,将10μl连接产物转化到感受态细胞E.coli DH5α中,接种至含氨苄西林的LB固体培养基上,37℃过夜培养。挑取单个菌落接种于含氨苄西林的LB培养液中,37℃过夜振荡。用TIANGEN质粒小提试剂盒提取质粒DNA,DNA经紫外分光光度计定量测定后进行酶切鉴定和测序鉴定。
1.2.4 野生型和T315I突变的abl重组质粒的酶切和测序鉴定取4μl提取好的重组质粒pSG5M-flag-abl(wild)和pSG5M-flag-abl(T315I),通过限制性内切酶EcoRⅠ和PstⅠ双酶切,酶切条件为:10× H buffer 1μl,EcoRⅠ和PstⅠ各0.5μl,重组质粒4μl,加灭菌水至10μl,放置37℃水浴中酶切4h后,加入10×Loading Buffer进行电泳分离,同时将未经酶切的重组质粒作为阴性对照,然后在紫外光下鉴定条带,当重组质粒中含有目的片段时,酶切将产生两条带。将酶切成功的质粒送公司测序,然后与GenBank中的序列进行比对。
1.2.5 质粒标准品浓度和纯度检测先采用EB缓冲液或者三蒸水在紫外分光光度仪波长260 nm/ 280nm处做空白校正,然后取2μl重组质粒pSG5M-flag-abl(wild)和pSG5M-flag-abl(T315I),用EB或者三蒸水稀释至50μl,采用紫外分光光度仪测定标准品OD260和OD280,每个标本重复检测3次,并通过OD260/OD280的比值评估标准品的纯度。
2 结果
2.1 野生型和含T315I突变的abl基因片段的获取通过PCR定点突变方法从正常人基因组中扩增而获得野生型和突变型abl基因第6号外显子片段,片段长度均为281bp,如图1A所示。
2.2 重组质粒的酶切鉴定含野生型abl基因片段的pSG5M-flag-abl(wild)和含T315I突变基因片段的pSG5M-flag-abl(T315I)经EcoRⅠ和PstⅠ双酶
切后,进行琼脂糖电泳分析,如图1B所示。酶切后的野生型和突变型重组质粒在5000bp和300bp左右的位置出现条带,与预期结果符合(理论上两质粒酶切后出现的两条带分别为4800bp和281bp)。
2.3 重组质粒测序鉴定野生型和突变型重组质粒中插入的片段仅相差一个碱基,将酶切正确的重组质粒送生工测序,判断插入的片段是否正确。结果显示:野生型pSG5M-flag-abl(wild)重组质粒中abl的DNA序列与GenBank中公布的序列一致;含T315I突变的pSG5M-flag-abl(T315I)重组质粒中abl的DNA中有一个突变位点,为C突变为T,如图2所示,其余均无突变或移码,与预期设计一致,表明质粒构建成功。
2.4 质粒标准浓度的测定采用紫外分光光度仪检测到阴性对照pSG5M-flag-abl(wild)和阳性对照pSG5M-flag-abl(T315I)标准品的浓度分别为148.3g/ml和125.7g/ml,通过计算得到质粒标准品的拷贝数浓度分别为2.97×1013copies/ml和2.51× 1013copies/ml,其OD260/OD280值分别为1.746和1.820(见表1)。
3 讨论
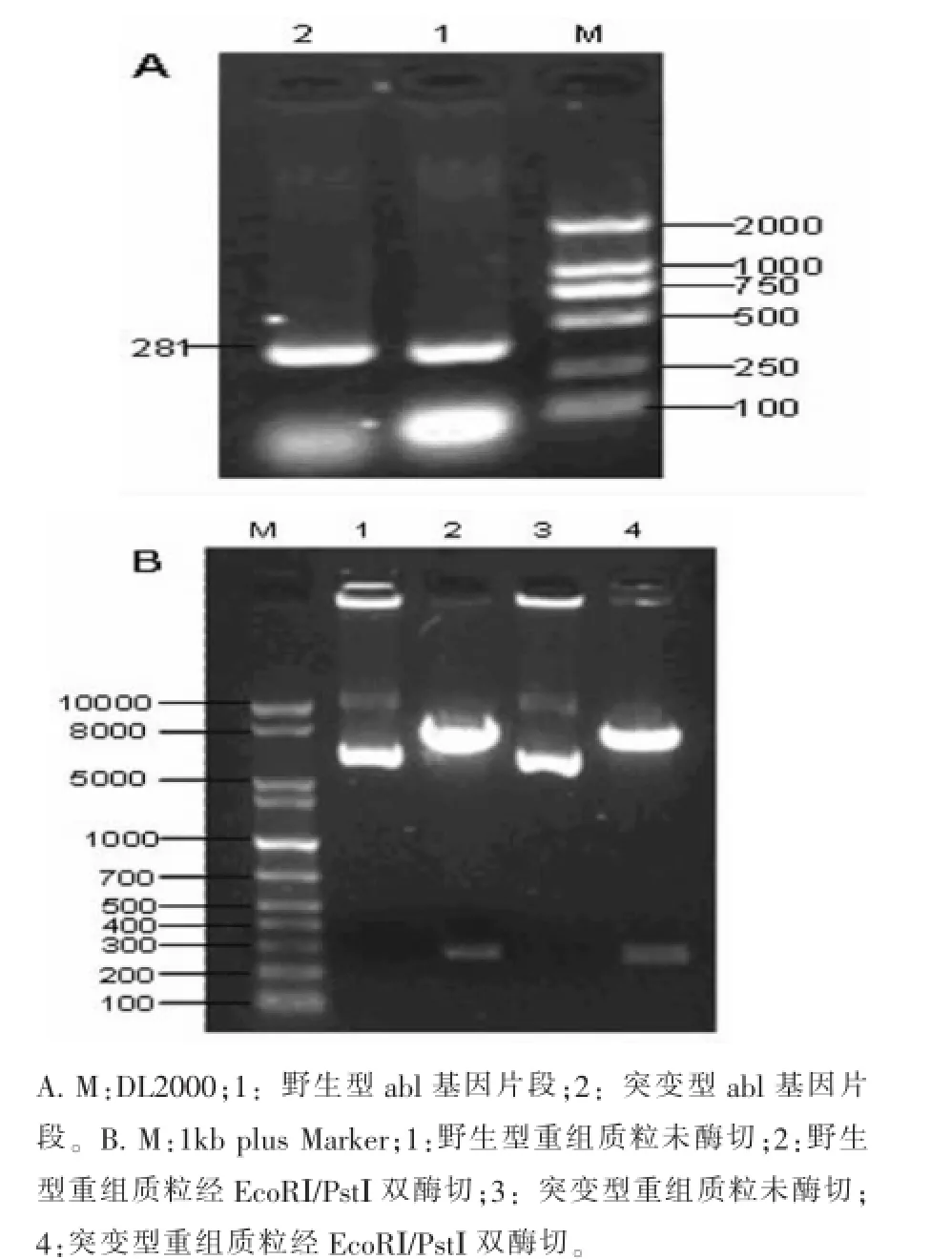
图1 目的片段PCR扩增及重组质粒酶鉴定电泳图

图2 重组质粒测序结果

表1 质粒标准品的浓度和纯度检测
abl基因位于9q34.1,基因全长170kb左右,由11个外显子组成。abl基因mRNA长5388bp,其开放式阅读框全长为3392bp。它易位到22q11的bcr区形成bcr/abl融合基因。该基因可转录出一个8.5kb的异常mRNA,最终翻译成相对分子质量为210kD的蛋白质(P210)。P210具有较强的酪氨酸蛋白激酶活性,可通过多种信号传导途径来活化癌基因和某些细胞因子,最终导致细胞的恶性转化。
临床上用于治疗CML的一线药物是甲磺酸伊马替尼(IM),它作为第一代信号传导抑制剂,能与bcr/abl融合蛋白ATP结合位点结合,竞争性结合abl酪氨酸激酶催化部位的ATP与胸苷激酶(TK)受体的结合位点,阻滞TK磷酸化,从而抑制信号传导,使酪氨酸激酶不能与ATP结合,失去催化活性。随着病程发展,几乎所有CML急变期和近15%~20%CML经IM长期治疗后复发的患者对IM产生了耐药,究其原因为bcr/abl融合基因发生了点突变,阻碍了与IM的结合。因此,对于IM耐药的CML患者,可选择第二代信号传导抑制剂达沙替尼(Dasatinib)、尼洛替尼(Nilotinib)和博舒替尼
(Bosutinib)等,但三者均对bcr/ablT315I突变型无效[3],在已发现的100多种bcr/abl点突变中[4,5],T315I突变频率约占15%左右[5]。
目前检测T315I点突变的方法很多[6-8],以ASPCR灵敏度高,特异性好,但该方法容易污染,影响结果的准确性。因此在检测中需设阳性对照和阴性对照及空白对照。本研究通过体外定点突变PCR方法构建了野生型和突变型abl重组质粒,获得的质粒标准品浓度均在1013copies/ml以上,可作为abl基因T315I突变检测的阳性和阴性对照以及质控品。
由于从患者血液内所提取的DNA中存在大量正常abl基因的干扰,此时普通PCR不能区分野生型和突变型abl基因。因此,要获得纯突变的abl基因片段较困难,需做大量的筛选工作,消耗大量的人力、物力和时间。由于PCR时引物和模板退火时相对特异,当引物3’末端3~4个碱基与模板不匹配时,在较低的退火温度时PCR也可扩增下去。本研究设计一条含39个碱基的突变型下游引物,巧妙地将目的碱基突变,使得引物3’端第8个碱基由G→A,其它碱基与abl基因完全匹配,然后以正常人外周血DNA为模板,在较低退火温度下扩增abl基因片段,这样扩增得到的片段均含有突变位点,再将其插入到载体质粒中,即可用作为检测该基因突变的阳性对照和质控品,也为abl T315I基因突变的后续研究奠定了基础。
[1]徐芬,张长林,简正伟,等.采用定点突变PCR构建c-kit D816V突变的重组质粒标准品[J].实验与检验医学,2012,30(2):123-125.
[2]Weisberg E,Manley PW,Cowan-Jacob SW,et al.Second generation inhibitors of BCR-ABL for the treatment of imatinib-resistant chronic myeloid leukaemia[J].Nat Rev Cancer,2007,7(5):.345-356.
[3]Gorre ME,Ellwood-Yen K,Chiosis G,et al.BCR-ABL point mutants isolated from patients with imatinib mesylate-resistant chronic myeloid leukemia remain sensitive to inhibitors of the BCR-ABL chaperone heat shock protein 90[J].Blood,2002,100(8):3041-3044.
[4]Velev N,Cortes J,Champlin R,et al.Stem cell transplantation for patients with chronic myeloid leukemia resistant to tyrosine kinase inhibitors with BCR-ABL kinase domain mutation T315I[J].Cancer,2010,116(15):3631-3637.
[5]Yin L,Dittman D,Chenn A.Rapid quantitative detection of the T315I mutation in patients with chronic myelogenous leukemia[J]. Diagn Mol Pathol,2012,21(1):34-39.
[6]Wongboonma W,Thongnoppakhun W,Auewarakul CU.A single-tube allele specific-polymerase chain reaction to detect T315I resistant mutation in chronic myeloid leukemia patients[J].J Hematol Oncol, 2011,4(7):1756-1763.
[7]Manrique AG,Scholl V,Perez V,et al.,Rapid and sensitive allelespecific(AS)-RT-PCR assay for detection of T315I mutation in chronic myeloid leukemia patients treated with tyrosine-kinase inhibitors[J].Clin Exp Med,2011,11(1):55-59.
Construction of plasmid standard preparations for abl T315I mutation detection by PCR-based site-directed mutagenesis in vitro
SHI Cong,ZHANG Zhanglin,JIAN Zhengwei,et al.Department of Clinical Laboratory,the First Affiliated Hospital of Nanchang University,Nanchang 330006,China
ObjectiveTo construct the recombinant plasmids containing the 6th exon fragment of wild-type abl and T315I mutant abl gene as the negative and positive control to detect T315I mutation in abl gene using the site-directed mutagenesis PCR. Methods Two pairs of primers were designed according to the gene sequence of abl,and mismatches were introduced into primers. The genomic DNA of healthy human peripheral blood serves as template.The wild type exon 6 fragment and the T315I mutant of abl were amplified by PCR.Then the PCR products were inserted into pSG5M-Flag plasmid and the recombinant plasmids were identified by enzyme digestion and DNA sequencing.The purity and concentration of plasmids were estimated by ultraviolet spectrophotometer.Results The sequencing analysis showed that the mutation site was correct.The 315th amino acid codon of abl gene mutated to Ile from Thr,indicating successful construction of mutant abl gene.Conclusion The data suggest that thePCR site-directed method has high accuracy and efficiency.Recombinant plasmids containing wild type exon 6 and the T315I mutant of abl were constructed successfully,which could serve as the negative and positive controls when we detect the T315I mutation of abl gene in further study.
Site-directed mutagenesis;abl gene;T315I;Positive control
R733.72,Q343.1+3
A
1674-1129(2013)02-0111-04
10.3969/j.issn.1674-1129.2013.02.003
江西省自然科学基金(201221AB205025)
石淙,硕士,主攻血液学诊断。
万腊根,教授,硕士生导师。

