ELISA法检测干细胞溶液中残留牛血清白蛋白含量
宛 莹,聂德志* ,贲 亮,黄若洋
(1.四平中心人民医院 中心实验室,吉林 四平 136000;2.吉林省拓华生物科技有限公司,吉林 四平 136000)
间充质干细胞(mesenchymal stem cells,MSCs)是一种来源于中胚层的具有多向分化潜能的干细胞,是造血微环境中一种重要细胞成分,目前临床实验证实间充质干细胞移植可用于组织的修复及治疗间充质组织遗传缺陷性疾病,临床应用前景广阔[1-4]。根据2013年国家《干细胞制剂质量控制及临床前研究指导原则(试行)》的规定,干细胞治疗作为一种新型的生物治疗产品,所有干细胞制剂都可遵循一个共同的研发过程,即从干细胞制剂的制备、体外试验、体内动物试验,到植入人体的临床研究及临床治疗的过程。整个过程的每一阶段,都须对所使用的干细胞制剂在细胞质量、安全性和生物学效应方面进行相关的研究和质量控制。
根据指导原则中的规定,在干细胞的采集、分离及干细胞(系)建立阶段,除进行细胞鉴别、成活率及生长活性检测以外,还应进行全面的内外源致病微生物、详细的干细胞特性检测,以及细胞纯度分析。其中细胞内外源性细胞因子的检测项中明确提到如使用过牛血清,须进行牛源特定病毒的检测包括BSA残留量检测。而目前尚无对细胞产品牛血清白蛋白残留量检测的标准化方法,主要参照2010年版《中国药典》三部附录中牛血清白蛋白残留量检测方法的规定进行,采用酶联免疫法测定供试品中残余牛血清白蛋白含量。本文采用酶联免疫法测定细胞不同清洗程序和培养基条件中BSA残留量的检测,探讨不同清洗程序对细胞产品中BSA残留量的影响,从而为建立合理有效的清洗程序和检测标准提供试验依据。
1 材料和方法
1.1 样品与试剂
用于检测的干细胞为脐带源间充质干细胞,足月剖宫产健康胎儿脐带,经产妇知情同意及医院伦理委员会批准,取自四平市中心医院妇产科,进行常规分离。选用流式细胞仪分析P5细胞检测表型[5]。BSA残留量检测使用试剂盒为无锡博生医用生物技术开发有限公司的定量检测牛血清白蛋白(BSA)酶联免疫试剂盒,批号:20120602。
1.2 试剂 α-MEM 培养 基购自美国 Thermo Fisher公司,胎牛血清购自美国Gibco公司,无血清培养基购自杭州百通生物科技有限公司。
1.3 方法 干细胞样品制备见表1。

表1 干细胞样品制备
1.4 ELISA法检测BSA残留的方法 将待测样品与BSA标准品加入包被有BSA抗体的96孔板中,37℃孵育1小时,洗板并加入酶标记抗体,室温避光孵育30 min;洗板后加入底物液并避光孵育10-15 min,加入终止液后轻轻震荡,并在450 nm单波长下读数。
1.5 统计学处理 实验重复至少3次,数据用±s表示,多组间均数差异性比较采用单因素方差分析(One-way ANOVA)。数据采用 Prism 5.0软件进行分析。
2 结果
h UMSCs自脐带中分离培养,并传至P3时形态学上显示成纤维细胞形态,细胞呈漩涡样生长。流式细胞术检测h UMSCs表达CD73,CD90和CD105;不表达 CD34,CD45,CD14,CD19,HLADR[6]。ELISA酶联检测试剂盒测定方法计算结果显示,根据标准浓度绘制标准曲线得到标准方程y=0.0240x-0.0313,R2=0.994 1,标准曲线见图1。使用常规培养基α-MEM 10% 胎牛血清中培养传至P5时,PBS清洗1次后干细胞溶液中残留BSA为117.58 ng/ml,PBS清洗3次后干细胞溶液中BSA的残留量下降为36.60 ng/ml。使用无血清培养基进行细胞培养,样品中BSA的残留量随着细胞的传代次数至P5时有明显的减少趋势,从P3时的95.12 ng/ml下降到P5时的5.96 ng/ml。同时,冻存后的细胞样品经过复苏后培养,BSA的残留为24.65 ng/ml。计算结果见表1。
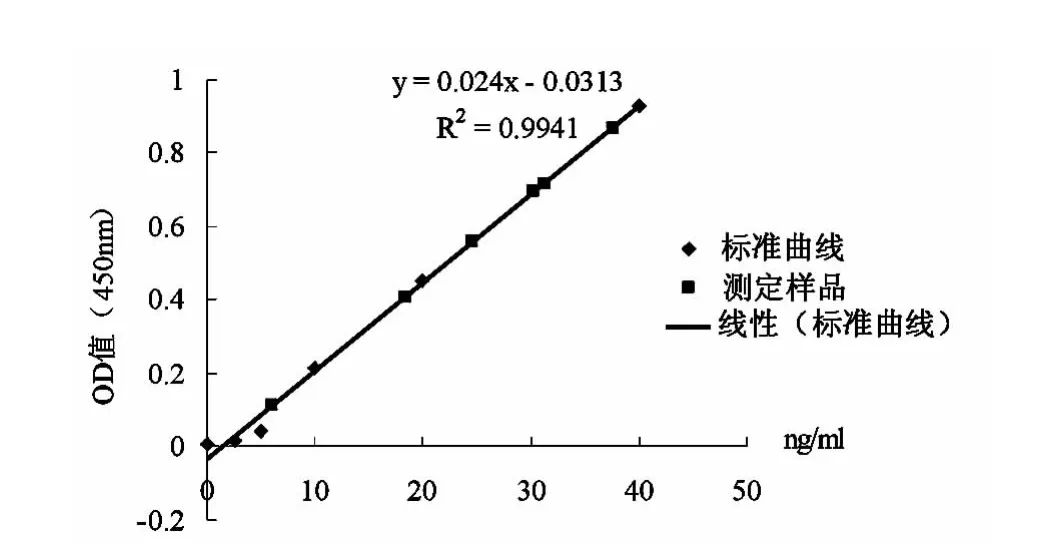
图1 根据标准浓度绘制散点图

表1 根据标准曲线计算得到的测定样品残留的BSA含量
3 讨论
牛血清是细胞培养和扩增过程中培养液的重要组分,是细胞培养中用量最大的天然培养基,也是许多生物制品保存液中的必要组分之一。在牛血清中,BSA是牛血清中的主要成分(约为35-50 mg/ml),同时也是引起过敏反应的最主要因素之一。BSA,作为异源蛋白的代表,能够引起机体的多种免疫反应[8-13]。因此,检测BSA的残留被作为国家对生物制品质量控制的重要指标。
与其他生物制品不同,细胞产品的纯化与清洁只能通过规范的清洗程序,以减低及清除对机体多种不利的影响因素,以达到国家对细胞制品的标准要求。通过本次试验证实,细胞培养至P5,PBS清洗3次后细胞中BSA残留量可达到40 ng/ml以内,而且采用无血清培养能从细胞培养的源头有效地避免BSA的残留,这对于提高细胞生物制品的生物安全性,推动干细胞生物产品走向规模化及市场化,从而有效地造福人类健康具有重要作用。
[1]Aggarwal S,Pittenger MF.Human mesenchymal stem cells modulate allogeneic immune cell responses[J].Blood,2005,105(4):1815.
[2]Erices A,Conget P,Minguell JJ.Mesenchymal progenitor cells in human umbilical cord blood[J].Br J Haematol,2000,109(1):235.
[3]Yen BL,Huang HI,Chien CC,et al.Isolation of multipotent cells from human term placenta[J].Stem Cells,2005,23(9):3.
[4]In't Anker PS,Scherjon SA,Kleijburg-van der Keur C,et al.Isolation of mesenchymal stem cells of fetal or maternal origin from human placenta[J].Stem Cells,2004,22(7):1338.
[5]野向阳,徐 岩,毕薇薇,等.人脐带源间充质干细胞体内外移植的免疫学特征[J].中国组织工程研究与临床康复,2011,15(45):8408.
[6]宛 莹,张世东,贲 亮,等.脐带源间充质干细胞(h UMSCs)对硫代乙酰胺诱导肝纤维化干预作用的研究[J].中国实验诊断学,2013,6(17):1003.
[7]刘 颖,牟忠梅,童 军,等.检测疫苗中小牛血清残存量ELISA试剂盒的研制[J].中国生物制品学杂志,2004;17(1):45.
[8]李 华,俞建昆,洪 超等.残余牛血清蛋白ELISA检测方法的建立及其初步应用[J].标记免疫分析与临床,2005,12(2):107.
[9]潘殊男,刘保奎.检测疫苗残余牛血清ELISA试剂的质量控制[J].中国生物制品学杂志,2005,18(1):54.
[10]周铁群,陈 震,强 东.应用酶免疫方法检测生物制品中残余牛血清白蛋白含量[J].中国生物制品学杂志,2004,17(3):171.
[11]马忠仁,冯玉萍,李 倬,等.动物血清在细胞培养中的重要性及其质量控制标准[J].西北民族大学学报,2003,24(50):56.
[12]曹谊林,主编.组织工程学理论与实践[M].上海:上海科学技术出版社,2004:111.
[13]杨晓芳,奚廷斐.医疗器械的免疫毒性评价[J].生物医学工程学杂志,2007,24(5):1191.

