KGF及KGFR共表达促进铁过载肝细胞增殖
安树才,张智斌
(1.青岛大学附属医院 甲状腺外科,山东 青岛 266003;2.佳木斯大学附属第一医院 普外一科,黑龙江 佳木斯 154002)
肝脏是铁代谢的主要器官,大量铁的吸收破坏了细胞内铁的平衡导致铁缺乏或铁过载。铁过载可引起肝细胞损伤导致肝细胞纤维化甚至肝硬化[1-2],并和肝脏肿瘤发生相关[3-4],在肝硬化和非肝硬化患者中铁过载可促进肝细胞癌的发生[5]。另外,丙型肝炎病毒感染患者经过长期的降铁药物治疗后,可以使肝脏功能得到明显改善[6-7]。有证据表明在感染HCV的年轻肝癌患者中铁过载和肝癌的发生有着密切的关系[8]。但是,铁过载和肝细胞增殖之间的相关性尚不清楚。正常情况下肝细胞处于较慢的一个增殖状态,但是在经过诸如部分肝切除等各种损伤后,肝细胞再生被激活[9-10],这为我们提供了实验模型来研究铁过载在肝细胞增殖中的作用。
角质细胞生长因子(keratinocyte growth facto,KGF)属于成纤维细胞生长因子家族,也叫FGF-7,来源于角质形成细胞,是对上皮细胞具强促分裂原活性的一种生长因子[11]。KGF和KGF受体(KGFR)相互结合参与细胞的增殖,而且KGFR特异性存在于上皮细胞内[12]。KGF是一个重要的增殖和分化因子,并且在上皮细胞系促进细胞的生长[13-15],包括胃肠和肝脏细胞[16-17]。KGF在体内和体外对肝细胞是一个强有力的促分裂素[16,18]。KGF 和KGFR在肝纤维化中出现共表达[19],但是在铁过载的情况下对肝细胞中的表达未见报道。本文旨在通过喂食大鼠3%羰基铁的铁过载动物模型,70%部分肝切除来探讨铁过载在肝细胞中的KGF和KGFR的表达并探讨其作用。
1 材料及方法
1.1 材料
多聚甲醛(POM)购自德国默克公司,3,3’-二氨基联苯胺-4-盐酸(DAB)购自日本Dojin化学制品公司,胎牛血清白蛋白(BSA)、正常抗小鼠Ig G和抗兔IgG购自美国Sigma公司,戊巴比妥购自日本Dainippon制药公司。辣根过氧化物酶(HRP)偶联的山羊抗小鼠IgG F(ab)’购自日本名古屋医疗生物实验室;辣根过氧化物酶(HRP)偶联的山羊抗生物素抗体购自美国加利福尼亚伯灵格姆向量实验室;辣根过氧化物酶(HRP)偶联的绵羊抗地高辛(1∶100)购自罗氏公司。KGF和KGFR抗体由日本长崎大学小路武彦教授提供。本实验应用的所有其他试剂购自日本和光纯药工业株式会社。
1.2 铁过载大鼠肝脏部分切除模型制备
健康雄性 Wistar大鼠40只,每组5只,清洁级,7-8周龄,体重200-250 g,佳木斯大学动物中心提供。随机分为正常组和实验组。正常组喂食普通食料,实验组喂食添加3%羰基铁食料。各组喂食3个月后通过腹腔注射戊巴比妥钠(40 mg/kg)进行麻醉,待麻醉满意后切开腹腔显露肝脏行70%肝脏部分切除术[20]。肝脏样本在不同的时间点(0 h,12 h,24 h,36 h)离体,在4%磷酸盐缓冲液(PBS)中4℃过夜固定、石蜡包埋。制备5-6μm厚度切片,部分用以HE染色进行组织学检测。
1.3 方法
铁在肝脏中沉积程度采用普鲁士蓝染色方法检测,方法见文献[8]。KGF和KGFR采用酶联免疫组织化学方法测定,按试剂盒说明书进行。HRP的位点在镍钴铁存在或不存在的情况下可以通过DAB和 H2O2可视化[21,22]。在实验进行中各阴性对照样本与正常兔IgG反应,而不是特异性一抗。
原位杂交方法:KGF和KGFR的探针分别为No.648-683和 No.1388-1432[23]。然后在37℃和42℃条件下杂交过夜,使用的介质中含有10 m M Tris-HCl(PH 7.4),1 m M 的乙二胺四乙酸,0.6 m M 的NaCl,1×Denhardt氏溶液,250 mg/ml酵母转移核糖核酸,125 mg/ml鲑鱼睾丸DNA,10%硫酸葡聚糖,200 U/ml的肝素,10 mg/ml多聚腺苷酸钾的盐,40%去离子甲酰胺和2 mg/ml-T二聚的KGF探针或T-T二聚KGFR探针。杂交后将切片在37℃下,在2xSSC/50% 甲酰胺/0.075%Brij 35中洗涤3次,再在37℃下,在0.5xSSC/50% 甲酰胺/0.075%Brij 35中洗涤1小时,最后在室温下,在2xSSC中洗涤15分钟。切片行酶学免疫组化处理。将切片在封闭液(封闭液中成分:PBS中加入5%BSA,0.3 m M 的 NaCl,100 mg/ml鲑鱼睾丸DNA,100 mg/ml酵母转移RNA,和500 mg/ml正常小鼠IgG)中室温条件下孵化1小时,然后切片在室温下,与1:80的HRP小鼠抗T-T-G抗体反应过夜。在PBS中用0.075%Brij 35洗涤后,用过氧化氢和DAB将HRP位点进行可视化处理。通过染色密度来评价阳性细胞,该染色密度是使用图像分析仪,通过测量正义探针染色水平来确定的。通过多种对照实验来确认特异性mRNA信号。每次实验中,正义探针都作为阴性对照。在每个实验中,用28S r RNA探针作为阳性对照,来评估组织切片中杂交RNA的水平。此外,为了提供确凿证据,用一些切片在过量未标记反义探针或正义探针中与反义探针杂交,来证明前面提到的信号序列的特异性。
1.4 数据分析 所有数据以平均数±SE表示,非配对t检验进行组间数据显著性分析。P≤0.05代表有显著性差异。所有分析均以数据分析包(Stat-View,version 5.0;Abacus Concepts,Berkeley,CA,USA)进行统计分析。
2 结果
2.1 铁沉积
正常组在各个时间均未检测到铁的沉积。实验组在0小时发现位于肝小叶中央静脉中央带的肝细胞质中表达(图1D),12 h发现在中央带的肝细胞质中表达增强(图1F),并随时间铁沉积的表达逐渐减弱(图1 H)。
2.2 KGF和KGFR蛋白的表达
KGF在正常组从12 h肝小叶中央静脉周围肝实质细胞和肝间质细胞中的细胞质中有表达,到36 h这种表达达到最强(图2 E)。实验组12 h同样检测出KGF表达,到24 h这种表达最为显著(图2 F)。KGFR的表达在正常组中0 h肝实质细胞的细胞质中出现,并随时间增加而逐渐增强,到36 h达到高峰(图3 E)。实验组0 h只检测出少量KGFR阳性细胞,到24 h达到最高随后减少(图3 F)。
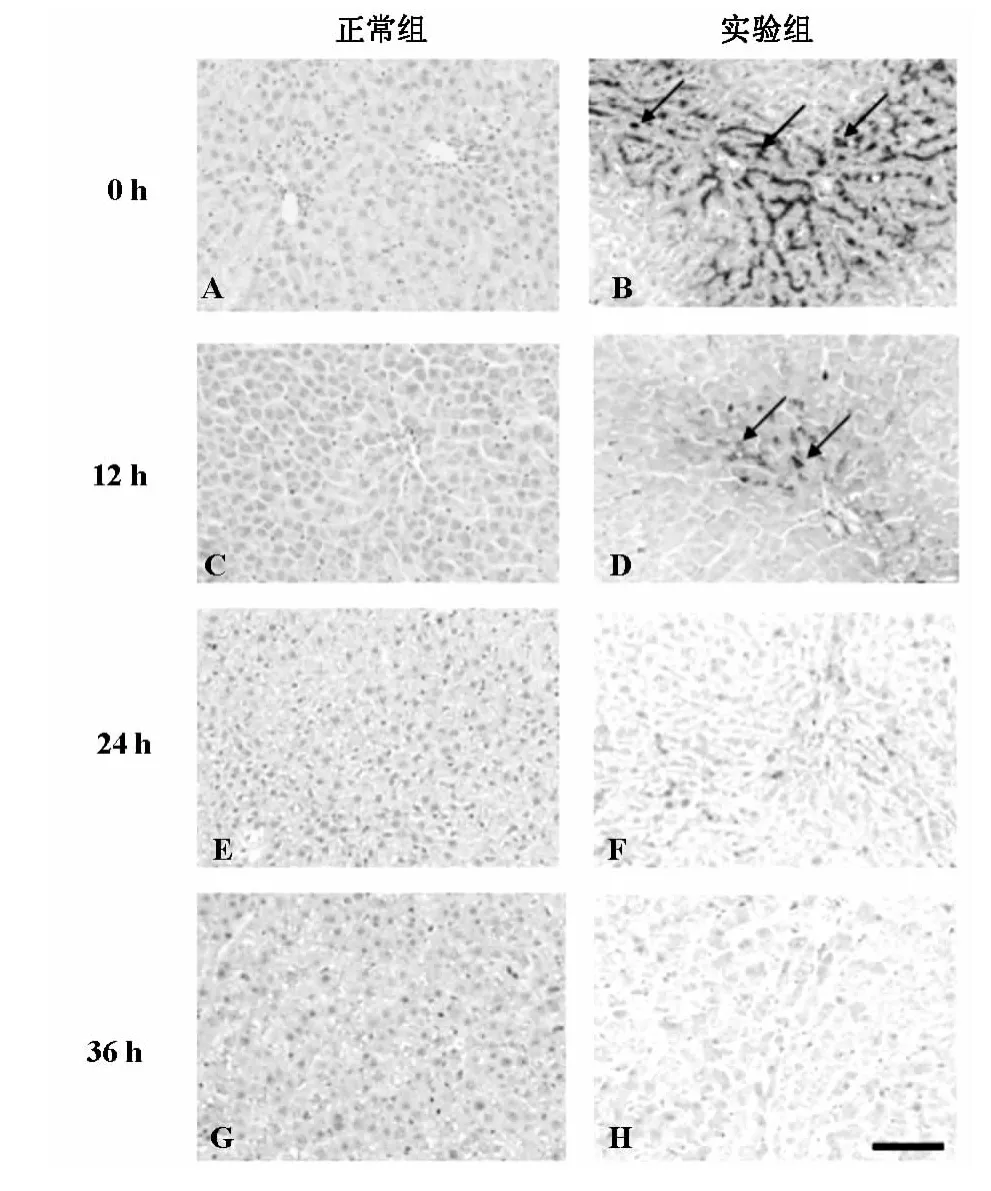
图1 各个时间段肝脏中铁沉积。正常组(A,C,E,G);实验组(B,D,F,H),黑色箭头为肝脏中铁沉积细胞。标尺:50μm。

图2 各个时间段肝脏中KGF阳性细胞。正常组(A,C,E);实验组(B,D,F),黑色箭头为肝脏中KGF阳性细胞。标尺:50μm

图3 各个时间段肝脏中KGFR阳性细胞。正常组(A,C,E);实验组(B,D,F),黑色箭头为肝脏中KGF阳性细胞。标尺:50μm。
2.3 KGF和KGFR mRNA的表达
正常组KGF mRNA在肝细胞中只有少量的表达(图4 A),在实验组中这种表达增加(图4 C)。在实验组24 h KGF mRNA的表达达到最高(图4 G),这种表达最重要是在肝实质细胞核中。同样的KGFR mRNA的表达和KGF mRNA表达是一致的(图5)。
3 讨论
肝脏中的铁沉积在肝切除术后迅速减弱,使得12-36 h肝窦部的肝细胞铁沉积明显,这与运用铁螯合剂治疗小鼠幼鼠血色素沉积症相似[24]。尽管本研究并未探讨原因,但肝细胞中的铁代谢在再生过程中是发生改变的。我们的实验证明在肝切除实验组24 h KGF和KGFR的蛋白水平和mRNA的表达同一时间到达最高,比正常组提前12 h。
血管内皮生长因子(VEGF)、红细胞生成素(erythropoietin)和基质金属蛋白酶(MMPs)对再生改善、组织重构和肝细胞复制有影响。然而,尽管VEGF被认为参与血管生长以及肝细胞增殖,但是VEGF并未被验证诱导肝再生[10]。相似的,尽管报导肝再生时红细胞生成素的合成增加,但其在肝再生中的作用尚存在争议[25]。因为肝脏细胞外基质是多种生长因子(如HGF和肝素结合生长因子等)的储存器,所以在组织重构的过程中组织基质的降解是必要的。事实上,人们已经认识到MMP-14和它的组织抑制剂(TIMP-1)在肝脏再生的早期阶段即可被特异性诱导,然而,它们在肝脏再生诱导中的作用尚未证实[26]。转化生长因子-α(TGF-α)参与肝细胞再生,但是确切的机理尚不清楚[27]。我们先前的研究证实在铁过载的情况下NF-KB参与了肝细胞增生[22]。KGF存在于间质细胞和T细胞中,并且可以在上皮细胞中表达,KGF和KGFR的特异性结合引起细胞的增殖。KGF在慢性肝病中的星状细胞中有表达[28],KGF和KGFR在肝纤维化中共表达[19],但是在铁过载的情况下对肝细胞的表达未见报道。我们的实验证明KGF和KGFR在肝细胞中蛋白和mRNA同时表达,并且在实验组24小时达到最大,比正常组提前,并且在先前的研究中已经证明在这个时段细胞数和肝脏重量有显著意义增加,证明KGF和KGFR参与肝细胞再生。KGF可以通过NF-KB的调节改变其表达[29],但是确切的作用机理还有待于进一步研究。我们推测由于严重铁沉积所维持的NF-κB激活KGF和KGFR共表达,可能绕过了肝切除后通常的肝脏再生通道顺序引起肝细胞的增生。

图4 各个时间段肝脏中KGF mRNA表达。正常组(A,C,E,G);实验组(B,D,F,H),黑色箭头为肝脏中 KGFmRNA阳性细胞。标尺:50μm。

图5 各个时间段肝脏中KGFR mRNA表达。正常组(A,C,E,G);实验组(B,D,F,H),黑色箭头为肝脏中 KGFmRNA阳性细胞。标尺:50μm。
[1]Pietrangelo A,Rocchi E,Schiaffonati L,et al.Liver gene expression during chronic dietary iron overload in rats[J].Hepatology,1990,11:798.
[2]Hentze MW,Muckenthaler MU,Andrews NC.Balancing acts:molecular control of mammalian iron metabolism[J].Cell,2004,117:285.
[3]Turlin B,Juguet F,Moirand R,et al.Increased liver iron stores in patients with hepatocellular carcinoma developed on a noncirrhotic liver[J].Hepatology,1995,22:446.
[4]Kowdley KV.Iron,hemochromatosis,and hepatocellular carcinoma[J].Gastroenterology,2004,127:S79.
[5]Di Bisceglie AM.Hepatitis C and hepatocellular carcinoma[J].Hepatology,1997,26:34S.
[6]Kato J,Kobune M,Nakamura T,et al.Normalization of elevated hepatic 8-hydroxy-20-deoxyguanosine levels in chronic hepatitis C patients by phlebotomy and low iron diet[J].Cancer Res,2001,61:8697.
[7]Yano M,Hayashi H,Yoshioka K,et al.A significant reduction in serum alanine aminotransferase levels after 3-month iron reduction therapy for chronic hepatitis C:a multicenter,prospective,randomized,controlled trial in Japan[J].J Gastroenterol,2004,39:570.
[8]Soe K,Hishikawa Y,Fukuzawa Y,et al.Possible correlation between iron deposition and enhanced proliferating activity in hepatitis C virus-positive hepatocellular carcinoma in Myanmar(Burma)[J].J Gastroenterol,2007,42:225.
[9]Fausto N,Campbell JS,Riehle KJ.Liver regeneration[J].Hepatology,2006,43:S45.
[10]Michalopoulos GK.Liver regeneration[J].J Cell Physiol,2007,213:286.
[11]Rubin JS,Osada H,Finch PW,et al.Purification and characterization of a newly identified growth factor specific for epithelial cells[J].Proc Natl Acad Sci U S A,1989,86:802.
[12]Miki T,Fleming TP,Bottaro DP,et al.Expression cDNA cloning of the KGF receptor by creation of a transforming autocrine loop[J].Science,1991,251:72.
[13]Tamaru N,Hishikawa Y,Ejima K,et al.Estrogen receptor-associated expression of keratinocyte growth factor and its possible role in the inhibition of apoptosis in human breast cancer[J].Lab Invest,2004,84:1460.
[14]Yamayoshi T,Nagayasu T,Matsumoto K,et al.Expression of keratinocyte growth factor/fibroblast growth factor-7 and its receptor in human lung cancer:correlation with tumour proliferative activity and patient prognosis[J].J Pathol,2004,204:110.
[15]Yamamoto S,Asanuma T,Takagi T,et al.The molecule role ontology:an ontology for annotation of signal transduction pathway molecules in the scientific literature[J].Comp Funct Genomics,2004;5:528.
[16]Housley RM,Morris CF,Boyle W,et al.Keratinocyte growth factor induces proliferation of hepatocytes and epithelial cells throughout the rat gastrointestinal tract[J].J Clin Invest,1994,94:1764.
[17]Bosch A,McCray PB Jr,Chang SM,et al.Proliferation Induced by Keratinocyte Growth Factor Enhances In Vivo Retroviralmediated Gene Transfer to Mouse Hepatocytes[J].J Clin Invest,1996,98:2683.
[18]Strain AJ,McGuinness G,Rubin JS,et al.Keratinocyte growth factor and fibroblast growth factor action on DNA synthesis in rat and human hepatocytes:modulation by hepar-in[J].Exp Cell Res,1994,210:253.
[19]Otte JM,Schwenger M,Brunke G,et al.Differential regulated expression of keratinocyte growth factor and its receptor in experimental and human liver fibrosis[J].Regul Pept,2007,144:82.
[20]Higgins GM,Anderson RM.Experimental pathology of theliver.1.Restoration of the liver of the white rat following partial surgical removal[J].Arch Pathol,1931,12:186.
[21]An S,Hishikawa Y,Liu J,et al.Lung injury after ischemiareperfusion of small intestine in rats involves apoptosis of type II alveolar epithelial cells mediated by TNF-alpha and activation of Bid pathway[J].Apoptosis,2007,12:1989.
[22]An S,Soe K,Akamatsu M,et al.Accelerated proliferation of hepatocytes in rats with iron overload after partial hepatectomy[J].Histochem Cell Biol,2012,138:773.
[23]Tamaru N,Hishikawa Y,Ejima K,et al.Estrogen receptor-associated expression of keratinocyte growth factor and its possible role in the inhibition of apoptosis in human breast cancer[J].Lab Invest,2004,84:1460.
[24]Nick H,Allegrini PR,Fozard L,et al.Deferasirox reduces iron overload in a murine model of juvenile hemochromatosis[J].Exp Biol Med(Maywood),2009,234:492.
[25]Bader A,Pavlica S,Deiwick A,et al.Proteomic analysis to display the effect of low doses of erythropoietin on rat liver regeneration[J].Life Sci,2011,89:827.
[26]Knittel T,Mehde M,Grundmann A,et al.Expression of matrix metalloproteinases and their inhibitors during hepatic tissue repair in the rat[J].Histochem Cell Biol,2000,113:443.
[27]Loyer P,Cariou S,Glaise D,et al.Growth factor dependence of progression through G1 and S phases of adult rat hepatocytes in vitro.Evidence of a mitogen restriction point in mid-late G1[J].J Biol Chem,1996,271:11484.
[28]Steiling H,Wüstefeld T,Bugnon P,et al.Fibroblast growth factor receptor signalling is crucial for liver homeostasis and regeneration[J].Oncogene,2003,22:4380.
[29]Li Y,Rinehart CA .Regulation of keratinocyte growth factor expression in human endometrium:implications for hormonal carcinogenesis[J].Mol Carcinog,1998,23:217.

