鱼鳞血管紧张素转化酶(ACE)抑制肽的制备工艺研究
张丰香,李清华,王 霞,周 健
(潍坊医学院公共卫生学院,山东潍坊261053)
1965年Ferreira从巴西蝮蛇(Bathrops jararaca)蛇毒里分离出被称为“缓激肽增强肽”的多肽物质,它能够增强舒缓激肽的舒张血管的作用,之后发现此肽类也能抑制血管紧张素转化酶(angiotensin-I converting enzyme,ACE)活性,从而具有降血压作用,从此开启了对ACE抑制肽的研究大门。目前已研究发现ACE抑制肽的来源有酪蛋白、大豆蛋白、胶原蛋白、鱼贝类肌肉蛋白、玉米蛋白、酒糟、大蒜等[1-6]。研究发现来源于食物蛋白的ACE抑制肽活性与肽的结构密切相关,主要分为两个方面:氨基酸的序列和肽链的大小,通常认为ACE抑制肽主要集中在相对分子质量较小(1500以下)的部份[7]。肽的氨基酸序列由来源的食物种类决定,很难通过外界条件改变。而肽链的大小或长短可以通过加工条件加以改变。目前将大分子蛋白加工成小分子多肽的方法主要有两种:一是通过化学方法(加热和酸碱处理),化学合成法可按人们的意愿合成任意活性肽,广泛用于生产高价的药理级肽,但成本高,而且副产物及残留化合物等对人体有害;二是通过体外酶水解蛋白质产生,包括直接酶解和利用微生物发酵间接酶解两类,酶法生产生物活性肽具有很多优点,即生产条件温和、安全性高、价廉且能够进行定位水解分裂得到特定的活性肽,因而目前酶法在生物活性肽生产中得到广泛应用,近几年报道的活性肽的制备方法皆为酶解法。鱼鳞是鱼加工的下脚料之一,富含胶原和羟基磷灰石,目前大多数鱼鳞并没有被充分利用,而是当作废弃物被扔掉,据估计,我国每年废气的鱼鳞达30万t[8],这不仅造成资源的巨大浪费,而且造成环境污染。为此,鱼鳞资源的开发利用备受关注。本实验拟采用酶法将鱼鳞开发成具有较高ACE抑制活性的鱼鳞多肽。
1 材料与方法
1.1 材料与仪器
鱼鳞 新鲜的草鱼鱼鳞收集于水产市场;Protease N、Proleather FG-F日本天野酶制品株式会社;中性蛋白酶 索莱宝公司;A lcalase 3.0T 丹麦诺维信(Novo)公司;木瓜蛋白酶 上海生物试剂公司;血管紧张素转化酶(ACE)、马尿酰组氨酰亮氨酸(hippuryl-L-His-Leu) 美国Sigma公司;其他试剂 均为分析纯。
Agilent 1100型安捷伦液相色谱仪 美国安捷伦;LGJ-10型冷冻干燥机 京四环科学仪器厂;812型磁力恒温搅拌器 上海曹县行无线电元件厂;pHS-2型酸度计 上海第二分析仪器厂;超级恒温水浴 上海市实验仪器厂;DFT-200型手提式中药粉碎机 浙江温岭大德中药机械有限公司。
1.2 原料及预处理
将鱼鳞清洗干净后,用10%的盐溶液浸泡24h,中间换液一次,之后用0.4mol/L的HCl脱钙90min,将预处理后的鱼鳞冷冻干燥,用手提式中药粉碎机粉碎后储藏备用。
1.3 鱼鳞粉成分分析[9]
灰分:灼烧法;粗蛋白质:凯氏定氮法,转化系数取5.55[10];总糖:苯酚-硫酸法;粗脂肪:索氏抽提法。
1.4 酶解工艺

表1 商品酶制剂的特性及酶活Table1 The specificity and activities of the commercial protease
不同商品蛋白酶对鱼鳞酶解效果的比较:称取粉碎的鱼鳞5g,放入恒温酶反应器中,加水95m L,将溶液温度和pH调到每种酶的最适值,酶的添加量为3000U/g底物,酶解过程不断搅拌,并不断加入0.5mol/L NaOH以使反应体系的pH变化维持在实验规定值范围内,用pH-stat法测定其不同时间内的水解度,水解反应终止时用沸水浴灭酶15m in(对A lcalase进行灭活时将反应体系的pH降到4.0并且保持20min)。冷却后以10000×g离心30m in,取上清液经浓缩后冷冻干燥。各种酶的特性及酶活力见表1。
酶的添加量对水解度的影响:在相同的底物浓度(5%)以及各种酶的最适反应温度和pH条件下,改变酶的添加量(2%、4%、6%、8%底物重量),酶解3h,用pH-stat法测定其水解度,其他操作同上。
确定鱼鳞最佳酶解条件:选定蛋白酶的种类后,在一定底物浓度(5%)和一定酶解时间(3h)下,以酶用量([E]/[S])、酶解温度(T)和pH 3个因素作为因变量,设计三因素三水平的二次回归方程来拟合因素和响应值之间的函数关系,因素及水平见表2,采用Box-Behnken响应面分析法优化酶解条件。响应值为鱼鳞胶原蛋白水解度(Degree of hydrolysis,DH),采用pH-stat法计算水解度[11],水解度的计算公式如下:

式中:B—碱液体积(m L or L);Nb—碱液的摩尔浓度;α—α-氨基的平均解离度;MP—底物中蛋白质总量(g或kg);htot—底物蛋白质中肽键总数(mmol/g蛋白质);对鱼胶原蛋白而言,htot=9.1(mmol/g蛋白质)(根据胶原蛋白氨基酸组成计算得到)。

表2 鱼鳞酶解工艺实验设计的因素和水平表Table2 Table of factors and levels of the experiment design for enzyme hydrolysis of fish scales
1.5 鱼鳞肽相对分子量分布的测定
仪器:Waters 600高效液相色谱仪(配2487紫外检测器和M 32工作站);色谱柱:TSKgel2000 SWXL 300mm×7.8mm;流动相:乙腈/水/三氟乙酸,45/55/0.1(V/V);检测:UV220nm;流速:0.5m L/m in;柱温:30℃。干燥后的鱼鳞酶解产物配成浓度0.5mg/m L,进样体积:20μL。
相对分子质量校正曲线所用标准品:细胞色素C(MW12500u);抑肽酶(MW6500u);杆菌酶(MW1450u);乙氨酸-乙氨酸-酪氨酸-精氨酸(MW451u);乙氨酸-乙氨酸-乙氨酸(MW189u)。相对分子质量校正曲线方程为:Log Mol W t=6.68-0.193T(T为保留时间),R2=0.9982。用GPC数据处理软件,将样品的色谱数据代入校正曲线方程中进行计算,即可得到样品肽的相对分子质量及其分布范围。用峰面积归一化法可计算不同相对分子质量肽的近似百分含量。
1.6 氨基酸组成及游离氨基酸的测定
1.6.1 氨基酸组成的测定的样品预处理 称0.2g左右脱钙后的鱼鳞胶原纤维样品于水解管中,加入6mol/L HCl,抽真空,封口,110℃水解24h。转移定容后过滤,取滤液在加NaOH的真空干燥器中蒸干,加盐酸溶解,上机测定。
1.6.2 游离氨基酸测定的样品预处理 称取约0.3g酶解产物,溶于10m L 3.5%磺基水杨酸中,定容至50m L,室温下静置2h,用滤纸过滤,吸取1m L滤液10,000r/m in离心15min,取清液上机测定。
1.6.3 采用安捷伦1100氨基酸分析仪进行测定 色谱条件:4.0mm×125mm C18柱;柱温40℃;流速1.0m L/min;检测波长338nm,262nm(Pro);流动相A:20mmol醋酸钠液,B:20mmol醋酸钠液∶甲醇∶乙腈=1∶2∶2(v/v)。
在相同的色谱条件下,与已知浓度的氨基酸标准品色谱峰面积相比较,计算出样品相应氨基酸的含量。
1.7 酶解产物ACE抑制活性的测定
ACE的活性测定采用色谱法,具体方法参照Shu Hua Xia[12]所写。ACE抑制活性计算式为:
ACE活性抑制率(%)=(空白对照的马尿酸峰值-样品的马尿酸峰值)/空白对照的马尿酸峰值×100
实验所采用的酶解样品的浓度为1.5mg/m L。
1.8 统计分析
实验结果采用平均值±标准偏差表示,使用SPSS for W indows(version 13.0)软件进行方差分析,p<0.05代表差异显著。
2 结果与讨论
2.1 经脱钙处理后鱼鳞的主要成分
鱼鳞是鱼体与外界接触的边缘组织,是鱼类真皮层胶原质经长期进化而形成的骨质衍生物,学名为鱼鳞硬蛋白,主要有羟基磷灰石Ca10(OH)2(PO4)6和胶原纤维组成[13]。因此当其中的羟基磷灰石被盐酸浸出后,其主要的成分就是蛋白质——鱼鳞胶原,约占脱钙鱼鳞的90%,其次为水分含量,约为10%,灰分含量不足1%,表明鱼鳞脱钙比较彻底,总糖含量不足1%,脂肪几乎检测不到,具体数据见表3。

表3 经脱钙冷冻干燥后鱼鳞的主要成分(%,w/w)Table3 Basic components of demineralized grass carp fish scales(%,w/w)
2.2 不同商品蛋白酶对鱼鳞酶解效果的比较
酶的专一性决定了某种蛋白酶可能只作用于某些肽键或带有某种基团的氨基酸所形成的肽键,酶的种类不同底物特异性和作用位点也就不同,这就直接决定了酶解产物的组成、结构和功能,因此从众多的蛋白酶中筛选合适的蛋白酶成为酶解法制备活性肽的关键。
蛋白酶按来源不同可分为动物蛋白酶、植物蛋白酶及微生物蛋白酶,其中微生物蛋白酶由于生产便捷、酶活高而成本低被认为是较为理想的酶源。选择待筛酶种时要考虑原料与目标产物的特性,使得到的酶解产物具有较好的得率、组成和活性,这样才能为后续的分离步骤打下良好的基础。本实验根据鱼鳞胶原的特性和目标ACE抑制肽是短肽的特点,选用了中性和碱性内切酶共5种,酶的特性见表1。除木瓜蛋白酶为植物蛋白酶外,其他均为微生物蛋白酶。
以鱼鳞胶原蛋白水解度(DH)为指标,水解度越大表明大分子蛋白被水解的越彻底,且本实验选用的蛋白酶主要是内切酶,因此,水解度加大,短肽含量也会增加。在相同的酶活与底物浓度比(3000U/g鱼鳞,底物浓度5%)以及各自最适条件下,对这五种蛋白酶酶解鱼鳞的能力进行了比较,结果见图1。从图中可看出Protase N、中性蛋白酶和A lcalase对鱼鳞的水解能力较强,这三种蛋白酶能使鱼鳞全部水解,形成透明溶液,水解度高于其他两种蛋白酶。
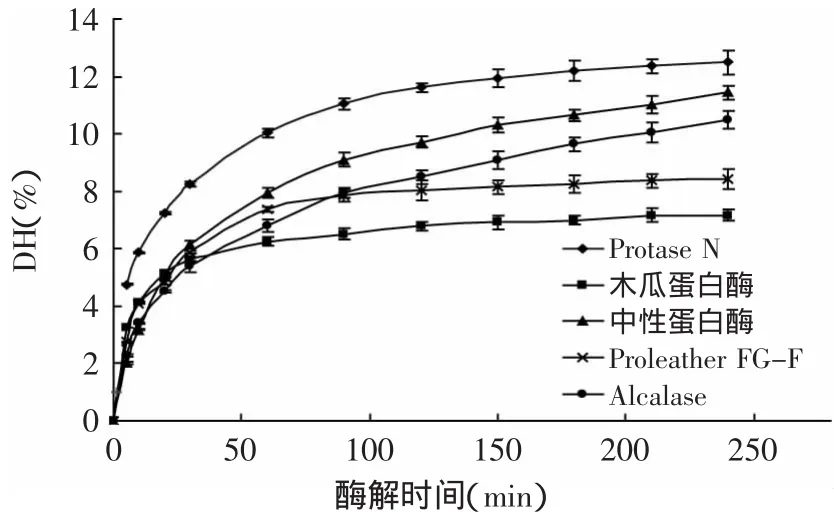
图1 不同蛋白酶酶解鱼鳞的进程曲线Fig.1 Hydrolysis curves for fish scales collagen with different proteases
2.3 酶的添加量对水解度的影响以及酶种类的选择
固定底物浓度(5%),改变Protase N、中性蛋白酶和Alcalase的加酶量,观察其在最适作用条件下对鱼鳞胶原的水解能力(酶解3h),实验结果见图2。改变A lcalase蛋白酶的添加量对水解度的影响并不显著(p>0.05),水解度维持在12%左右,这可能由于对该底物浓度A lcalase蛋白酶的添加量已过多或者Alcalase蛋白酶对鱼鳞胶原的作用位点较少。水解度随着中性蛋白酶和Protase N量的增加而增加,但当加酶量超过6%时,再增加加酶量,两者的水解度都不会有显著的增加(p>0.05),最终达到的水解度约为16%。

图2 酶的添加量对鱼鳞胶原水解度的影响Fig.2 The effects of amountof enzymes on the DH of the fish scales collagen
在相同的水解度下,由于酶的作用位点不同,水解产物会以肽和游离氨基酸两种形式存在,这两种形式都可以被人体直接吸收,但吸收方式有很大差别。肽主要通过肠道黏膜的运输方式被人体吸收,其中寡肽的吸收更为快速高效[14-15],且研究发现肽链中氨基酸残基的数目与其活性有很大关系[16-17]。但如果水解产物当中的游离氨基酸过高,其高渗透性甚至有可能造成腹泻[18]。因此对中性蛋白酶与Protase N蛋白酶的水解产物的分子量分布及游离氨基酸的含量进行了分析,见图3和表4。
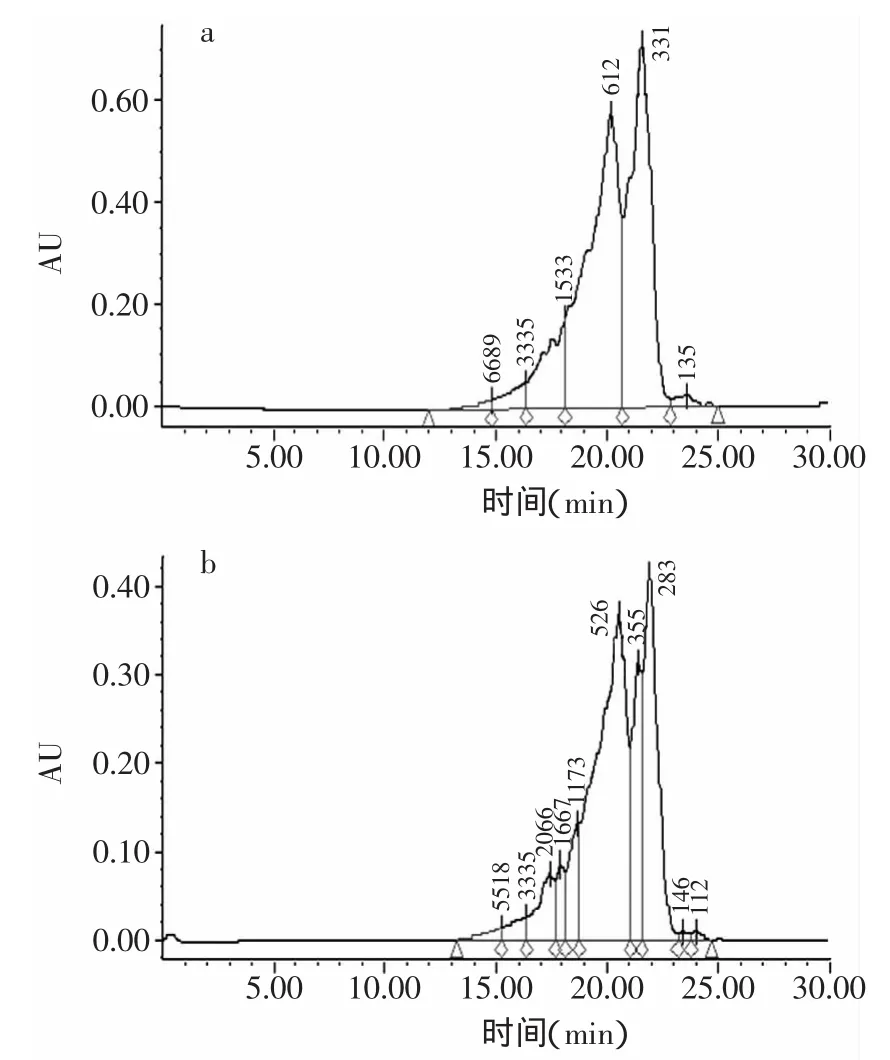
图3 Protease N酶解产物和中性蛋白酶解产物的相对分子质量分布图Fig.3 Themolecularweight distribution of Protease N and neutral protease hydrolysates

表4 酶解产物相对分子质量分布及游离氨基酸的含量Table4 Themolecularweight distribution and contentof free amino acids of hydrolysates
图3与表4为水解度为16%时中性蛋白酶与Protase N蛋白酶两种酶解产物的分子量分布及游离氨基酸的含量。从中可以得出,在相同水解度下,中性蛋白酶的酶解产物的寡肽含量高一些,游离氨基酸的含量低一些。这说明利用枯草芽孢杆菌发酵生产的中性蛋白酶对鱼鳞胶原有较好的水解能力。
为进一步确定最佳的酶种类,对这两种酶的酶解产物的ACE抑制率进行测定,结果见表5。从表5中可知,在相同水解度下,相同浓度的(1.5mg/m L)中性蛋白酶酶解产物的ACE抑制活性显著高于Protease N的酶解产物(p<0.01),这可能是酶对底物的特异性及作用位点的差异所导致的。且随着水解度的增加两种酶解产物的ACE抑制活性也随之显著增加(p<0.01),通常认为具有ACE抑制活性肽其相对分子质量较小,而这一结果也与表4的结果相吻合。

表5 不同水解度下酶解产物的ACE抑制率(%)Table5 The ACE inhibitor activities of hydrolysates on different DH(%)
2.4 酶解条件的优化
通过以上实验结果,选择来源于枯草芽孢杆菌的中性蛋白酶水解鱼鳞制备ACE抑制活性肽。又因为实验结果显示中性蛋白酶水解产物的水解度越高,ACE抑制活性也越高,且短肽含量越高,游离氨基酸含量越少,因此优化实验以鱼鳞的水解度为指标,利用Box-Behnken响应面分析法来确定最佳的酶解工艺条件,使其水解度达到最大值。

表6 响应面实验设计及结果Table6 Response surfacemethodology design and experimental results
影响酶解过程的主要因素有pH、温度、加酶量([E]/[S])、底物浓度([S])及酶解时间等。实验发现过高的底物浓度会产生抑制作用,因此选择底物浓度为5%。从不同蛋白酶酶解鱼鳞的进程曲线可以看出当酶解时间超过3h,水解度几乎不再发生变化,因此确定酶解时间为3h,可避免过长的反应时间造成过多的游离氨基酸地产生和能源地消耗。以pH、酶解温度(T)和酶用量([E]/[S])3个因素作为因变量,以水解度作为响应值,设计三因素三水平的二次回归方程来拟合因素和响应值之间的函数关系,采用响应面分析法确定最佳的酶解条件。温度(T)、pH和加酶量([E]/[S])三个因素的响应面实验设计及实验结果见表6。

表7 响应值水解度(DH)回归模型的方差分析Table7 Analysis of variance for regressmodels of response DH
2.5 回归分析
对表6中的实验结果采用Design-Expert®6软件(美国Stat-Ease公司软件)进行回归分析。响应值水解度(DH)Y的回归方程模型方差分析见表7。结果表明,响应面的二次方程回归模型F检验呈高度显著(p<0.001),相关系数达到0.9931,并且失拟项F检验不显著,实验的误差小,表明二次回归方程模型适用于酶解鱼鳞制备ACE抑制肽的实验条件的理论分析预测。回归方程中的各项系数及F检验值见表8,从表8可见,温度、pH和加酶量([E]/[S])的一次项和二次项的F检验均呈显著性,而交互项对响应值的影响不显著,说明响应值的变化相当复杂,各个具体因素对响应值的影响不是简单的线性关系,而是存在二次关系,Y的回归方程为:Y=18.96-1.07X1+2.74X2+0.68X3-4.70X-5.51X-2.62X-0.02X1X2+0.35X1X3+0.087X2X3。

表8 回归系数极其显著性检验Table8 Regression coefficients and its significant levels
图4为各影响因素在实验范围内对响应值的响应面图和等值线图,由图4可以直观的看出pH、温度和加酶量对水解度的影响。随着pH的增大,DH值先增加后下降,说明在实验范围内存在酶水解的最佳pH,低于或高于该值,酶的活力都受到影响。低的pH有利于提高酶解反应速率;随着温度的提高,DH值增大,当温度超过50℃后,DH值则略有下降,这主要是因为过高的反应温度引起酶的失活;加大酶的用量DH值也随之明显提高,但受温度和pH的影响,水解度也呈现先增后降的趋势。因此在所选的因素水平范围内,存在最佳的酶解条件使水解度达到最大。

图4 酶解时间、酶解温度和加酶量对水解度的响应面图Fig.4 Effects of hydrolysis time,hydrolysis temperature and amountof enzyme on DH
2.6 最优酶解条件的确定及其验证
从因素检验可以看出,pH对水解度的影响最大(p<0.0001),温度的影响次之,酶浓度的影响在本实验范围内最小。此外实验中还发现虽然加大加酶量能提高水解度,但在加酶量5%(w/w)以上时水解度增加的并不显著,考虑到经济因素,在加酶量5%(w/w)情况下从回归方程计算出最佳酶解条件为:温度50℃,加酶量5%,pH为6.4,水解度值为18.96。在最优条件(即:pH 6.4,温度50℃,加酶量([E]/[S])5%,鱼鳞浓度[S]5%,水解3h)下,由验证实验所得的水解度为19.26%±0.28%(n=3),与回归方程的拟合结果十分接近。
2.7 酶解产物的分子量分布与氨基酸分析
在最佳酶解条件下采用中性蛋白酶解鱼鳞制备鱼鳞ACE抑制肽,并对酶解产物进行了氨基酸组成分析以及相对分子质量分布测定。
酶解产物的氨基酸组成见表9,鱼鳞ACE抑制肽富含脯氨酸、甘氨酸,这与鱼鳞胶原三股螺旋区为连续的Gly-X-Y重复序列相对应的,其中X、Y是除甘氨酸外的其他氨基酸残基,X为脯氨酸,Y为羟脯氨酸或羟赖氨酸[19]。此外还含有较多的丙氨酸,缺乏色氨酸,为典型动物胶原的氨基酸组成,其疏水性氨基酸约占总氨基酸的28%。

表9 鱼鳞酶解产物的氨基酸组成(残基数/1000个)Table9 Amino acid composition of fish scale hydrolysate(residues/1000)
酶解产物的相对分子质量分布见图5。相对分子质量分布测定结果表明酶解产物由多种不同相对分子质量的组分组成。其相对分子质量主要分布在80~800之间,约占80%;相对分子质量大于1300的组分比例约为8.5%;相对分子质量在800~1300的组分比例约为11.8%。由相对分子质量分布可见酶解产物中含2~6个氨基酸的寡肽比例较高。

图5 鱼鳞胶原蛋白酶解产物的相对分子质量分布图Fig.5 Themolecularweightdistribution of fish scale hydrolysate
3 结论
本文从五种蛋白酶中选取来源于枯草芽孢杆菌的中性蛋白酶酶解鱼鳞制备具有较高ACE抑制活性的多肽。并采用Box-Behnken响应面分析法确定其最佳的酶解工艺为:pH 6.4,温度50℃,加酶量([E]/[S])5%,鱼鳞浓度[S]5%,水解3h,水解度为19.26%。对最佳工艺条件下的酶解产物进行分析发现其富含脯氨酸和甘氨酸,其次是丙氨酸,缺乏色氨酸,疏水性氨基酸约占总氨基酸的28%。相对分子质量主要分布在80~800之间,约为2~6个氨基酸的寡肽。
[1]Byun H G,Kim SK.Structure and activity of angiotensinI-converting enzyme inhibitory peptides derived from Alaskan Pollack skin[J].Journal of Biochemistry and Molecular Biology,2002,35:239-243.
[2]H Gül Akıllıoglu Sibel Karakaya.Effects of heat treatment and in vitro digestion on the Angiotensin converting enzyme inhibitory activity of some legume species[J].Eur Food Res Technol,2009,229:915-921.
[3]Qing Kong,Feng Chen,Xi Wang,et al.Optimization of conditions for enzymatic production of ACE inhibitor peptides from collagen[J].Food and Bioprocess Technology,2011,4(7):1205-1211.
[4]Srinivas S,Prakash V.Bioactive peptides from bovinemilk a-casein:Isolation,characterization andmultifunctional properties [J].Int JPept Res Ther,2010,16:7-15.
[5]Zhen Wu,Daodong Pan,Xiaoqun Zhen,et al.Angiotensin I-converting enzyme inhibitory peptides derived from bovine casein and identified by MALDI-TOF-MS/MS[J].Journal of the Science of Food and Agriculture,2013,93(6):1331-1337.
[6]Nicholas Parris,Robert A Moreau,David B Johnston,et al.Angiotensin I converting enzyme-inhibitory peptides from commercial wet-and dry-milled corn germ[J].Journal of Agricultural and Food Chemistry,2008,56(8):2620-2623.
[7]Cheung H S,Wang F L,OndettiM A,etal.Binding of peptide substrates and inhibition of angiontensin-converting enzyme:importance of the COOH-terminal dipeptides sequence[J].JBiol Chem,1980,255:401-407.
[8]罗红宇.海鱼鱼鳞营养成分的分析[J].食品研究与开发,2003,24(3):63-66.
[9]无锡轻工业学院,天津轻工业学院合编.食品分析[M].北京:中国轻工业出版社,1985:1-100.
[10]PeterHarris.Food Gel[M].London:Elsevier Applied Science,2001:250.
[11]Nissen J A.Enzymatic hydrolysis of food proteins[M].London:Elsevir Applied Science Publishers,1986:132.
[12]Shu Hua Xia,Zhang Wang,Shi Ying Xu.Characteristics of Bellamya purificata snail foot protein and enzymatic hydrolysates [J].Food Chemistry,2007,101:1188-1196.
[13]Ikoma T,Kobayashi H,Tanaka J,et al.Microstructure,mechanical,and biomimetic properties of fishscales from Pagrus major[J].JStruct Biol,2003,142:327-333.
[14]Matthews,DM.Intestinal absorption[J].Phys Rev,1975,55:537-608.
[15]Silk D B A,Faairglough D,Clark ML,et al.Use of peptide rather than amino acid nitrogen source in chemically defined‘Elemental’diets[J].JParent Enter Nutr,1980,4:548-553.
[16]Silk DB A,Grimble G K,Rees R G.Protein digestion and amino acid and peptide absorption[J].Proceed Nutr Soc,1985,44:63-72.
[17]Webb Jnr K E.Intestinal absorption of proteins hydrolysisproducts:a review[J].JAnim Sci,1990,68:3011-3022.
[18]Mahmoud M I.Physicochemical and functional properties of protein hydrolysates in nutritional products[J].Food Tech,1994,48:89-95.
[19]Chan VC,Ramshaw JAM,Kirkpatrick A,et al.Positional preferences of ionizable residues in Gly-X-Y triplets of the collagen triple-helix[J].JBiol Chem,1997,272:31441-31446.

