过氧化损伤及抗氧化能力时间动态变化与造血干/祖细胞衰老的相关性
耿 珊 张 琛 徐春燕 姜 蓉 王 璐 王建伟 王亚平
(重庆医科大学干细胞与组织工程研究室组织胚胎学教研室,重庆 400016)
过氧化损伤及抗氧化能力时间动态变化与造血干/祖细胞衰老的相关性
耿 珊 张 琛 徐春燕 姜 蓉 王 璐 王建伟 王亚平
(重庆医科大学干细胞与组织工程研究室组织胚胎学教研室,重庆 400016)
目的探讨增龄过程中小鼠Sca-1+造血干/祖细胞(Sca-1+HSC/HPC)过氧化损伤及抗氧化能力的动态变化与其衰老的关系。方法
C57BL/6J雄性小鼠分为幼年组(3~4周龄),青年组(2月龄),中年组(6月龄),中老年组(12月龄),老年组(18月龄)。提取各组小鼠骨髓单个核细胞,免疫磁性吸附细胞分选法(MACS)分离纯化Sca-1+细胞群,WST法检测细胞超氧化物歧化酶(SOD)含量,TNB显色法检测细胞总谷胱甘肽(GSSG+GSH)含量,WST-1法检测超氧化物含量,硫代巴比妥酸法检测丙二醛(MDA)含量,衰老相关β-半乳糖苷酶(SA-β-gal)染色观察各年龄组阳性细胞百分比,造血祖细胞混合集落培养比较各年龄组Sca-1+细胞形成集落能力。结果总SOD活力值、GSSG+GSH含量、超氧化物含量吸光度、MDA含量、SA-β-Gal阳性细胞百分比及混合集落形成率分别在幼年组为(27.51±1.11)U/g、(28.78±0.77)μmol/L、(0.114±0.005)、(2.06±0.54)nmol/mg、(2.26±0.65)%、(8.79±0.56);青年组为(38.23±3.50)U/g、(31.48 ±2.03)μmol/L、(0.109±0.005)、(0.81 ±0.35)nmol/mg、(9.08±2.74)%、(9.48±0.74);中年组为(28.85±0.65)U/g、(47.62±4.93)μmol/L、(0.133±0.002)、(2.69±0.62)nmol/mg、(11.58±0.89)%、(5.14 ±0.89);中老年组(12.67±0.89)U/g、(25.63±1.23)μmol/L、(0.151±0.009)、(11.44±1.19)nmol/mg、(35.34±2.50)%、(1.56±0.23);老年组为(17.52±1.27)U/g、(39.10±2.19)μmol/L、(0.141±0.005)、(7.06±0.95)nmol/mg、(15.76±1.23)%、(0.98±0.50)。结论随年龄增加Sca-1+HSC/HPC的SA-β-Gal阳性细胞百分比逐渐增高,混合集落形成能力下降,SOD活性、GSSG+GSH含量逐步降低,而超氧化物、MDA含量逐渐增加,提示在增龄过程Sca-1+HSC/HPC过氧化损伤,抗氧化能力逐渐降低是造血干细胞衰老的可能机制之一。
Sca-1+造血干/祖细胞;超氧化物歧化酶;谷胱甘肽;超氧化物;丙二醛
氧化损伤理论被认为是细胞衰老的重要机制之一,该理论认为机体内具有完善产生和清除氧自由基的平衡体系〔1〕。由于细胞生存环境中超氧化物歧化酶(SOD)和谷胱甘肽(GSH)等机体抗氧化酶的活性不断下降,使得细胞内氧自由基蓄积,细胞逐渐受到损失并最终发生衰老〔2〕。造血干细胞具有高度的自我更新、多向分化、跨系分化与重建长期造血的潜能,尽管在机体衰老在过程中造血系统的基本成分得以维持,但造血干细胞的数量和功能逐渐降低〔3〕。本研究采用免疫磁性吸附细胞分选法分离纯化不同年龄小鼠的Sca-1+造血干/祖细胞(Sca-1+HSC/HPC),研究氧化损伤与抗损伤因素在造血干细胞自然衰老中的作用,为阐述在增龄过程中HSC/HPC衰老机制提供理论与实验室依据。
1 材料与方法
1.1 实验动物与分组 雄性C57BL/6小鼠,重庆市医学实验动物中心提供〔动物合格证号:SCXK(渝)2007-0001〕。小鼠分为幼年组(3~4周龄,质量13~16 g),青年组(2月龄,质量20~25 g),中年组(6月龄,质量35~40 g),中老年组(12月龄,质量39~43 g),老年组(18月龄,质量37~45 g)。
1.2 主要药品与试剂 抗Sca-1+微珠试剂盒(No.130-092-529),MiniMACS磁珠分选系统,MS磁珠分离柱,缓冲液(德国Miltenyi Biotech公司);总谷胱甘肽检测试剂盒(S0052),BCA蛋白浓度测定试剂盒(增强型P0010S),超氧化物检测试剂盒(S0060),总SOD活性检测试剂盒(WST法S0102),脂质氧化(MDA)检测试剂盒(S0131),Western及 IP细胞裂解液(P0013),细胞衰老β-半乳糖苷酶染色试剂盒(C0602),小鼠干细胞集落形成实验专用混合培养基(美国Stem cell公司),红细胞裂解液(碧云天生物技术有限公司)。
1.3 免疫磁珠分离纯化Sca-1+造血干/祖细胞〔4〕颈椎脱臼处死各年龄组小鼠,取胫骨和股骨,分离提取骨髓单个核细胞。按本课题组方法,采用免疫磁性细胞分选系统(MACS)分离、纯化Sca-1+造血干/祖细胞(Sca-1+HSC/HPC),并进行细胞活性和纯度鉴定。
1.4 WST法检测各组Sca-1+细胞总SOD活性 收集分选的各年龄组 Sca-1+细胞(每组1×106个),PBS洗涤 2次,加Western及IP细胞裂解液充分裂解细胞,离心5 min。取上清,BCA蛋白浓度测定试剂盒测定蛋白浓度,按照总SOD活性检测试剂盒说明加样,450 nm波长测定吸光度,根据说明书计算出各年龄组的Sca-1+HSC/HPC每克蛋白SOD酶活力单位。
1.5 TNB显色法检测各组Sca-1+细胞总谷胱甘肽含量 收集分选的各年龄组Sca-1+细胞(每组1×106个),PBS洗涤细胞1次,离心收集细胞,吸尽上清。按照总谷胱甘肽检测试剂盒操作,获得样品在412波长测定吸光度值。根据不同浓度标准品测得的不同吸光度作出标准曲线,根据标准曲线计算出各组总谷胱甘肽的含量。
1.6 WST-1法检测各组Sca-1+细胞超氧化物含量 按超氧化物检测试剂盒说明书配制检测工作液。收集分选的各年龄组Sca-1+细胞(每组5×104个/m l),PBS洗涤1次,在96孔板中每孔加入200μl检测工作液悬浮的细胞37℃孵育3 min,Biorad 550酶标仪(美国伯乐公司)在450 nm测定吸光度。
1.7 硫代巴比妥酸(TBA)法检测各组Sca-1+细胞MDA含量收集分选的各年龄组Sca-1+细胞(每组1×106个),按脂质氧化(MDA)检测试剂盒说明书配制检测工作液,取细胞样品加入到96孔板中,在532 nm测定吸光度。根据标准曲线计算获得MDA的摩尔浓度,计算出样品溶液中的MDA含量,通过单位重量的蛋白含量来表示最初样品中的MDA含量。
1.8 衰老相关β-半乳糖苷酶(SA-β-gal)染色 分别收集各年龄组Sca-1+HSC/HPC各1×105个,按照SA-β-gal Staining Kit试剂盒方法对各组Sca-1+HSC/HPC进行染色。染色阳性细胞呈蓝色,倒置相差显微镜下观察200个细胞,计数阳性细胞百分率。
1.9 各年龄组Sca-1+细胞形成造血祖细胞集落能力比较 分别取各年龄组Sca-1+细胞各4×104个细胞,加入1 ml混合集落专用培养基,混匀后分别加入24孔细胞培养板0.5 m l/孔,每天用倒置相差显微镜观察细胞形态并拍照,培养7 d时计数各组混合集落数。
1.10 统计学分析 采用SPSS17.0软件分析,数据以±s表示,描绘各年龄组小鼠Sca-1+HSC/HPC的SOD、总谷胱甘肽、超氧化物及MDA含量变化曲线,方差分析比较不同年龄组各指标差异,相关分析比较各检测指标与年龄变化有无相关性。
2 结果
2.1 MACS分选前后Sca-1+细胞纯度比较 MACS分选前Sca-1+细胞百分比为(1.02±0.19)%;MACS分离纯化后Sca-1+细胞纯度可达(93.66±0.83)%。各年龄组分选前后Sca-1+细胞纯度百分比无统计学差别(P>0.05)(表1)。
表1 各年龄组分选前后Sca-1+细胞纯度百分比(%,±s)
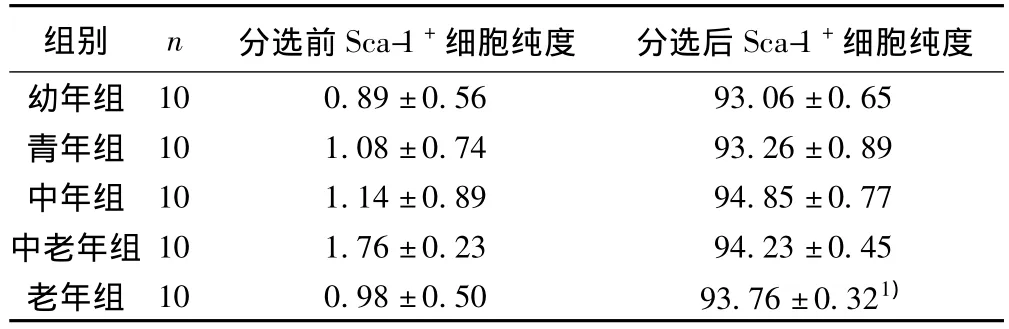
表1 各年龄组分选前后Sca-1+细胞纯度百分比(%,±s)
组别 n 分选前Sca-1+细胞纯度 分选后Sca-1+10 0.89±0.56 93.06±0.65青年组 10 1.08±0.74 93.26±0.89中年组 10 1.14±0.89 94.85±0.77中老年组 10 1.76±0.23 94.23±0.45老年组 10 0.98±0.50 93.76±0.321)细胞纯度幼年组
2.2 各年龄组Sca-1+细胞内总SOD活性 幼年组、青年组、中年组、中老年组和老年组各组样品总SOD活力值分别为(27.51±1.11)、(38.23 ±3.50)、(28.85 ±0.65)、(17.52 ±1.27)、(12.67±0.89)U/g。总SOD活性与月龄变化有明显相关关系(r2=0.881 9,P <0.01)。
2.3 各年龄组Sca-1+细胞内总谷胱甘肽含量 幼年组、青年组、中年组、中老年组和老年组各组总谷胱甘肽的含量分别为(28.78±0.77)、(31.48 ±2.03)、(47.62 ±4.93)、(39.10 ±2.19)、(25.63±1.23)μmol/L。GSH含量变化与月龄变化有明显相关关系(r2=0.875 4,P<0.01)。
2.4 各年龄组Sca-1+细胞内细胞超氧化物含量 幼年组、青年组、中年组、中老年组和老年组各组测得吸光度分别为(0.114±0.005)、(0.109±0.005)、(0.133±0.002)、(0.141 ±0.005)、(0.151±0.009)。超氧化物含量反映的吸光度变化与月龄变化有明显相关关系(r2=0.946 4,P<0.05)。
2.5 各年龄组Sca-1+细胞内MDA含量 幼年组、青年组、中年组、中老年组和老年组测得各组Sca-1+细胞MDA含量分别为(2.06±0.54)、(0.81±0.35)、(2.69±0.62)、(7.06±0.95)、(11.44±1.19)nmol/mg。MDA含量含量变化与月龄变化有明显正相关关系(r2=0.955 2,P<0.01)。
2.6 各年龄组Sca-1+细胞SA-β-Gal阳性细胞百分比 SA-β-半乳糖苷酶染色显示阳性细胞着蓝色,胞浆内可见蓝色颗粒;阴性细胞未着色。幼年组、青年组、中年组、中老年组和老年组的阳性细胞数逐渐升高,分别为(2.26±0.65)%、(9.08±2.74)%、(11.58±0.89)%、(15.76±1.23)%、(35.34±2.50),各年龄组之间比较差异有统计学意义(P<0.05)。
2.7 各年龄组Sca-1+细胞形成造血祖细胞集落能力比较 通过观察得知幼年组、青年组、中年组、中老年组和老年组的Sca-1+细胞形成的造血祖细胞集落数量降低,集落中细胞数也逐渐减少,分别为(8.79±0.56)、(9.48±0.74)、(5.14±0.89)、(1.56±0.23)、(0.98±0.50)个/104,各年龄组之间比较差异有统计学意义(P<0.05)。
3 讨论
理论上认为3~4周龄小鼠各器官发育水平相当于人类1~2岁即幼年水平,2月龄小鼠相当于15~20岁即青壮年水平,6月龄小鼠相当于40~50岁即中年水平,12月龄小鼠相当于60岁左右即中老年水平,18月龄小鼠相当于70岁以上即进入老年水平。
造血干细胞损伤衰老后,其自我更新和多向分化的能力下降,表现为造血干细胞数量减低,增殖分化形成造血祖细胞的能力下降,后者进一步分化形成各系成熟血细胞功能衰退,表现为外周血全血细胞下降,骨髓明显收抑制,发生再生障碍性贫血。研究证明,造血干细胞衰老与老年性白血病有密切联系,随年龄增长,老年人急性髓性白血病(AML)逐年增高〔5〕。
SOD能催化超氧化物阴离子发生歧化作用,生成过氧化氢(H2O2)和氧气(O2),是生物体内一种重要的抗氧化酶。SOD活性通常有种属、性别及组织特异性,不同动物的不同器官随年龄增长,SOD活性各不同〔6〕。本研究发现随年龄增长造血干细胞中的SOD呈下降趋势,整个生命中总体变化趋势,自出生至青年达到高峰,之后出现缓慢降低,其趋势与造血干细胞形成发展及衰老趋势相一致,表明中年起造血干细胞抗氧化能力急剧下降与其衰老相关。
还原型谷胱甘肽是绝大多数活细胞中巯基的主要来源,对于维护蛋白巯基适当的氧化还原状态有重要作用,并且是动物细胞中关键的抗氧化剂。本研究发现随年龄增长总谷胱甘肽呈下降趋势,整个生命中总体变化趋势,自出生至中年达到高峰,之后出现缓慢降低,其下降趋势与造血干细胞形成及发展趋势相一致,再次表明中老年起始造血干细胞抗氧化能力急剧下降与其衰老相关。
超氧化物通常指超氧化物阴离子O2-,是一种氧分子的自由基。在呼吸链中,NADPH氧化酶把电子传递给氧分子的时候,就会产生超氧化物阴离子O2-。超氧化物阴离子O2-是一种强氧化剂,可以由被刺激的白细胞等产生,从而抵御微生物的感染等。超氧化物阴离子O2-也可以导致氧化损伤,和许多疾病的发生密切相关。本研究发现随年龄增长超氧化物呈上升趋势,整个生命中总体变化趋势,自出生至青年达到最低,可能是由于这一时期抗氧化能力比较强,之后出现缓慢增长,其趋势表明中年起造血干细胞过氧化损伤急剧增高与其衰老相关。
MDA是自由基攻击生物膜中多不饱和脂肪酸引发脂质过氧化作用所形成的脂质过氧化物。MDA的量可反映机体内脂质过氧化的程度,间接反映细胞损伤的程度。脂质过氧化产物又可进一步引起细胞损伤,主要因素有:①膜脂改变导致膜功能障碍和膜酶的损伤;②活性氧造成脂质过氧化过程中产生的活性产物对酶和其他细胞成分的损伤〔7〕。本次实验观察到小鼠造血干细胞MDA含量自出生后1~2个月处于低水平,2~6个月基本稳定,自6个月开始急剧上升,表明造血干细胞脂质氧化损伤婴幼儿、少年、青中年程度大致相当,自中年起始氧化损伤进行性急剧加重。
绝大多数正常细胞被认为仅有有限的分裂能力,在不能分裂后就进入衰老状态。此时细胞仍然是存活的,但细胞的基因和蛋白的表达谱发生了很大改变。衰老细胞细胞通常体积变大,表达pH 6.0时有高酶活性的β-半乳糖苷酶。本次实验观察到随年龄增长小鼠造血干细胞β-半乳糖苷酶活性逐渐增高,集落形成能力逐渐降低,说明造血干细胞逐渐出现衰老且功能逐渐出现下降。
综合分析上述4项指标变化趋势可以推测,随着年龄增长,造血干细胞在长期紫外线照射、维生素缺乏、微量元素代谢紊乱、内分泌影响、离子辐射等危险因素作用下,自中年起始抗氧化能力急剧下降,导致氧化及抗氧化平衡关系被打破,造血干细胞氧化损伤开始急剧加重,这可能是导致造血干细胞出现衰老,导致老年性白血病和再生障碍性贫血的发病率增高。
1 王亚平.造血干细胞生物学及其研究方法〔M〕.北京:科学出版社,2007:322-6.
2 Zhou Y,Yang B,Yao X,etal.Establishmentofan agingmodel of Sca-1+hematopoietic stem cell and studies on its relative biologicalmechanisms〔J〕.In Vitro Cell Dev Biol Animal,2010;47(2):149-53.
3 Lagasse E.Purified hematopoietic stem cells can differentiate to hepatocytes in vivo〔J〕.Nature Med,2000;6(11):1229-34.
4 耿 珊,张 琛,刘 俊,等.免疫磁性活化细胞分选方法优化及纯化后细胞的生物学特性检测〔J〕.细胞与分子免疫学杂志,2012;28(7):393-4.
5 王亚平.干细胞衰老与疾病〔M〕.北京:科学出版社,2009:13-4.
6 Warner HR.Superoxide dismutase,aging and degenerative disease〔J〕.Free R ad ic Biol Med,1994;17(3):249-58.
7 Yan Lu,ZHao Ke-Hao,Li L,etal.Lipid peroxidation and antioxidation in lens of aging rats〔J〕.Rec Adv Ophthalmol,2008;28(4):241-4.
The dynam ic changes of peroxidation and antioxidation in hematopoietic stem/progenitor cells aging
GENG Shan,ZHANG Chen,XU Chun-Yan,et al.
Laboratory of Stem Cells and Tissue Engineering,Department of Histology and Embryology,Chongqing M edical University,Chongqing 400016,China
ObjectiveTo investigate the dynamic changes of peroxidation and antioxidation in Sca-1+hemopoietic stem/progenitor cells of agingmice.MethodsSixty C57BL/6Jmice were divided into 3 ~4 weeks,2,6,12,18 months group,20 mice in 3 ~4 weeks group,10 mice in others.Themice were executed to wash out bone marrow.The MACSwas applied to obtain the Sca-1+hematopoietic stem/progenitor cells from mouse bonemarrow respectively.The TNB colour test,WST-1 method and thiobarbituric acidmethodswere used to detect total glutathione(GSSG+GSH),superoxide dismutase(SOD),superoxide and malondialdehyde(MDA)levels in the Sca-1+hematopoietic stem/progenitor cells of thesemice.The percentage of SA-β-gal positive cellswas detected by senescence-associated β-galactosidase(SA-β-Gal)staining.The ability to forming CFU-Mix was tested.ResultsThe SOD contents of Sca-1+HSC/HPC in five groups were(27.51±1.11),(38.23±3.50),(28.85±0.65),(12.67±0.89),(17.52±1.27)U/g(P<0.01).The total glutathione contents were(28.78±0.77),(31.48±2.03),(47.62±4.93),(25.63±1.23),(39.10±2.19)μmol/L(P <0.01).The optical density reflected by superoxide contentswere(0.114±0.005),(0.109±0.005),(0.133±0.002),(0.151±0.009),(0.141±0.005)(P<0.01).The MDA contents were(2.06±0.54),(0.81±0.35),(2.69±0.62),(11.44±1.19),(7.06±0.95)nmol/mg(P<0.01).The percentages of SA-β-gal positive cells were(2.26±0.65)%,(9.08±2.74)%,(11.58±0.89)%,(35.34±2.50)%,(15.76±1.23)%.The numbers of CFU-Mix were(8.79±0.56),(9.48±0.74),(5.14±0.89),(1.56±0.23),(0.98±0.50).ConclusionsWith aging,the contents of total glutathione and SOD are decreased,the contents of superoxide and MDA are increased,which indicates that the aging procedure is related with increase of peroxidation damage and the descent of antioxidation ability in Sca-1+hematopoietic stem/progenitor cells.
Sca-1+HSC/HPC;Superoxide dismutase;Glutathione;Superoxide;Malondialdehyde
R329.2
A
1005-9202(2013)05-1061-03;
10.3969/j.issn.1005-9202.2013.05.035
国家自然科学基金课题资助(81173398,30973818,30970872)
王亚平(1956-),男,教授,主要从事干细胞衰老研究。
耿 珊(1986-),女,在读硕士,主要从事造血干细胞衰老的研究。
〔2012-11-05收稿 2013-02-20修回〕
(编辑 曲 莉)

