伊立替康联合顺铂治疗晚期非小细胞肺癌的临床观察
赵文英,陈冬云,叶晓兵,陈景华
(皖南医学院弋矶山医院肿瘤内科,安徽芜湖 241000)
伊立替康联合顺铂治疗晚期非小细胞肺癌的临床观察
赵文英,陈冬云,叶晓兵,陈景华
(皖南医学院弋矶山医院肿瘤内科,安徽芜湖 241000)
目的评价伊立替康(CPT-11)联合顺铂(DDP)(IP方案)治疗晚期非小细胞肺癌(NSCLC)的疗效和毒副反应。方法入组31例晚期NSCLC患者均接受IP方案治疗:CPT-11 100 mg·m-2,静脉滴注90 min,d1,8;DDP 75 mg·m-2,静脉滴注,d1~3,分 3 次给药,21 d 为 1 周期。结果全组无 CR 病例,PR 8 例(25.8%),SD 17 例(54.8%),PD 6 例(19.4%),有效率(RR)为 25.8%。初治者 RR 为 31.6%(6/19),复治者RR为16.7%(2/12)。中位疾病进展时间为204 d。Ⅲ、Ⅳ度毒副反应主要为粒细胞减少、脱发、腹泻和恶心呕吐。结论IP方案治疗晚期NSCLC有效,且患者耐受性良好。
伊立替康;顺铂;非小细胞肺癌
肺癌的发病率和死亡率居世界首位,大多数患者就诊时已属晚期。非小细胞肺癌(non-small-cell lung cancer,NSCLC)发病率约占肺癌的 85%[1],化疗仍是治疗晚期NSCLC的主要手段。2007年1月至2009年12月,作者采用伊立替康(irinotecan,CPT-11)联合顺铂(cisplatin,DDP)(IP方案)治疗晚期NSCLC患者31例。现将结果报道如下。
1 资料与方法
1.1 一般资料 本组患者31例,男21例,女10例;年龄29~74岁,中位年龄62岁。病理类型:腺癌19例,鳞癌9例,腺鳞癌2例,未分型1例。临床分期:Ⅲb期11例,Ⅳ期20例。行为状态评分(performance status,PS):0~1分21例,2分10例。每位患者受累部位1~5个,中位数3个,常见的受累脏器或部位依次为肺部、淋巴结、胸膜、骨、肾上腺、脑、肝脏等。既往曾接受不同方法治疗:手术治疗5例、放疗7例、化疗12例,初次化疗19例。既往接受不同化疗方案的患者:长春瑞滨+DDP 6例、吉西他滨+DDP 3例、紫杉类+DDP 3例,治疗中位周期数为3。全部患者均有可测量或可评价的指标,预计生存期≥3个月,血常规、肝肾功能、心电图均正常,无青光眼及慢性腹泻病史,依从性好,并签署知情同意书。
1.2 治疗方法 CPT-11 100 mg·m-2,静脉滴注90 min,d1,8;DDP 75 mg·m-2,静脉滴注,d1~3,分 3 次给药,21 d为1周期,至少治疗2周期。化疗前静脉给予阿扎司琼10 mg预防性止吐,必要时给予重组人粒细胞集落刺激因子治疗。
1.3 疗效及毒副反应评价 2周期化疗结束后进行疗效评价,有效病例于4周后进行疗效确认。肿瘤的客观疗效按照RECIST标准分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),以CR+PR计算有效率(response rate,RR),以CR+PR+SD计算疾病控制率(disease control rate,DCR)[2]。疾病进展时间(time to tumor progression,TTP)定义为自治疗至疾病进展或死亡的时间。毒副反应根据NCICTC 3.0标准进行评价。
2 结果
2.1 近期疗效 31例患者共接受83周期治疗,中位周期数为3,均可评价疗效 。全组无 CR病例,PR 8例(25.8%),SD 17 例(54.8%),PD 6 例(19.4%)。RR为25.8%(8/31),DCR 80.6%(25/31)。其中初治者RR 为31.6%(6/19),DCR 89.5%(17/19);复治者RR为16.7%(2/12),DCR 66.7%(8/12)。31 例中可统计TTP 25例,中位TTP为204 d。见表1。
2.2 毒副反应 本组患者均可评价毒副反应,无治疗相关性死亡。常见的毒副反应依次为粒细胞减少、脱发、腹泻和恶心呕吐,Ⅲ、Ⅳ度的发生率为粒细胞减少(19.4%)、脱发(16.1%)、腹泻(6.5%)和恶心呕吐(6.5%)。见表 2。
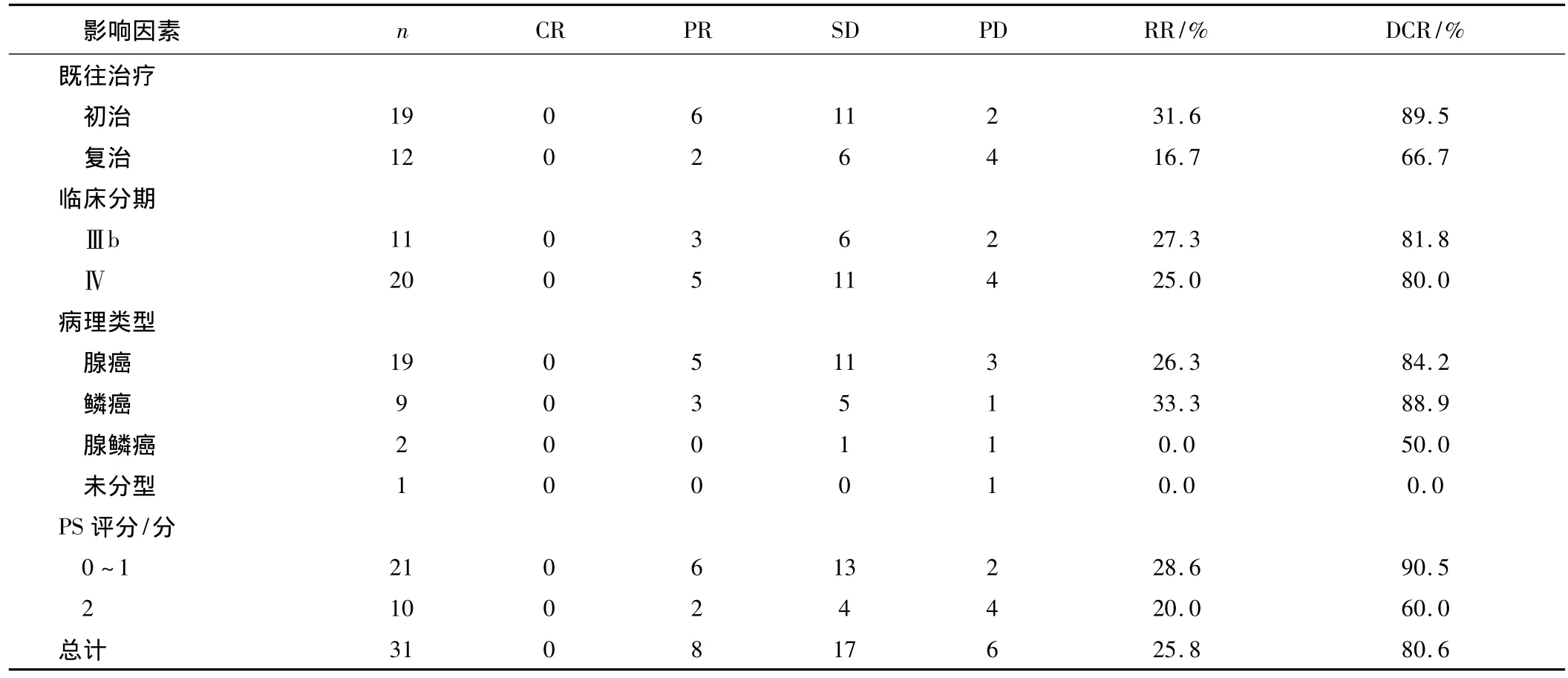
表1 IP方案治疗晚期NSCLC的疗效
3 讨论
近年来,环境污染导致肺癌的发病率及病死率迅速增高,肺癌已成为世界范围男性发病率和死亡率最高的癌症,在女性发病率为第4位,死亡率居第2位,2008年全球约140万人死于肺癌,而我国约占20%[1]。NSCLC起病隐匿,发展迅速,预后差,不治疗者的中位生存期(median survival time,MST)仅为4~5个月,1 a生存率约10%,5 a生存率不足5%[3]。患者初诊时多数已发生转移,失去了手术机会,化疗是其主要的治疗方法。2010年的Meta分析[4]显示,对于晚期NSCLC化疗较支持治疗具有明显的生存优势(HR=0.77),1 a生存率提高 9%(20%vs 29%),MST 延长1.5个月(4.5个月 vs6个月),差异均有统计学意义(P 均 <0.0001)。

表2 IP方案治疗晚期NSCLC的毒副反应 例
ECOG1594研究[5]以 DDP+PTX 为对照方案,与DDP+GEM、DDP+DOC、CBP+PTX等3个方案进行了比较,结果显示:4组的有效率分别为21%、22%、17%、17%,MST 分别为 7.8、8.1、7.4、8.1 个月,1 a 生存率分别为31%、36%、31%、34%,中位TTP分别为3.4 、4.2 、3.7 、3.1 个月,从而奠定了 GEM、DOC、PTX这3个第3代药物联合铂类治疗晚期NSCLC的一线地位。之后的多项研究分析显示以铂类为主的两药方案较单药方案显现出更佳的反应率和生存率,而三药化疗较两药方案并不能改善生存时间,毒副反应却增加[6-7]。目前以铂类为基础、联合第3代细胞毒性药物的两药方案已被ASCO推荐为有较好PS评分的Ⅲ~Ⅳ期NSCLC患者的标准一线治疗方案,RR 25% ~60%,MST 8~14个月,1 a生存率35%,2 a生存率约15%[5,8]。这些药物与铂类联合应用的近期疗效与远期疗效结果相似。目前尚无循证医学结果明确提示哪一个方案综合治疗疗效和低毒副反应方面具有突出的优势。
CPT-11于80年代初期在日本合成,为DNA拓扑异构酶Ⅰ抑制剂,其与DNA拓扑异构酶Ⅰ形成的复合物结合,从而使断裂的DNA单链不能重新接合,阻止DNA复制和抑制RNA合成,为细胞周期S期特异性药物。CPT-11在体内被羧酸酯酶转化为有活性的代谢产物SN-38[9]。CPT-11作为DNA拓扑异构酶Ⅰ抑制剂,作用机制与传统的酶抑制剂不同,其并不阻碍DNA拓扑异构酶Ⅰ的结合,而是将这种核酶转变成对DNA有害的物质,即DNA拓扑异构酶Ⅰ的浓度越高,对药物越敏感。基础研究[10]表明,结肠癌、宫颈癌 、卵巢癌等细胞内的DNA拓扑异构酶Ⅰ含量大大高于正常组织,尤其在S期肿瘤细胞中活性大幅度提高。在欧美及日本进行的临床研究中,发现该药对晚期大肠癌有肯定疗效,且与5-氟尿嘧啶(5-Fu)无交叉耐药,故FDA批准的适应证是用于对5-Fu耐药的结直肠癌。CPT-11对NSCLC、小细胞肺癌、宫颈癌、皮肤鳞癌、胰腺癌、胃癌和卵巢癌也有效[11]。临床前研究[12]证实CPT-11联合顺铂有协同增效作用。
CPT-11的非血液学毒性主要为腹泻,为剂量限制性毒副反应。有研究[2]表明CPT-11及其活性代谢产物SN-38诱发的腹泻有2个高发期。早期腹泻发生在输注后24 h内,一般认为与CPT-11抑制胆碱酯酶活性引起的胆碱能神经兴奋有关,并可伴随其他症状(如缩瞳、多涎、流泪、出汗、面红和肠痉挛等),这些反应均为一过性,偶尔较严重,给予莨菪碱类药物可以预防和治疗。更严重的毒副反应是迟发性腹泻,中位发生时间为用药后第5天,平均持续4 d。一般认为迟发性腹泻是由于肠黏膜损害引起的离子转运异常,导致向肠腔内分泌水和电解质过多所致。有研究[13]认为是CPT-11的活性代谢产物SN-38引发肠结构和功能的损害,出现肠壁变薄,伴有空洞形成、血管扩张、炎症细胞浸润以及回肠黏膜细胞凋亡。
日本在20世纪90年代初将CPT-11用于肺癌治疗[14],并做了大量的临床研究,Ⅰ期临床推荐治疗剂量为 CPT-11 60 mg·m-2,d1,8,15,DDP 80 mg·m-2,d1。DeVore等[15]采用CPT-11联合DDP治疗初治Ⅲb和Ⅳ期的NSCLC患者,客观缓解率28.8%,MST 9.9个月,1 a生存率37%,Ⅲ、Ⅳ度毒副反应包括恶心32.7%,呕吐13.5%,迟发性腹泻17.3%,中性粒细胞减少46.1%。Saito等[16]报道的一项DDP联合CPT-11治疗晚期NSCLC的Ⅱ期临床研究结果显示客观缓解率30%,MST 52周,1 a生存率48%,Ⅲ、Ⅳ度毒副反应包括迟发性腹泻22%,中性粒细胞减少60%。张湘茹等[17]报道了CPT-11联合DDP治疗晚期NSCLC的临床研究。其中 CPT-11 60 mg·m-2,d1,8,15;DDP 80 mg·m-2,d1。35 例近期 RR 为 22.9%,初治者29.2%,复治者为 9.1%,中位 TTP 为199 d,1 a生存率为45.4%。Ⅲ、Ⅳ度毒副反应发生率为粒细胞减少19.4%、脱发16.1%、腹泻 6.5% 和恶心呕吐 6.5%。陈誉等[18]CPT-11联合DDP一线治疗晚期NSCLC 35例。CPT-11 100mg·m-2,d1,8;DDP 75mg·m-2,d1~3,结果显示,全组 CR 1 例(2.8%),PR 10 例(28.6%),SD 20例(57.1%),PD 4 例(11.4%)。初治 RR 为31.4%,DCR 88.5%,中位 TTP 为 199 d,1 a生存率为54.3%,2 a生存率为11.4%。Ⅲ、Ⅳ度毒副反应的发生率为粒细胞减少17.1%,血小板减少2.8%,脱发17.1%,腹泻 8.6%,恶心呕吐 2.8%。
作者采用IP方案治疗晚期NSCLC,31例中PR 8例(25.8%),SD 17 例(54.8%),RR 为 25.8%,DCR 80.6%,与国外报道相同治疗方案相仿[8],与其他铂类为主治疗NSCLC方案相近。在本组患者中,复治者12例,PR 2例,SD 6例,PD 4例,复治者 RR为16.7%,DCR 66.7% 。本文结果显示:CPT-11联合DDP二线治疗晚期NSCLC有一定疗效,患者耐受性好,且与患者的临床分期、病理类型及PS状态无关,可成为二线方案的一种选择。但本组病例数尚少,尚需大样本临床研究结果以进一步确立CPT-11在晚期NSCLC二线治疗中的地位。
IP方案常见的毒副反应依次为粒细胞减少、脱发、腹泻和恶心呕吐,本组Ⅲ、Ⅳ度的发生率为粒细胞减少 19.4%、脱发 16.1%、腹泻 6.5%和恶心呕吐6.5%。粒细胞减少在应用集落刺激因子的作用下很快恢复,而腹泻基本可以用盐酸洛派丁胺控制,均未影响治疗进程。
综上所述,CPT-11联合 DDP方案治疗晚期NSCLC疗效肯定,患者耐受性较好,可以作为晚期NSCLC的治疗选择。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer JClin,2011,61(2):69 -90.
[2] 孙燕,石远凯.临床肿瘤内科手册[M].5版.北京:人民卫生出版社,2008:152,822.
[3] Visbal AL,Leighl NB,Feld R,et al.Adjuvant chemotherapy for early-stage non-small cell lung cancer[J].Chest,2005,128(4):2933-2943.
[4] Non-Small Cell Lung Cancer Collaborative Group.Chemotherapy and supportive care versus supportive care alone for advanced nonsmall cell lung cancer[J].Cochrane Database Syst Rev,2010,12(5):CD007309.
[5] Schiller JH,Harrington D,Belani CP,et al.Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J].N Engl JMed,2002,346(2):92 -98.
[6] Azim HA Jr,Elattar I,Loberiza FR Jr,et al.Third generation triplet cytotoxic chemotherapy in advanced non-small cell lung cancer:a systematic overview[J].Lung Cancer,2009,64(2):194 -198.
[7] 王艇,马彬,杨克虎,等.第三代药物为基础的三药方案对比两药方案化学治疗晚期非小细胞肺癌的系统评价[J].中国肺癌杂志,2009,12(6):565 -570.
[8] Ohe Y,Ohashi Y,Kubota K,et al.Randomized phase Ⅲ study of cisplatin plus irinotecan versus carboplatin plus paclitaxel,cisplatin plus gemcitabine,and cisplatin plus vinorelbine for advanced nonsmall-cell lung cancer:Four-Arm Cooperative Study in Japan[J].Ann Oncol,2007,18(2):317 -323.
[9] Lavelle F,Bissery MC,AndréS,et a1.Preclinical evaluation of CPT-11 and its active metabolite SN-38 [J].Semin Oncol,1996,23(1 Suppl3):11-20.
[10]王丽焱.抗肿瘤药伊立替康的研究进展[J].国外医学:药学分册,2004,31(1):7 -11.
[11]江滨,陈书长.抗肿瘤药物临床应用指南[M].北京:中国协和医科大学出版社,2005:279-284.
[12] Jagasia MH,Langer CJ,Johnson DH,et a1.Weekly irinotecan and cisplatin in advanced non-small cell lung cancer:a multicenter phase Ⅱ study[J].Clin Cancer Res,2001,7(1):68 -73.
[13] Ikuno N,Soda H,Watanabe M,et a1.Irinotecan(CPT-11)and characteristicmucosal changes in themouse ileum and cecum[J].JNatl Cancer Inst,1995,87(24):1876 -1883.
[14] Masuda N,Fukuoka M,Takada M,et al.CPT-11 in combination with cisplatin for advanced non-small-cell lung cancer[J].JClin Oncol,1992,10(11):1775 -1780.
[15] DeVore RF,Johnson DH,Crawford J,etal.Phase Ⅱ study of irinotecan plus cisplatin in patients with advanced non-small-cell lung cancer[J].JClin Oncol,1999,17(9):2710 -2720.
[16] Saito H,Kudoh S,Nakagawa K,et al.Phase Ⅱstudy of 3-week scheduling of irinotecan in combination with cisplatin in patients with advanced nonsmall-cell lung cancer[J].Am J Clin Oncol,2006,29(5):503 -507.
[17]张湘茹,朱允中,修清玉,等.伊立替康联合顺铂治疗晚期非小细胞肺癌临床报告[J].中华肿瘤杂志,2006,28(10):777-779.
[18]陈誉,何志勇,林动.伊立替康联合顺铂一线治疗晚期非小细胞肺癌临床观察[J].徐州医学院学报,2010,30(3):187 -189.
Clinical Observation of Irinotecan p lus Cisp latin for Advanced Non-small Cell Lung Cancer
ZhaoWenying,Chen Dongyun,Ye Xiaobing,Chen Jinghua
(Department of Medical Oncology,Yijishan Hospital ofWannan Medical College,Wuhu 241000,China)
ObjectiveTo evaluate the efficacy and toxicities of irinotecan(CPT-11)combined with cisplatin(DDP)(IP regimen)in the treatment of patientswith advanced non-small cell lung cancer(NSCLC).MethodsThirty one patients with advanced NSCLC
the IP regimen chemotherapy:CPT-11 100 mg·m-2,intravenously guttae,d1,8,DDP 75 mg·m-2was divided into 3 days,intravenously guttae,d1-3,every 21 dayswas a cycle.ResultsOf the 31 patients,no CR was observed,PR in the 8 patients(25.8%),SD in the17 patients(54.8%),PD in the 6 patients(19.4%),the response rate(RR)was 25.8%.The RR was 31.6%(6/19)of the initial treatment patients,and was 16.7%(2/12)of the retreatment patients.Themedian time to tumor progression was 204 days.Themain toxicitieswith grade Ⅲ-Ⅳ were neutropenia,alopecia,diarrhea,nausea and vomiting.ConclusionIP regimen is effective for the patients with advanced NSCLC,and the toxicities can be tolerated.
irinotecan;cisplatin;non-small cell lung cancer
10.3969/j.issn.1673-5412.2013.02.005
R734.2;R730.53
A
1673-5412(2013)02-0107-04
赵文英(1966-),女,主任医师,副教授,主要从事肿瘤内科工作。E-mail:zhaowy98@yahoo.com.cn
2012-06-21)

