基于取代水杨醛与取代邻氨基酚Schiff碱的合成、表征及光谱性质研究
孙雄飞,王剑秋,田炜,倪鹏辉,陈智勇,蒋伍玖,邝代治,林建雄,韩绪英,曾志君,艾 慧
(1.功能金属有机材料湖南省普通高等学校重点实验室,湖南 衡阳 421008;2.衡阳师范学院 化学与材料科学系,湖南 衡阳 421008)
Schiff碱也称亚胺或亚胺取代物,是一类含有C=N基团的有机化合物。自从Schiff碱于1864年首次报道了伯胺和羰基化合物发生缩合生成具有甲亚胺基的产物,即称Schiff碱,迄今国内外学者仍在不断开展此领域的工作[1-5],推陈出新,方兴未艾。Schiff碱是一类重要的配体,能灵活地选择各种羰基化合物和不同的胺类反应,改变连接的取代基,变化给予体原子的位置,可以得到从单齿到多齿,链状到环状,对称到不对称等种类繁多、结构复杂的Schiff碱。Schiff碱上的取代基团的灵活多变及Schiff碱C=N基团本身的特性,使其具有重要的化学意义。Schiff碱可以和周期表中大多数金属离子形成稳定性不同的配合物,是配位化学中应用最为广泛的配体之一。这些配体及其配合物己广泛地应用于分子催化、生物活性、药物分子设计以及功能材料等方面的研究[5-11],在配位化学发展的过程中起着重要的用[12-14]。本文利用取代水杨醛与取代邻氨基酚反应,制备了12种取代水杨醛缩取代邻氨基酚Schiff碱,利用元素分析、FT-IR、ESIMS、1H NMR对化合物进行了表征,并研究了化合物的光谱性质。
1 实验部分
1.1 仪器和试剂
水杨醛、邻氨基酚和四氯化碳为化学纯,其他试剂均为分析纯,5-氯水杨醛、5-溴水杨醛、3,5-二氯水杨醛、3,5-二溴水杨醛参考文献[15]方法合成。IR用日本岛津IR Prestige-21红外光谱仪(4 000~400cm-1,KBr压 片)测 定,核 磁 用Bruker AVANCE-400核磁共振仪测定;元素分析用PE-2400(II)元 素 分 析 仪 测 定;ESI-MS用 岛 津LCMS2020基于取代水杨醛与取代邻氨基酚测定;紫外光谱用日本岛津公司UV-2550紫外光谱仪测定;荧光用日本日立公司F-7000荧光光谱仪测定;熔点用北京产XT-4双目体视显微熔点测定仪测定(温度计未经校正)。
1.2 取代水杨醛缩邻氨基酚类Schiff碱的合成
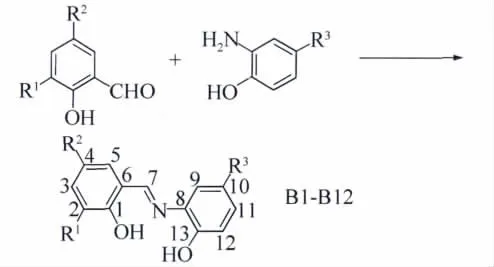
将10mmol取代水杨醛和10mmol取代邻氨基酚置于50mL圆底烧瓶中,加入20~30mL无水乙醇,在磁力搅拌下回流3h。静置冷却至室温,抽滤,真空干燥,得产品。
2 结果与讨论
2.1 合成反应及物理性质
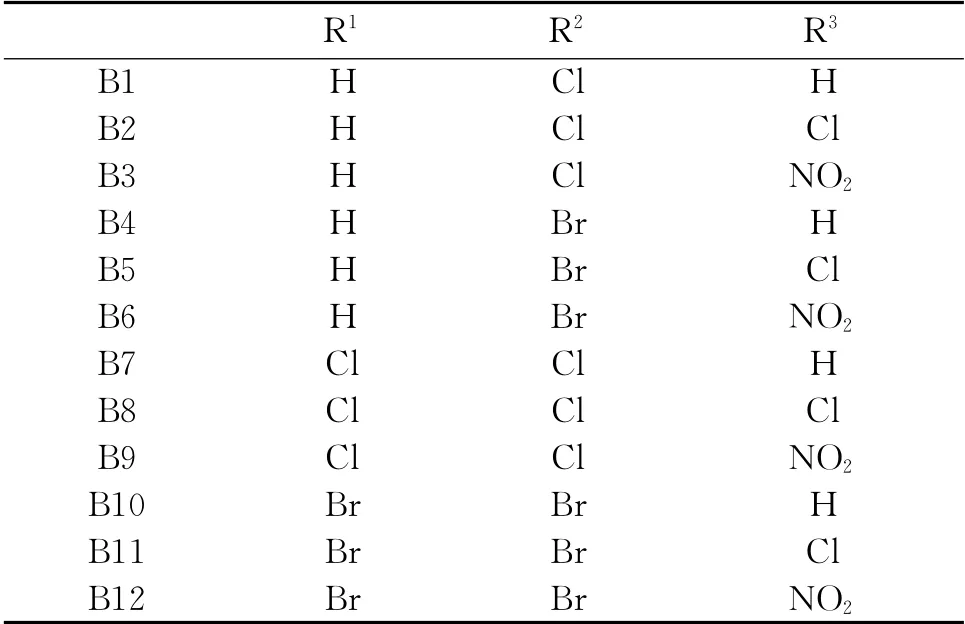
从反应机理上看,Schiff碱形成属于亲核加成反应,对于胺类物质来说,氮原子的电子云密度越大,试剂的亲核性就越强,化学反应速度就越快,反之就越慢。芳香性胺,其苯环上氨基的邻、对位为供电子基团时,则有利于氮原子电子云密度增加;反之,苯环上氨基的邻、对位采为吸电子基团如硝基、卤素时,则不利于氮原子电子云密度增加,其亲核性下降,反应速度下降,表1结果符合这一规律,如化合物B1-B12的产率:B1>B2>B3,B4>B5>B6,B7>B8>B9,B10>B11>B12。Schiff碱化合物在极性反应体系中易于生成,如甲醇、乙醇等。因为当反应形成过渡态时,过渡态的电荷相对于反应物的增大、集中,选择极性比较大的溶剂有利于过渡态的稳定,从而降低反应的活化能,有利于产物的生成。因此,选择极性比较大的溶剂会加速化学反应的进行。

表1 Schiff碱化合物的元素分析及物理性质
2.2 谱学表征
2.2.1 红外光谱
取代水杨醛缩邻氨基酚类Schiff碱B1-B12的红外光谱数据见表2。从表中数据可以看出,-OH的吸收峰在3 450cm-1左右,标志Schiff碱形成的C=N键产生的吸收峰出现在1 619~1 630cm-1及1 591~1 610cm-1,C-Cl键和C-Br的吸收峰分别在1 007~1 086cm-1和1 029~1 085cm-1,C-NO2的吸收峰出现在1 502~1 532cm-1。
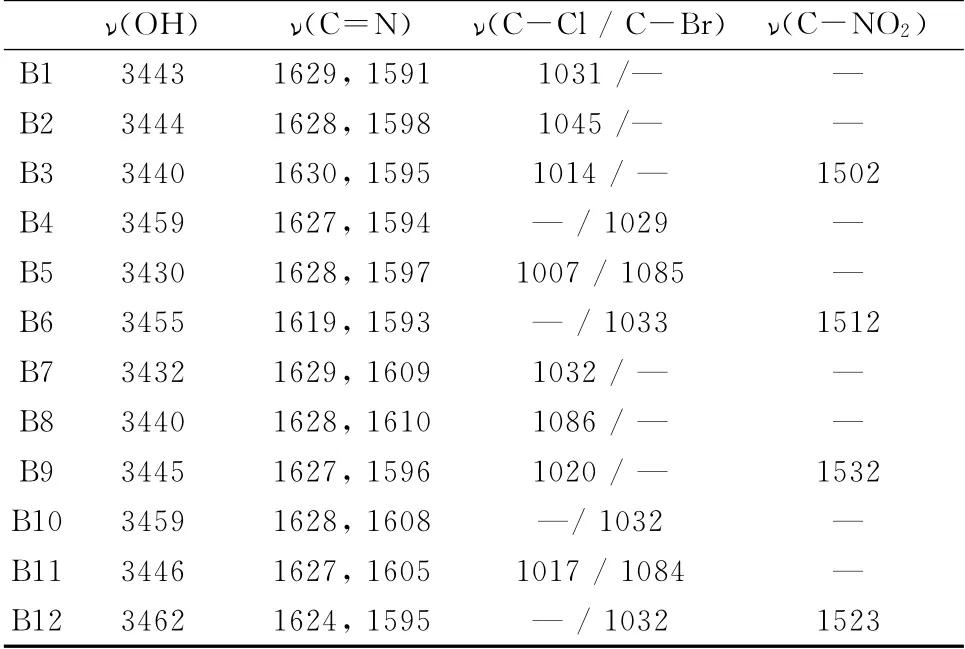
表2 Schiff碱化合物的IR谱数据(KBr,cm-1)
2.2.2 核磁共振氢谱
Schiff碱化合物的1H NMR谱数据见表3,在取代水杨醛缩邻氨基酚类Schiff碱的1H NMR中,其各组峰的积分面积之比与理论推测结构的各组质子数相对吻合,H2O的质子化学位移出现在3.33 ppm,DMSO-d6的质子化学位移出现在2.50 ppm。酚羟基上质子化学位移在9.76~11.69 ppm和13.08~15.63ppm,芳香环上的质子化学位移在6.39~8.42ppm,与N相连的碳上的质子化学位移在8.15~9.46ppm[16-18]。

表3 Schiff碱化合物的1 H NMR谱数据(DMSO-d6,400MHz)
2.3 ESI-MS
化合物B1的ESI-MS图谱见图1,m/z 246.0是所代表的化合物B1的准分子离子峰[M-H]-,m/z 248.0为[M+2-H]-,由于化合物B1中含有一个氯原子,而氯原子的同位素丰度为35Cl(75.8%):37Cl(24.2%)(3:1),故在谱图中m/z 246.0:m/z 248.0峰高比为3:1是由于氯同位素导致的一个特征峰,综合分析结果,测试化合物为目标化合物B1。
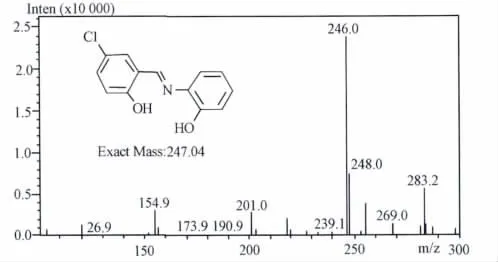
图1 化合物B1的ESI-MS图谱(负离子模式)
2.4 UV-vis光谱研究
在室温下,用丙酮分别配置浓度为1×10-4mol/L的B1-B12溶液,分别测试它们的紫外-可见吸收光谱,如图2所示。从图中可以发现,3,5-二氯水杨醛邻氨基酚Schiff碱(B7)和3,5-二溴水杨醛邻氨基酚Schiff碱(B10)在465nm出现一个较大吸收;3,5-二氯水杨醛4-氯邻氨基酚Schiff碱(B8)、3,5-二溴水杨醛4-氯邻氨基酚Schiff碱(B11)、3,5-二氯水杨醛4-硝基邻氨基酚Schiff碱(B9)和3,5-二溴水杨醛4-硝基邻氨基酚Schiff碱(B12)在475nm出现中等强度吸收峰;而其他取代的水杨醛邻氨基酚类Schiff碱(B1-B6)在这两个区域没有出现吸收峰,这可能是由于卤素原子的供电子效应影响了相关共轭分子轨道的能级所致[19-21]。
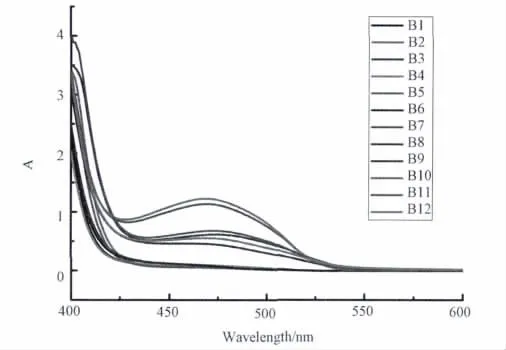
图2 取代水杨醛邻氨基酚类Schiff碱B1-B12紫外-可见光谱图
2.5 荧光光谱研究
在室温下,用丙酮分别配置浓度为1×10-5mol/L的B1-B12溶液,分别测试它们的荧光光谱,如图2所示。从图中可以看出,取代水杨醛邻氨基酚类Schiff碱(B1-B12)为荧光效率较低的物质,其中3,5-二溴水杨醛邻氨基酚Schiff碱(B10)、3,5-二溴水杨醛4-氯邻氨基酚Schiff碱(B11)和3,5-二氯水杨醛邻氨基酚Schiff碱(B7)相对较强;说明苯环上连接的卤素原子越多,荧光越强,且溴强于氯,可能是由于卤素的供电子效应所致[19-21]。
3 结 论
本文从水杨醛出发,合成了4个取代水杨醛,12个取代水杨醛邻氨基酚类Schiff碱,并运用元素分析、IR、1H NMR和ESI-MS等手段对结构进行表征。研究了此类化合物的紫外-可见及荧光光谱,结果表明:合成Schiff碱化合物苯环上连接卤素原子越多,其荧光越强,且溴原子的作用强于氯原子。
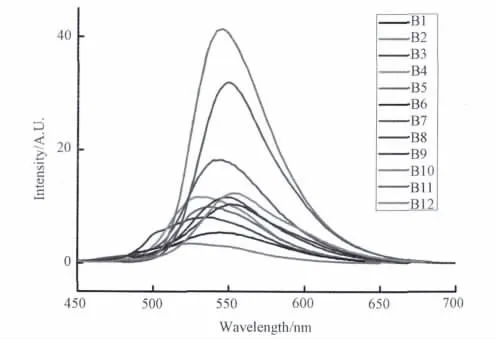
图3 取代水杨醛邻氨基酚类Schiff碱B1-B12荧光光谱图
[1]Ashok M,Holla B S,Poojary B.Convenient one pot synthesis and antimicrobial evaluation of some new mannich bases carrying four-methyl thiobenzyl mointy[J].European Journal of medicinal chemistry,2007,42(8):1095-1101.
[2]Shiradkar M,Suresh Kumar G V,Dasari V.Clubbed triazoles:a novel approach to antitubercular drugs[J].European Journal of medicinal chemistry,2007,42(6):807-816.
[3]李红,乐学义,吴建中,等.铜(II)邻菲咯琳蛋氨酸配合物与DNA相互作用的研究[J].化学学报,2003,61(2):245-250.
[4]林秋月,冯旭文,胡瑞定,等.水杨醛缩赖氨酸Schiff碱金属配合物的合成和表征[J].化学研究与应用,2004,16(4):547-551.
[5]李五聚,史瓒,李时银,等.邻香草醛缩氨基酸钾Schiff碱及其三苄基锡(IV)配合物的合成与表征[J].无机化学学报,2000,16(3):510-514.
[6]李忠芳,傅芳信,潘华德,等.β-烷氧羰乙基三氯化锡与Schiff碱配合物的合成、表征与结构[J].化学学报,1999,57(7):820-830.
[7]赵建章,赵冰,徐蔚青,等.Schiff碱N,N-双水杨醛缩-1,6乙二胺的光致变色光谱的研究[J].高等学校化学学报,2001,22(6):971-975.
[8]李建章,秦圣英,李仲辉,等.冠醚化单和双Schiff碱的合成及其钴(II)配合物的氧加合性能[J].化学学报,1999,57(3):289-304.
[9]冯雷,禹兴海,金淑萍,等.含香豆素骨架水杨醛Schiff碱荧光材料的制备及光谱性能研究[J].化学试剂,2012,34(3):257-260.
[10]高春艳,冯莉,卢静,等.水杨醛甘氨酸Schiff碱铜配合物的合成、结构、磁性及其化学核酸酶活性研究[J].化学试剂,2012,34(3):257-260.
[11]Arbaoui A,Redshaw C,Noelia M S B,et al.Bimetallic copper(II)and zinc(II)complexes of acyclic Schiff base ligands derived from amino acids[J].Inorganica Chimica Acta,2011,365(1):96-102.
[12]游效曾,孟庆金,韩万书.配位化学进展[M].北京:高等教育出版社,2000.
[13]唐婷.希夫碱的研究新进展[J].杭州医学高等专科学校学报,2000,21(4):204-210.
[14]Bastos M B R,MoreiraJ C,Farias P A M.Adsorptive stripping voltammetric Behaviour of UO2(Ⅱ)complexed with the Schiff base N,N-Prime-ethylenebis(salicylidenimine)in 4-(2-hyd roxy ethyl)-l-piperazine ethanesulfonic acid medium[J].Analytica Chimica Acta,2000,408(9):83-88.
[15]刘瑞蓝.水杨醛衍生物的制备[J].陕西化工,1988(1):1-3.
[16]Ferraro J R.Low-frequency Vibrations of Inorganic and Coordinations Compounds[M].New York:Plenum Press,1971.
[17]Adams D M.Metal-Ligand and Related Vibrations[M].London:Edward Arnod,1967.
[18]Gottlieb H E,Kotlyar V,Nudelman A.NMR chemical shifts of common laboratory solvents as trace impurities[J].J.Org.Chem.1997,62(21):7512-7515.
[19]柯以侃,董慧茹.分析化学手册:第三分册[M].北京:化学工业出版社,1998.
[20]侯丽新.希夫碱锌配合物电致发光材料的合成及物理性能研究[D].太原:太原理工大学,2007.
[21]王延伟.希夫碱金属有机化合物的合成、结构表征及性质研究[D].宁波:宁波大学,2011.

