骨肉瘤中血管生成拟态与HIF-1α蛋白的关系及临床意义
鲍正齐 柴大敏 肖玉周 张长春 吴 敏 周建生*
(1蚌埠医学院第一附属医院骨科;2蚌埠医学院第一附属医院病理科,安徽233003)
骨肉瘤(osteosarcoma)是骨组织最常见的恶性肿瘤,易早期发生血行转移,在临床诊断的病例中,约80%的病例在确诊时已存在由血道转移至远处部的微小瘤灶[1]。最近的研究发现一些高度恶性肿瘤除了血管生成(angiogenesis)外,还存在一种不依赖于血管内皮细胞的血液供应模式—血管生成拟态(vasculogenic mimicry,VM),即肿瘤细胞通过自身变形和基质重塑产生血管样通道,从而满足自身血液供应的方式,使肿瘤更易侵袭和转移。
缺氧诱导因子-1α(HIF-1α)基因位于14号染色体,编码826个氨基酸,当细胞缺氧时,HIF-lα在细胞核内高表达。当恶性肿瘤快速生长,发生缺氧时,HIF-lα会上调VEGF等多种靶基因表达以逃避或适应相对缺氧环境,参与肿瘤生长、浸润和转移[2-3]。本研究采用免疫组织化学和组织化学染色的方法检测108例骨肉瘤和对照组28例骨软骨瘤组织中VM、HIF-1α和微血管密度(microvessel density,MVD)表达情况,分析其与临床病理因素及预后的关系,旨在探寻影响骨肉瘤侵袭、转移和生存时间的指标。
材料和方法
1.一般资料
收集蚌埠医学院第一附属医院临床病理科2003年1月至2008年12月存档石蜡包埋骨肉瘤标本108例。所有患者术前均未进行放、化疗及免疫治疗,具有完整的临床、病理及随访资料且经过患者及人体试验伦理道德委员会(蚌埠医学院)同意。病程1-4个月,平均2.42±0.45个月,男性67例,女性41例;年龄6-75岁,平均22.23±13.09岁,其中<22岁55例,≥22岁53例;软组织浸润52例、无浸润56例;远处(包括远处)转移59例、无转移49例;肿瘤部位:膝关节附近58例(股骨下端31例、胫骨上端27例),颌骨31例(上颌骨21例、下颌骨10例),其他部位19例(肱骨上端9例,腓骨3例,锁骨3例,胸骨4例);组织分型:骨母细胞型55例,纤维母细胞型35例,软骨母细胞型18例;病理分级低危险度(G1级)23例,中、高危险度(G2级)85例;按Enneking分期:Ⅰ期23例,Ⅱ期40例,Ⅲ期45例,以同时期28例骨软骨瘤作为对照。所有标本均经过两位以上资深病理医师确诊。
2.实验试剂和方法
2.1实验试剂
鼠抗人单克隆 HIF-lα抗体(SC-53546)购自美国Santa Cruz公司,稀释浓度为 1:200;CD34(MAB-0034)单克隆抗体购自福州迈新生物技术开发公司;ElivisionTMplus试剂盒和DAB显色试剂盒均购自福州迈新生物技术开发公司。
2.2免疫组织化学染色
采用免疫组织化学ElivisionTMplus法,每张切片连续切数张,每张约4-5μm厚,烤干,置于二甲苯溶液及不同浓度的乙醇中脱蜡至水洗。免疫组化染色操作步骤按试剂盒说明书进行,以PBS缓冲液代替一抗作空白对照。
2.3CD34和PAS套染及MVD计数
免疫组织化学CD34染色,DAB显色后蒸馏水冲洗1min左右终止显色反应,置于0.5%过碘酸中还原5-8min,蒸馏水冲洗2min,置于Schiff液中染色10min,0.5%偏重亚硫酸钠液滴洗2次,蒸馏水冲洗2min,此后依次苏木素复染细胞核、盐酸酒精分化、返蓝、脱水后中性树胶封片。CD34主要表达于血管内皮细胞的细胞质/胞膜,因而可以通过CD34的阳性表达进行MVD的计数,参照修改过的Weidner[4]法计数。
3.结果判定
HIF-lα蛋白主要位于肿瘤细胞及对照组织细胞的胞核,呈棕褐色细颗粒状,胞浆仅有少量表达。免疫组化结果采用半定量双评分法评价:每张切片随机观察10个高倍视野,每个视野计数200个细胞。阳性细胞记为:<10%为0分;10-50为1分;51-75为2分;﹥75为3分;细胞着色强度记为:不着色为0分;浅黄色为1分;黄色为2分;棕褐色为3分。两者分数相乘0-1分为(-);2-3分为(+);4-6分为(++);>6分为(+++)。根据免疫组化结果和患者术后存活时间的不同,截定点为3,即≤3分为低表达,≥4分为过表达;免疫组化结果由资深病理医师读片评定。
4.随访
随访定义为自首发症状至死亡之间的时间为总体存活时间(Overall survival time,OS),自手术之日起至肿瘤复发或再次转移所经历时间称为无瘤存活时间(Disease free survival time,DFS),所选病例随访至患者死亡或截止2012年12月,随访时间为3-110个月。
5.统计与分析
采用SPSS19.0统计软件进行数据分析。采用Kaplan-Meier法比较 VM、HIF-lα过表达及 MVD阳性组与阴性组之间的生存差异;Log-rank检验比较组间差异;Cox多因素分析骨肉瘤患者临床病理因素及VM、HIF-lα和 MVD与预后之间的关系;VM、HIF-lα和 MVD在骨肉瘤组织及骨软骨瘤中的表达及与临床病理因素的相关性采用χ2检验及Spearman等级相关检验,P<0.05为差异有统计学意义。
结 果
1.骨肉瘤组织中VM与临床病理因素之间的关系
通过苏木素-伊红(HE)染色观察到在异型的细胞间有脚手架结构样骨样组织(图1A)结合影像学和临床病史确诊为骨肉瘤,且在骨肉瘤组织中存在VM结构(图1B),即肿瘤细胞围绕成管腔样结构,管腔内可有可无红细胞,具有VM的肿瘤细胞附近不见坏死的肿瘤细胞及炎症细胞;通过CD34和PAS套染VM显示为管壁没有CD34阳性的梭形内皮细胞环绕而有PAS阳性的基底膜样结构。管壁有CD34阳性的内皮细胞,无论管腔内有无红细胞,均判定为内皮依赖性血管(图1C,D)。
在108例骨肉瘤组织中查见68例存在VM样通道,其阳性率为62.96%(68/108);骨软骨瘤中不存在VM样通道,差异具有统计学意义(P<0.05)。VM与患者的性别、年龄、部位、组织学分型及直径之间差异无统计学意义(P>0.05),与病理分级、软组织浸润、远处转移及临床分期组间差异均有统计学意义(P<0.01),见表1。
2.骨肉瘤组织中HIF-lα过表达及其与临床病理因素之间的关系
HIF-lα主要表达于细胞核,呈棕褐色(图1E,F)。HIF-lα在骨肉瘤及骨软骨瘤组织中过表达率分别57.41%(62/108)和32.14%(9/28),组间比较差异有统计学意义(P<0.05);HIF-lα表达水平与患者的性别、年龄、部位、组织学分型及直径之间差异无统计学意义(P>0.05);与病理分级、软组织浸润、远处转移及临床分期间差异有统计学意义(P<0.01),见表1。
3.骨肉瘤组织中 MVD与临床病理因素、VM及HIF-lα蛋白过表达之间的关系
MVD的均值为22.47±8.38,故以 MVD<22为阴性组,MVD≥22为阳性组。MVD在骨肉瘤组织中阳性率为58.33%(63/108),在骨软骨瘤组织中阳性率为28.57%(8/28),组间比较差异有统计学意义(P<0.05)。MVD与患者的性别、年龄、部位、组织学分型及直径之间差异无统计学意义(P>0.05);与病理分级、软组织浸润、远处转移及临床分期间差异有统计学意义(P<0.01),见表1。
Spearman相关分析显示,在骨肉瘤组织中VM,HIF-lα蛋白过表达及 MVD两两之间均呈正相关(P<0.01,表2)。
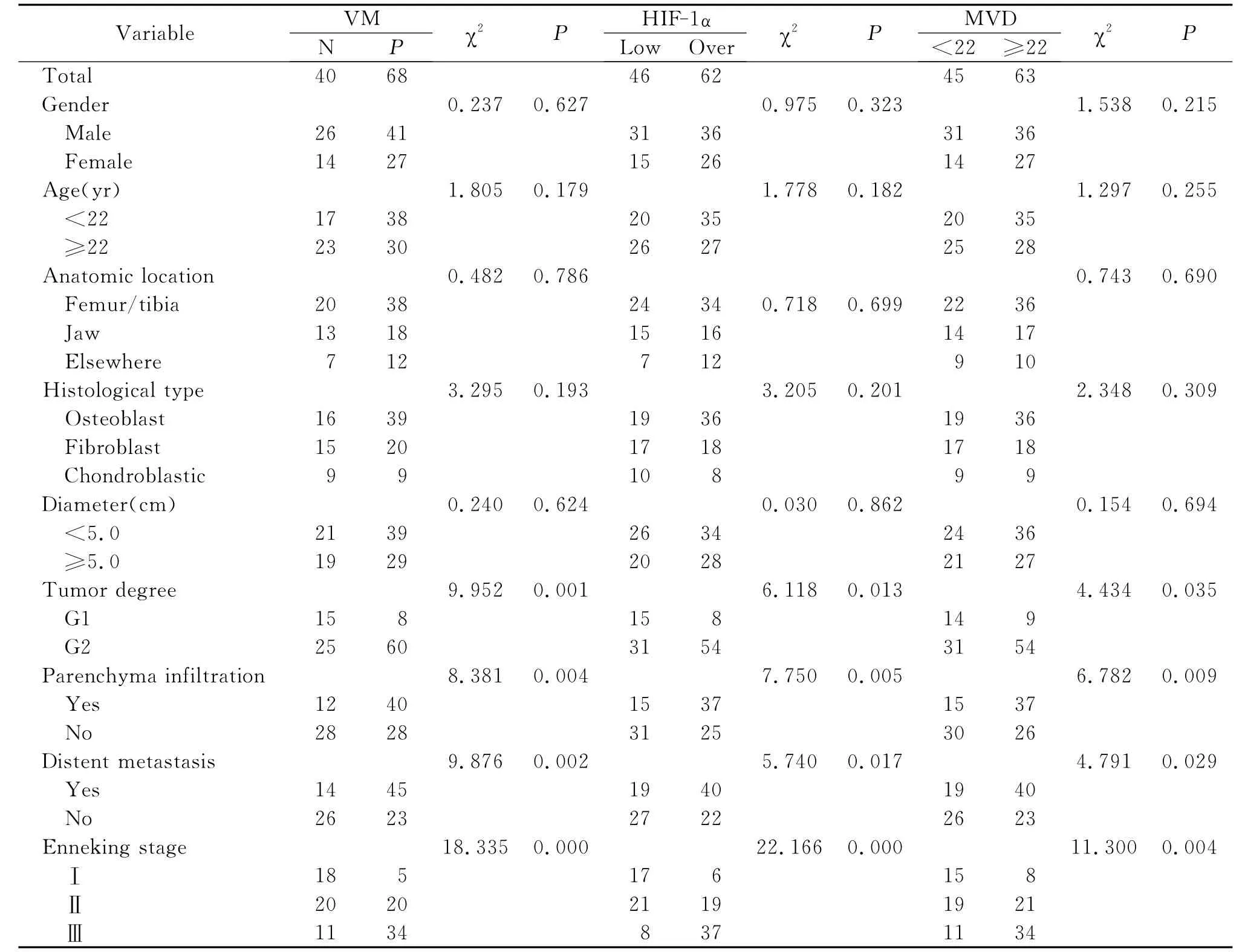
表1 骨肉瘤患者中VM、HIF-1α过表达及MVD与临床病理因素之间的关系(n=108)Table 1 Correlation of VM,over-expression of HIF-1αand MVD to clinicopathologic characateristics in osteosarcoma(n=108).

表2 骨肉瘤组织中VM、HIF-lα表达水平及MVD之间的相互关系(n=108)Table 2 The association of VM,HIF-lαand MVD in osteosarcoma(n=108)
4.多因素预后分析
将性别(男与女)、年龄(<22岁与≥22岁)、肿瘤部位(膝关节附近、颌骨与其他部位)、病理分级(G1组与G2组)、组织类型(骨母细胞型、纤维母细胞型与软骨母细胞型)、肿瘤直径(≥5.0cm组与<5.0cm组)、软组织浸润(浸润组与无浸润组)、远处转移(转移组与无转移组)、Enneking分期(Ⅰ、Ⅱ与Ⅲ期)、VM(阴性组与阳性组)、MVD(≥22组与<22组)和HIF-lα蛋白(过表达组与低表达组)等因素引入Cox模型进行多因素预后分析,结果显示VM、HIF-lα蛋白表达的水平和MVD、软组织浸润、远处转移及Enneking分期是影响骨肉瘤患者预后的独立因素(P<0.05,表3)。
5.生存分析
Kaplan-Meier生存分析显示108例骨肉瘤患者,至随访结束之日起,存活时间超过60个月(5年)者共41例,即总体5年存活率为37.97%(41/108)。VM阳性与阴性组、HIF-1α过表达与低表达组及MVD≥22与<22组间比较差异有统计学意义(P<0.05),见表4,生存曲线见图2。

表3 108例骨肉瘤患者COX多因素生存分析Table 3 Multivariate survival analysis of 108patients with osteosarcoma

表4 不同VM、HIF-1α和MVD组骨肉瘤患者5年存活率、总体和无瘤存活时间Table 4 The 5-year-survival rate,overall and disease free survival time of patients with osteosarcoma in different VM,HIF-1αand MVD groups
讨 论
血管生成拟态是1999年由 Maniotis[5]等首次提出,即后来被Folberg等[6]描述的PAS阳性图案:直的、平行排列的、十字交叉的、彩虹样的(没有完全封闭)、有分支的彩虹样的、封闭的环状的和网络状的通道(即最少有3个背靠背的PAS阳性环)。该通道的特点是无内皮细胞衬覆,内皮细胞特异标记物(CD31,CD34,FⅧ)染色均为阴性,肿瘤细胞模仿机体血管形成而形成瘤细胞条索并围成通道,而血液可在这无内皮细胞的通道中流动,通道外周是一层厚薄不一的PAS阳性物质构成的基底膜。研究发现在恶性黑色素瘤、炎性乳腺癌、肝细胞性肝癌、胃恶性间质瘤、非小细胞肺癌[7-10]等高度侵袭性肿瘤中存在VM。本研究108例骨肉瘤组织中68例存在符合VM结构的管道,而正常骨软骨瘤组织中不存在VM结构,组间比较差异有统计学意义(P<0.05)。存在VM的骨肉瘤患者病理分级较差、软组织浸润及远处转移率较高且Enneking分期更晚(Ⅱ和Ⅲ期),组间比较差异均有统计学意义(P<0.05)。VM阳性组患者的5年存活率(8.82%)显著低于VM阴性组患者(87.5%),且患者总体生存时间(28.5±1.39)及无瘤生存时间(12.250±0.736)均显著低于VM 阴性组(68.5±1.15和38.725±2.207)。我们观察到在VM区域肿瘤细胞坏死现象不明显,说明在VM存在的情况下确实形成了有效的血液供应模式。正如Zhang et al[11]提出的肿瘤血供的“三阶段现象”,即在肿瘤小于2.0mm时,主要是通过VM形成的功能性微循环供血;之后内皮细胞长入肿瘤细胞之间形成马赛克血管,管腔由肿瘤细胞和内皮细胞共同构成;然后进一步成熟为内皮依赖性微血管。我们的研究中,根据 Weidner[2]计数法 MVD≥22组患者远处转移及软组织浸润率显著高于MVD<22组患者;MVD≥22组患者具有更晚的Enneking分期(Ⅱ和Ⅲ期)和更高的病理分级(G2)。MVD≥22组患者5年存活率(3.17%)明显低于MVD<22组5年存活率(86.67%);且MVD≥22组患者平均OS和平均DFS(分别为27.33±1.21和11.762±0.757)显著低于MVD<22组患者(65.69±1.87和36.467±2.186)。
本研究结果显示,在108例骨肉瘤患者中有62例HIF-1α过表达,其过表达率57.41%高于骨软骨瘤32.14%(P<0.05)。HIF-1α过表达组骨肉瘤患者较HIF-1α低表达组患者具有更差的病理分级、更晚的临床分期且更易发生远处转移和软组织浸润;HIF-1α过表达组患者5年存活率(8.06%)显著低于 HIF-1α低表达组(78.26%);HIF-1α过表达组患者平均 OS(27.16±1.31)和平均 DFS(11.903±0.766)也显著低于 HIF-1α蛋白低表达组平均OS(65.09±1.80)和平均 DFS(35.739±2.252)。Spearman相关性分析显示HIF-lα过表达与 MVD及VM之间呈正相关性(P<0.01),提示在肿瘤快速生长发生缺氧时,引起 HIF-1α的积聚和活性增高,调节其下游基因的转录和表达,刺激肿瘤微血管生成、抑制肿瘤细胞凋亡、促进其转移,使肿瘤细胞适应缺氧微环境并且不断增殖、侵袭和转移[12-13]。有研究显示HIF-lα通过上调或下调肝素酶和曲古抑菌素使骨肉瘤细胞和组织中 MVD 增大[14-15],我们推测HIF-lα过表达在参与肿瘤MVD形成同时,某些具有可塑性的肿瘤细胞就会变形,形成VM通道使肿瘤细胞获得足够氧供,这也可以解释为什么具有VM结构的肿瘤细胞周围坏死较少。我们的结果和国内外很多文献报道抑制HIF-1α的表达可以阻断 VM 的形成一致[16-18],这些提示我们,缺氧很可能是诱导肿瘤细胞形成VM的一个重要始动因素。多因素分析显示MVD、VM及HIF-1α蛋白过表达、远处转移、软组织浸润和Enneking分期是影响患者的独立危险因素。
综上所述,HIF-1α过表达可能是骨肉瘤发生侵袭、转移的分子生物学基础,血管新生和VM可能是骨肉瘤发生侵袭、转移的关键过程。而HIF-1α、VM和MVD可能成为患者预后判断的病理学指标,为骨肉瘤患者的治疗提供新的靶点。
图 版 说 明
图1 VM及HIF-lα蛋白在骨肉瘤及骨软骨瘤组织阳性染色(×400)A骨肉瘤组织中骨样组织及异型细胞(HE×400);B骨肉瘤组织中VM结构(箭头所示,HE×400);C,D骨肉组织中VM及微血管(黑箭头示VM,红箭头示微血管,CD34+PAS×400);E骨肉瘤组织中 HIF-lα过表达(ElivisionTM×400);F 骨软骨瘤组织中 HIF-lα弱表达(ElivisionTM×400)。
图2 108位骨肉瘤患者VM阴性及阳性、HIF-1α蛋白过表达及低表达和MVD≥22和<22总体及无瘤生存曲线。A VM阳性及阴性组患者总体生存曲线;B VM阳性及阴性组患者无瘤生存曲线;C HIF-1α蛋白过表达阳性及阴性组患者总体生存曲线;D HIF-1α蛋白过表达阳性及阴性组患者无瘤生存曲线;E MVD≥22和<22组患者总体生存曲线;F MVD≥22和<22组患者无瘤生存曲线。
EXPLANATION OF FIGURES
Fig.1Positive staining of VM and HIF-lαprotein in osteosarcoma and osteochondroma (×400)A There were osteoid tissue and atypia tumor cells in osteosarcoma(HE×400);B There were VM in osteosarcoma(black arrow,HE ×400);C,D Positive staining of VM and micro-vessel(black arrow is VM,red arrow is micro-vessel,CD34+PAS double staining×400);E Over-expression of HIF-lαin osteosarcoma (ElivisionTM ×400);F Low-expression of HIF-lαin osteochondroma(ElivisionTM×400).
Fig.2The overall and disease-free survival curve of 108patients in VM positive or negative groups,over-or low-expression of HIF-1αprotein groups and MVD≥22or<22groups with osteosarcoma.A Overall survival curve of osteosarcoma patients with VM positive or negative group;B Disease-free survival curve of osteosarcoma patients with VM positive or negative group;C Overall survival curve of osteosarcoma patients with HIF-1αprotein over-or low-expression groups;D Disease-free survival curve of osteosarcoma patients with HIF-1αprotein over-or low-expression group;E Overall survival curve of osteosarcoma patients with MVD ≥22or<22groups;F Disease-free survival curve of osteosarcoma patients with MVD ≥22or<22groups.
[1]Meyers P,Schwartz C,Krailo M.et al.Osteosarcoma:A randomized,prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin,doxorubicin and high-dose metho-trexate.J Clin Oncol,2005,23(9):2004-2011
[2]Swinson DE,Jones JL,Cox G,et al.Hypoxia-inducible factor-1alpha in non small cell lung cancer:elation to growth factor,protease and apoptosis path-ways.Int J Cancer,2004,111(1):43-50
[3]Liu LX,Lu H,LuoY,et al.Stabilization of vascular endothelial growth factor mRNA by hypoxia-inducible factor 1.Biochem Biophys Res Commun,2002,291(4):908-914
[4]Kumada T,Tsuneyama K,Hatta H,et al.Improved 1-h rapid immunostaining method using intermittent microwave irradiation:practicability based on 5years application in Toyama Medical and Pharmaceutical University Hospital.Mod Pathol,2004,17(9):1141-1149
[5]Folberg R,Hendrix M J,Maniotis A J,et al.Vasculogenic mimicry and tumor angiogenesis.Am J Pathol,2000,156(2):361-381
[6]Frenkel S,Barzel I,Levy J,et al.Demonstrating circulation in vasculogenic mimicry patterns of uveal melanoma by confocal indocyanine green angiography.Eye(Lond),2008,22(7):948-952
[7]Ma JL,Han SX,Zhu Q,et al.Role of Twist in vasculogenic mimicry formation in hypoxic hepatocellular carcinoma cells in vitro.Biochem Biophys Res Commun,2011,408(4):686-691
[8]赵晖,顾晓萌,丛波等.恶性食管间质瘤的血管生成拟态研究.中华消化杂志,2006,26(6):405-407
[9]Wu SW,Yu L,Tao YS,et al.Expression of maspin in non-small cell lung cancer and its relationship to vasculogenic mimicry.Journal of Huazhong University Science and Technology,2012,20(3):346-356
[10]陶识博,张蕾,张云汉等.食管鳞癌中MTA1、MMP-9和MVD的表达及其临床病理意义.河南大学学报(医学版),2010,29(1):30-32
[11]Zhang S,Guo H,Zhang D,et al.Microcirculation patterns in different stages of melanoma growth.Oncol Rep 2006,15(1):15-20
[12]刘阳,杨福兵,刁正文等.葡萄糖转运蛋白-3及缺氧诱导因子1α在星形细胞瘤中的表达.中华神经医学杂志,2011,10(1):29-32
[13]赵宁辉,杨勇涛,徐蔚等.低氧诱导因子1α过表达对PC12细胞在CoCl2拟缺氧模型中凋亡的影响.中华神经医学杂志,2010,9(12):1189-1192
[14]Z CZ,Luo C,Yang Z,et al.Heparanase participates in the growth and invasion of human U-2OS osteosarcoma cells and its close relationship with hypoxia-inducible factor-1αin osteosarcoma.Neoplasma,2010,57(6):562-571
[15]Yang QC,Zeng BF,Shi ZM,et al.Inhibition of hypoxia-induced angiogenesis by trichostatin A via suppression of HIF-1αactivity in human osteosarcoma.J Exp Clin Cancer Res,2006,25(4):593-599
[16]Sun B,Zhang D,Zhang S,et al.Hypoxia influences vasculogenic mimicry channel formation and tumor invasion-related protein expression in melanoma.Cancer Lett,2007,249(2):188-197
[17]Li M,Gu Y,Zhang Z,et al.Vasculogenic mimicry:a new prognostic sign of gastric adenocarcinoma.Pathol Oncol Res,2010,16(2):259-266
[18]Hendrix MJ,Seftor RE,Seftor EA,et al.Transendothelial function of human metastatic melanoma cells:role of the microenvironment in cell-fate deterurination.Cancer Res,2002,62(3):665-668

