EZH2在胃癌组织中的表达及与Hp-L型感染关系的探讨
赵淑芳 于东红
(蚌埠医学院第一附属医院病理科;蚌埠医学院病理学教研室,安徽233004)
EZH2是PcG(polycomb group)基因家族的核心成员,是果蝇zeste基因增强子的人类同源基因。EZH2通过抑制染色质中的靶基因控制细胞的记忆系统,从而促进细胞的增殖和扩散,与肿瘤的恶性程度和患者的预后密切相关[1-2]。幽门螺杆菌L型(Helicobacter pylori-L)是幽门螺杆菌(Helicobacter pylori)的细胞壁缺陷型。Hp可在胃液、胆汁、溶菌酶、抗生素等因素作用下发生细胞壁缺陷而形成Hp-L型。因多为球形幽门螺杆菌,故又称球形。已知Hp-L型的生物学性状和致病性与原菌有相似之处,也有明显不同,且与胃癌的发生有一定关系。目前国内外对EZH2蛋白在胃癌组织中的表达及意义以及EZH2与幽门螺杆菌及其L型感染相关性的研究报道较少,为此我们应用免疫组织化学、革兰染色和RT-PCR方法检测胃癌组织及其切缘组织中EZH2蛋白的表达、Hp及其L型感染的情况,旨在探讨胃癌EZH2的表达及临床意义,以及EZH2与Hp-L型感染的相关性。
材料和方法
1.一般资料
1.1收集2012年2月至2012年5月胃癌手术的新鲜标本30例(有转移的)及新鲜的远端正常组织(距肿瘤边缘组织约5cm处),术前未行放、化疗治疗,所有胃癌组织均在离体30min内切取,其中男性21例,女性9例,年龄55-79岁,中位年龄64岁,所有患者临床资料完整,病理资料均由2名病理主治医师复习。
1.2收集蚌埠医学院病理学教研室2010年12月-2011年6月外检档案中胃癌手术标本80例,其中男性60例,女性20例;年龄34-87岁,中位年龄60岁。组织学分级Ⅰ级+Ⅱ级(高分化+中分化)45例,Ⅲ级(低分化+未分化)35例;有淋巴结转移者13例,无淋巴结转移者67例;癌组织未浸润至浆膜层11例,浸润至浆膜层69例;按照国际抗癌联盟(UICC)公布的TNM分期标准(2002年,第6版)进行分期:Ⅰ-Ⅱ期44例,Ⅲ-Ⅳ期36例。在该组病例中,随机选取30例胃癌两端切缘组织为正常对照。所有病例均满足如下标准:1)组织块按常规经10%中性福尔马林溶液固定、石蜡包埋,4μm连续切片数张;2)所有病例术前均未接受放疗或化疗;3)外科治疗均为根治性切除,存在无瘤切缘;4)病理诊断依据第4版WHO胃癌组织学分类标准。除做常规HE染色外,余做革兰染色、免疫组织化学染色。EZH2(多克隆)购于北京中杉金桥生物技术有限公司,ElivisionTMplus免疫组化试剂盒,购自福州迈新生物技术开发有限公司。Trizol Reagent(Invitrogen)、逆转录试剂盒、Marker、DEPC(Sigma)、琼脂糖、TBE等购自合肥志宏生物技术有限公司,EZH2基因引物、β内参引物由上海生工生物工程技术服务有限公司设计合成。
2.方法
2.1EZH2检测
2.1.1采用免疫组化Elivision法:组织切片进行微波抗原修复,具体操作按说明书方法进行。用已知阳性片为阳性对照;用PBS替代一抗为阴性对照。结果判断:EZH2阳性显色以癌细胞胞核呈棕黄色颗粒为主,双盲法对染色结果进行评估,每例随机观察5个高倍视野(×400),每高倍视野计数100个瘤细胞。采用半定量积分法,将染色强度分为3级:无着色1分,浅着色2分,棕黄色3分;按阳性瘤细胞的百分比分3级:≤25%为Ⅰ级记1分,26%-75%为Ⅱ级记2分,≥76%为Ⅲ级记3分。每张切片最后的得分为两次评分的乘积(1-9分),≥3分为阳性,<3分为阴性。
2.1.2RT-PCR 总 RNA 提取:取50-100mg组织匀浆后用Trizol提取液提取总RNA,取部分总RNA用紫外分光光度仪A260/A280,要求全部样本 OD260/OD280比值在1.8-2.0之间;cDNA 制备:操作过程参考逆转录试剂盒说明书进行,总RNA加入量为0.1-5μg,反应终体积20μl;PCR扩增:EZH2 基 因 上 游 引 物 5′-TCATGCAACACCCAACACTTA-3′,下 游 引 物 5′-CACCACTCCACTCCACATTCT-3′;β-actin 上 游 引 物 5′-CTGGGACGACATGGAGAAAA-3′,下 游 引 物 5′-AAGGAAGGCTGGAAGAGCGC-3′,反 应 条 件:95℃预变性5min后,以94℃45s变性,EZH2退火温度57.1℃,β-actin退火温度55.6℃,各进行45s,72℃延伸45s,反应35循环,最后一轮延伸7min。预期扩增产物大小分别为407bp和564bp。
2.1.3PCR产物判定:取5μl扩增产物用1.5%琼脂糖凝胶电泳(电压按100V,电流60mA),溴化乙锭(EB)显色,结果在GIS凝胶图像处理系统中拍摄记录,并使用图像分析软件行灰度扫描作半定量分析,以EZH2的吸光度值与β-actin吸光度值的比作为EZH2的基因表达半定量值。
2.2Hp-L型检测
革兰染色检测Hp-L型感染,油镜(10×100)观察并计数,每例随机观察10-15个视野,取平均数,Hp-L型和Hp平均数≥20为阳性,<20或未查见Hp-L型和Hp为阴性,Hp-L型形态多样,大小不等,有巨形体、圆球体等。革兰染色阴性呈红色,阳性呈紫红色,Hp-L型大多数呈革兰染色阴性(红色),少数Hp-L型革兰染色阳性(紫红色);Hp则呈螺旋形、“S”形或海鸥形,革兰染色阴性(红色)。革兰染色L型细菌检出和免疫组化Hp-L型抗原表达同时阳性者定为Hp-L型感染阳性。每例标本同时用免疫组化法检测Hp-L型抗原的表达,Hp-L型多克隆抗体由蚌埠医学院微生物教研室制备,工作浓度为1∶100。用已知Hp-L型阳性切片作为阳性对照,用PBS替代一抗为阴性对照。Hp-L型免疫组化的阳性标准为:胃癌细胞、正常胃黏膜上皮细胞及间质巨噬细胞的胞质或胞膜着棕黄色为Hp-L型阳性,常呈细颗粒状,不着色为阴性。革兰染色Hp-L型检出和免疫组化Hp-L型抗原表达同时阳性者定为Hp-L型感染阳性。
2.3统计学处理
采用SPSS17.0统计软件对相关的数据资料进行统计学处理:计数等级资料采用t检验、χ2检验和单因素方差分析,P<0.05为差异有统计学意义。
结 果
1.胃癌的EZH2表达及与临床病理因素的关系
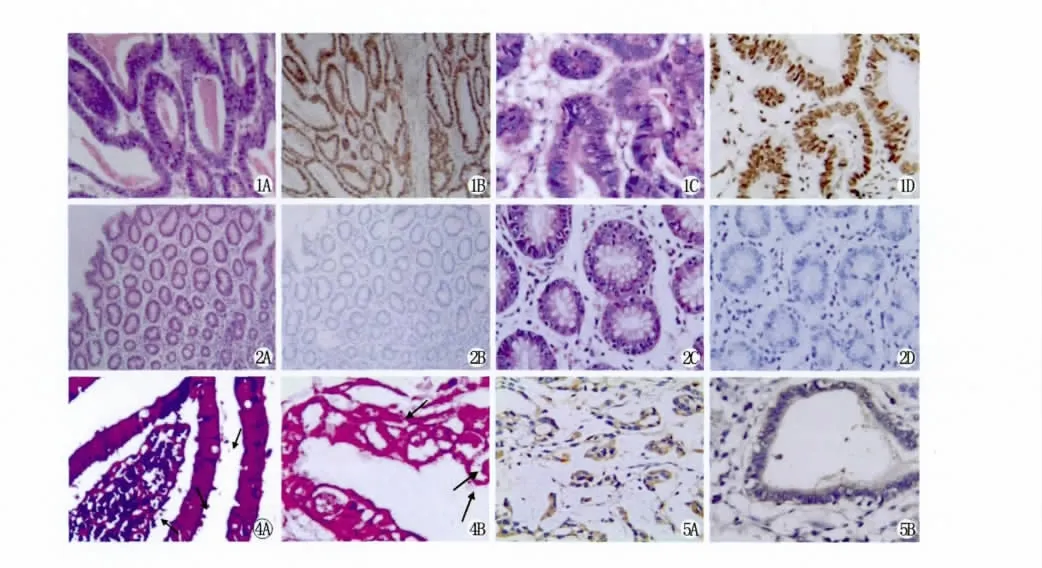
EZH2蛋白在胃癌中的表达阳性率为62.5%(50/80);显著高于对照组(8/30,26.7%),两者比较具有统计学意义(P<0.01,表1),经χ2检验,胃癌组织中EZH2的表达与患者的年龄、性别、肿瘤细胞分化程度无关,而与肿瘤大小、浸润深度、淋巴结转移和临床分期相关(均P<0.05,表2,图1,2)。

表1 不同组织中EZH2蛋白的表达情况Table 1 The expression of EZH2in different gastric tissues
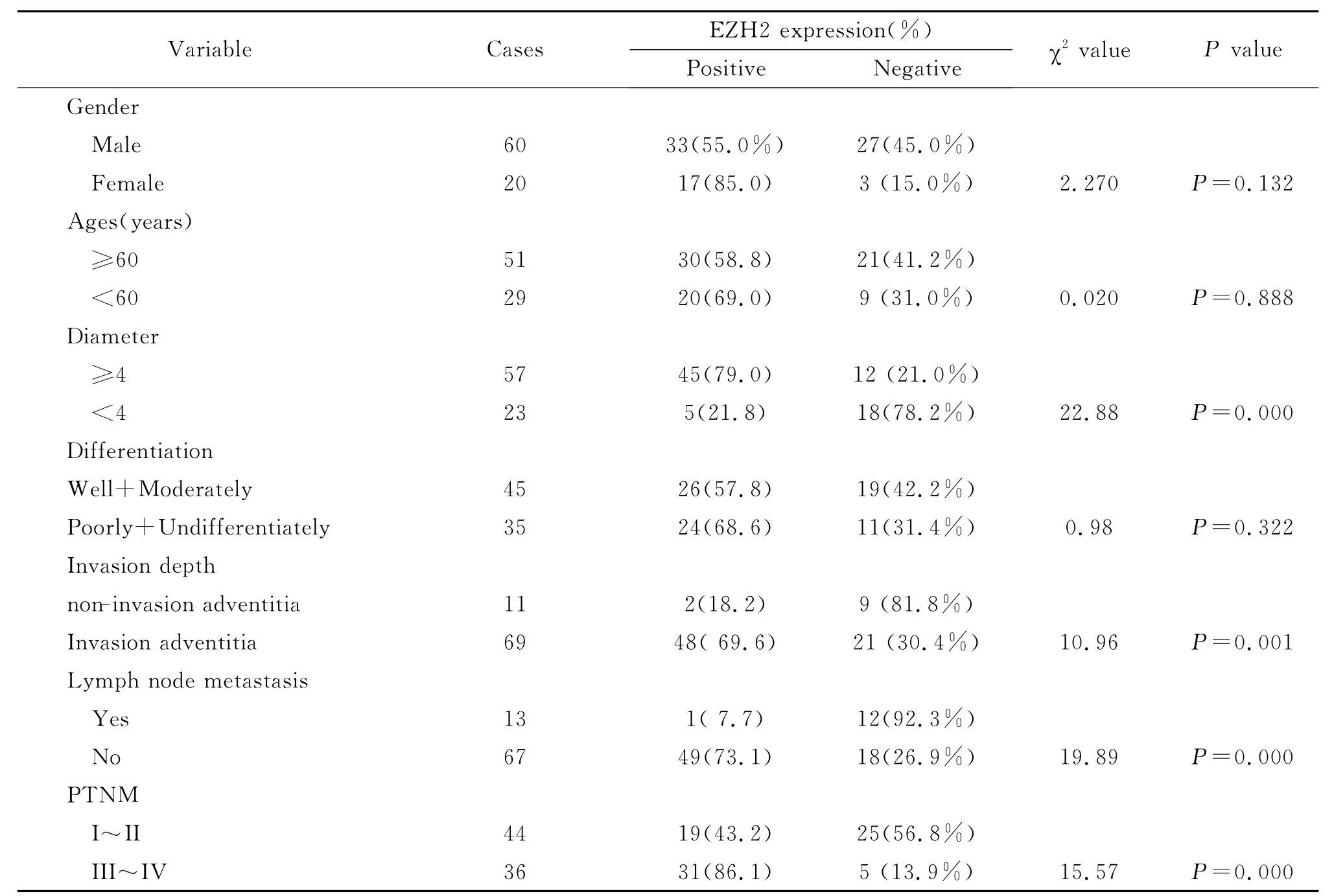
表2 胃癌组织EZH2蛋白表达与临床病理学特征的关系Table 2 Relationship between the expression of EZH2and clinical pathological characteristics in gastric carcinom
2.EZH2扩增产物与内参基因电泳结果
胃癌组织和对照组组织中均可在凝胶成像仪下见到扩增的EZH2条带(407bp处),但肿瘤组织的较对照组组织稍清楚(见图3),并同时用电泳β-actin内参(564bp处)和DNA标准分子量标记物(DNA Marker)作为参照和标尺。经过凝胶成像分析仪扫描后,对30例胃癌患者EZH2/β-actin电泳条带吸光度比值(mRNA水平相对值一目的条带吸光度值/内参β-actin条带吸光度值),进行统计学分析,胃癌组织中EZH2mRNA的表达量为0.9117±0.0765,远端正常对照组织的表达量0.7535±0.0716,胃癌组织中EZH2mRNA显著高于对照组,差异具有统计学意义(P<0.01)。
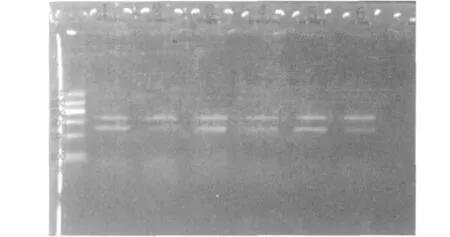
图3 EZH2mRNA的琼脂糖电泳图(1、3、5为胃癌组,2、4、6为对照组)Fig.3Agarose electrophoresis of EZH2mRNA (1、3、5for the GC group,2、4、6for the controls group)
3.胃癌中Hp和Hp-L型的检测结果及分布
胃癌组中有63例革兰染色检出L型,仅7例同时检出L型和 Hp,检出率分别为78.8%(63/80)和8.8%(7/80)。免疫组织化学法 Hp-L型抗原表达阳性见图5,其阳性率为73.8%(59/80),与革兰染色L型检出的阳性率具有一致性(P>0.05)。80例胃癌组织中Hp-L型阳性(即革兰染色L型检出阳性和免疫组化Hp-L型抗原表达同时阳性)的病例数为57例,其阳性率为71.3%。对照组中有10例革兰染色同时检出Hp和L型,免疫组化Hp-L型抗原表达阳性为7例,两种方法检测同时阳性(即Hp-L型阳性)的有7例,阳性率为23.3%(7/30),Hp检出阳性率为30%(9/30),经统计学处理与Hp-L型检出阳性率差异无显著性(P>0.05)。从表3可见胃癌组中Hp-L型阳性率(71.3%)高于对照组(23.3%),两者有统计学意义(P<0.01)。观察革兰染色切片发现,Hp-L型主要存在于胃癌癌巢和癌旁,癌细胞的胞浆内也可查见,癌巢的坏死处几乎无Hp-L,正常组织内也较少见。Hp则主要存在于正常组织内,呈螺旋形,“S”形和海鸥形,癌巢、癌旁较少,癌巢的坏死处几乎无Hp。Hp-L型大部分是革兰染色阴性,多数呈圆球形,可在癌巢、癌间质或黏膜层聚集成堆,也可散在分布于其中,也可见到L型黏附于癌细胞表面的现象(图4)。
4.胃癌中Hp-L型感染与EZH2蛋白表达的关系
从表4可见,胃癌Hp-L型阳性组的EZH2表达明显高于其Hp-L型阴性组,应用Spearman秩相关检验,两者之间呈正相关(r=0.250,P<0.05)。
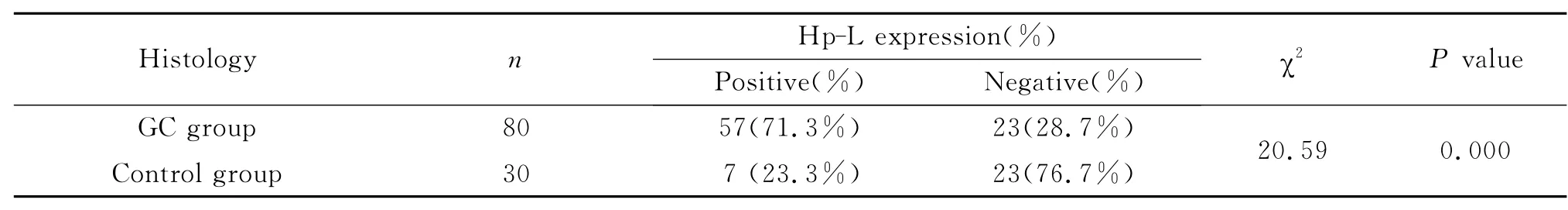
表3 不同组织中Hp-L检测情况Table 3 The result of Hp-L detected in different gastric tissues
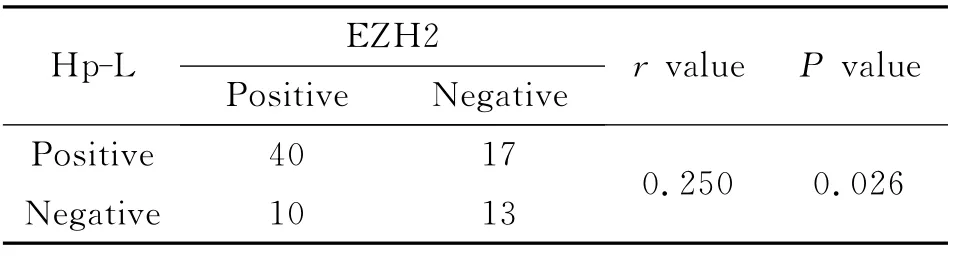
表4 80例胃癌组织中Hp-L感染与EZH2蛋白表达之间的关系Table 4 The relativity between Helicobacter pylori L-formt infection and he expression of EZH2in80samples of gastric carcinoma
讨 论
EZH2作为PcG(polycomb group)基因家族的核心成员,是果蝇zeste基因增强子的人类同源基因。EZH2与细胞生长调节相关,通过抑制染色质中的靶基因而调节细胞增殖,作为转录阻遏因子,控制细胞的记忆系统。近年研究表明,EZH2基因的过表达与细胞的过度增殖乃至肿瘤发生有关。Croonquist[3]等报道显示,在多种实体瘤中存在着过表达并与肿瘤的生物学行为及预后有关,故认为EZH2基因是一个候选的癌基因。EZH2能够促进细胞增殖、肿瘤细胞扩散,在许多恶性肿瘤中存在不同程度的高表达。包括骨髓肿瘤、非霍奇金淋巴瘤、前列腺癌、膀胱癌、乳腺癌、大肠癌、肝癌等,并与肿瘤 的 侵 袭 转 移 和 预 后 有 关[1-2]。 有 研 究 报 道[4-5]EZH2可促进胃癌细胞增殖,可以推测,EZH2参与胃癌发生、发展的机制之一可能与其促进增殖能力有关,这与恶性肿瘤中的研究结果一致。Chen等[6]研究显示,EZH2在胃癌组织中的表达可达到56.6%,并且肿瘤的大小、浸润深度、淋巴结转移、侵犯血管致血运转移及临床分期都可影响其表达水平。Mccabe等[7]研究发现,胃癌有无远处转移和EZH2表达水平的高低有关,玄东春[8]等研究显示,EZH2表达水平与胃癌的进展有关,进展期胃癌组织中EZH2的表达水平明显高于早期胃癌。本研究采用免疫组化法检测了80例胃癌组及30例对照组的EZH2蛋白表达情况,应用RT-PCR检测30例新鲜胃癌组及30例对照组的EZH2mRNA表达,发现EZH2在胃癌组中表达明显增高,而且EZH2表达增高与胃癌的浸润深度、淋巴结转移、分化程度和TNM分期有关,与文献结果基本一致。提示EZH2可能参与了胃癌的发生、发展,并且对胃癌的预后评估有很大帮助。
幽门螺杆菌(Hp)已被公认为慢性胃炎、消化性溃疡的致病因素,也与胃癌的发生密切相关。Hp主要定植于人胃黏膜,在不利于其生长繁殖的环境中易发生细胞壁缺陷而形成幽门螺杆菌L型(Hp-L),Hp-L型对环境抵抗力强,是Hp适应外界不良条件的一种自我保护形式[9,10],Hp-L型的生物学性状与原菌相比也有很多相似处,Figueroa等[11]用免疫印迹证明Hp-L型可能与原菌一样具有免疫功能。进一步研究证明,Hp-L型抗原与原菌相比仅有量的减少,或仅有某些细胞壁抗原成分的缺失而无质的变化,甚至比原菌的致病性要强。Cellini等[12]用 Hp-L 型感染BALB/c小鼠,2周后可见鼠胃内有Hp-L型的定居,1个月后引起胃组织学改变,并使小鼠产生抗Hp的抗体。宣兰兰等研究[13]证实Hp-L型可以抑制胃癌细胞的凋亡,从而促进肿瘤的发生。周蕾等[14]对120例胃癌进行 Hp-L型检测发现,胃癌组 Hp-L型检出率(68.33%),结果提示Hp-L型感染是影响胃癌侵袭和转移的重要因素之一。本研究对80例胃癌、30例切缘对照胃黏膜进行Hp-L检测,结果有57例胃癌检出Hp-L,15例同时检出Hp和L型,仅5例单纯Hp检出阳性,说明Hp在患者体内易发生L型变异,多数是以Hp-L型的形式存在。Chan等[15]研究也发现,胃癌组织中Hp通常以L型的形式存在,且在癌变组织中的检出量远高于溃疡病患者。本研究革兰染色切片在油镜下均见到Hp-L型位于胃黏膜的浅表胃小凹内、胃癌腺体内及胃癌细胞内,说明Hp-L型在胃癌的发生和进展过程中可能以一种播散侵入的方式而定植,这一结果与胃溃疡中的Hp-L型感染情况相近[17]。
我们对Hp-L型感染和EZH2表达的关系进行研究和分析,发现Hp-L型阳性组中EZH2表达阳性的例数较Hp-L型阴性组中EZH2表达阳性的例数明显增多,数据采用卡方检验分析P<0.05,两组之间的差异有统计学意义,说明Hp-L型感染可促进胃癌组织中EZH2的表达,并且是胃癌发生的一个危险因素。至于EZH2和Hp-L型具体致癌机制及二者之间的相互作用机理有待进一步研究。
图 版 说 明
图1 EZH2蛋白在胃腺癌中的表达阳性,主要表达于细胞核(A,HE×100;B,Elivision×100;C,HE×400;D,Elivision×400)
图2 EZH2蛋白在切缘正常组织中的表达阴性,细胞核不着色(A,HE×100;B,Elivision×100;C,HE×400;D,Elivision×400)
图4 正常胃组织内的Hp及Hp-L型(A)及胃腺癌中的Hp-L型(B)。Hp呈螺旋形、“S”形或海鸥形。Hp-L型位于癌细胞内及癌细胞旁,呈圆球状,有圆球体、巨形体和原生小体等(箭头)(革兰氏×1000)
图5 Hp-L型抗原在胃腺癌中的阳性表达,主要表达于细胞浆(Elivision×400)
EXPLANATION OF FIGURES
Fig.1Positive expression of EZH2in the nuclei of adenocarcinoma cancerous tissue(A,HE×100;B,Elivision×100;C,HE×400;D,Elivision×400)
Fig.2negative expression of EZH2in the nuclei of normal gastric mucosa tissues(A,HE×100;B,Elivision×100;C,HE×400;D,Elivision×400)
Fig.4Hp and Hp-L form in Normal and adenocarcinoma gastric tissue of Hp were spira,“S”-shaped or seagull shape,Hp-L form cylindrical and spherical,the sphere,giant body and native body(arrow)(Gram stain×1000).
Fig.5Positive expression of Helicobacter pylori L-form in gastric adenocarcinoma(Elivision×400)
[1]Yoon KA,Gil HL,Han J.Genetic poly morphisms in the polycomb group gene EZH2and the risk of lung cancer.J Theorac Oncol,2010,5(1):10-16
[2]Burdach S,Plehm S,Unland R.Epigenetic maintenance of stemness and manlignancy in peripheral neuroectodermal tumors by EZH2.Cell Cycle,2009,8(13):1991-1996
[3]Croonquist PA,Van Ness B.The polycomb group protein enhancer of zeste homolog 2(EZH2)is an oncogene that influences myeloma cell growth and the mutant ras phenotype.Oncogene,2005,24(41):6269-6280
[4]Juan AH,Kumar RM,Marx JG.Mir-214-dependent regulation of the poly-comb protein Ezh2in skeletal muscle and embryonic stem cells.Mol Cell,2009,36(1):61-74
[5]Tanq H,Chen F,Tan Q.Regulation of CD1lb transcription by decreasing PRC2and increased acH4level during ATRA-induced HL-60differentiation.Acta Biophys Sin,2009,41(7):588-593
[6]Chen H,Gu X,Su H.Polycomb protein Ezh2regulates pancreatic beta-cell Ink4a/Arf expression and regeneration in diabetes mellitus.Genes Dev,2009,23(8):975-985
[7]Mccabe MT,Brandes JC,Vellino PM.Cancer DNA mehtylation:molecular mechanisms and clinical implications.Clin Cancer Res,2009,15(12):3927-3937
[8]玄东春,崔演.胃癌组织中EZH2和p53蛋白的表达及临床意义.临床与实验病理学杂志,2011,27(11):1161-1164
[9]于东红,承泽农,贾继辉等.食管癌幽门螺杆菌L型感染与其血管形成的关系.中华肿瘤杂志,2003,25(1):51-54
[10]余菲菲,朱苹,史碧山等.水中幽门螺杆菌的球形变异及其致病力.中华微生物和免疫学杂志,2001,21(4)395-396
[11]Figueroa G,Faundez G,Tronceso M,et al.Immunoglobulin G antibody response to infection with coccoid forms of Helicobacter pylori.Clin Diagn Lab Immunol,2002,9(5):1067-1071
[12]Cellini L,Allocati N,Angelucci D,et al.Coccoid Helicobacter pylori not culturable in vitro reverts in mice.Microbio Immunol 1994,38 (11):843-850
[13]宣兰兰,于东红,承泽农等.幽门螺杆菌L型感染抑制胃癌细胞凋亡的实验研究.癌变.畸变.突变,2009,21(2):93-97
[14]周蕾,于东红,魏军等.胃癌组织中幽门螺杆菌L型感染及骨桥蛋白检测的意义.中国组织化学与细胞化学,2011,20(1),36-39
[15]Demetrick DJ,Zhang H,Beach DH,et al.Chromosomal mapping of the genes for the human CDK2/cyclinA-associated proteins p19(SKP1Aand SKP1B)and p45S(KP2).Cytogenet Cell Genet,1996,73(1/2):104-107

