葡聚糖的环氧化修饰与表征
杨梅竹,薛亚楠,蔡 宁,齐国斌,张 寒,喻发全
(武汉工程大学化工与制药学院 绿色化工过程教育部重点实验室,湖北 武汉430073)
葡聚糖与生物组织具有良好的生物相容性,无毒,对温度和pH值的稳定性好[1],经过化学改性后,可作为一种理想的药物载体材料。葡聚糖的环氧化是在葡聚糖的结构单元中引入了环氧基团。环氧化葡聚糖由于引入了环氧基团,不仅水溶性得到提高,而且能够很好地与带有羟基(-OH)、氨基(-NH2)、羧基(-COOH)或巯基(-SH)官能团的药物、蛋白质、DNA等[2-4]结合,形成具有特殊用途的药物前驱体、药物载体、基因载体等[2-6]。
作者在此以葡聚糖(Dex)为原料、1,4-丁二醇二缩水甘油醚(BDE)为双端带有环氧基团的环氧化试剂,在碱性条件下将葡聚糖分子链修饰上环氧基团,并考察了投料比、pH值、反应时间等条件对环氧取代度的影响;通过改变反应条件对环氧取代度进行调控,得到环氧取代度可调的环氧化葡聚糖,为葡聚糖进一步功能化修饰及应用奠定了基础。
1 实验
1.1 试剂与仪器
葡聚糖(20kDa),分析纯,阿拉丁试剂有限公司;1,4-丁二醇二缩水甘油醚,分析纯,华威锐科试剂有限公司;氢氧化钠(NaOH)、硼氢化钠(NaBH4)、浓盐酸(HCl)、五水合硫代硫酸钠(Na2S3O3·5H2O)、酚酞,分析纯,国药集团化学试剂有限公司;重水(D2O),青岛腾龙微波科技有限公司。所有试剂均直接使用,未经纯化处理。
透析袋(截留分子量Mw=3500),上海晨易生物有限公司;Heal Force SUPER NW型系列超纯水仪,力康科技有限公司。
1.2 环氧化葡聚糖的合成方法
按设定的反应条件,将一定量的葡聚糖溶解到0.6mol·L-1的NaOH溶液(含2mg·mL-1NaBH4)中,搅拌下将上述溶液经注射泵缓慢加入到过量的BDE溶液中,37℃下搅拌反应一定时间。反应结束后,将反应混合液转入透析袋中,室温透析3d,所得透析液经冷冻干燥后得到目标产物。反应式如图1所示。
1.3 环氧化葡聚糖的结构表征
以重水(D2O)为溶剂,用Mercury VX-300型核磁共振波谱仪在300MHz下对环氧化葡聚糖进行核磁共振氢谱(1HNMR)的测定。

图1 葡聚糖的环氧化反应Fig.1 Epoxidation of dextran
1.4 分析与检测
1.4.1 环氧化葡聚糖分子量及其分布的测定
采用多角度激光光散射(MALLS)和尺寸排阻色谱(SEC)联用分析系统(MALLS-SEC)测定环氧化葡聚糖的分子量及其分布。其中尺寸排阻色谱使用Waters-2690DHPLC装备Ultrahydrogel 120和250柱,流动相为PBS缓冲溶液(0.5mol·L-1,pH值8.0),流速为0.6mL·min-1,柱温为25℃。光散射数据由Wyatt DAWN DSP型多角度光散射检测仪和Waters 2410型示差折光检测器双检测系统获得。
1.4.2 环氧化葡聚糖环氧取代度的测定
参照文献[7]测定产物中环氧基团的含量,进而对葡聚糖的环氧取代度进行表征:

1.4.3 环氧化葡聚糖在水中稳定性的测定
将样品配制成0.01mol·L-1的水溶液,4℃静置,通过检测环氧基团随时间的变化情况考察其在水中的稳定性。
2 结果与讨论
2.1 环氧化葡聚糖的结构表征
原料葡聚糖和产物环氧化葡聚糖的核磁共振氢谱见图2。
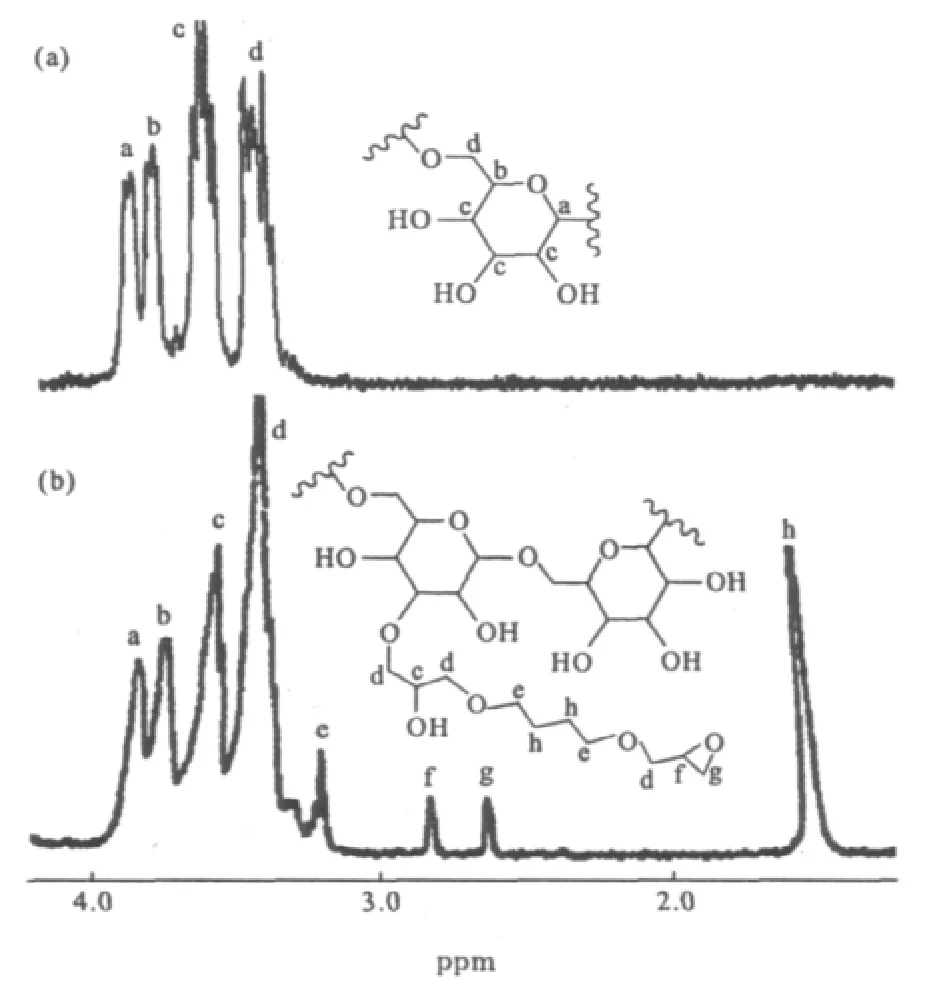
图2 葡聚糖(a)和环氧化葡聚糖(b)的核磁共振氢谱(D2O为溶剂)Fig.2 1 HNMR Spectra of dextran(a)and epoxy-activated dextran(b)using D2O as solvent
由图2可以看出,3.4~4.0ppm处的4个峰(峰a~d)分别对应于葡聚糖骨架上的质子信号峰;而产物核磁谱图中的3.2ppm(峰e)、2.8ppm(峰f)、2.6ppm(峰g)与1.5ppm(峰h)处则出现了不同于葡聚糖骨架的特征峰,它们分别归属于侧链中与氧原子相连的亚甲基侧链末端环氧基团中的次甲基与亚甲基以及侧链中亚甲基的质子信号峰。表明环氧基团被成功地引入到葡聚糖的侧链中,并且由于BDE侧链的引入使3.4ppm(峰d)处信号峰强度增强。通过计算侧链末端环氧基团中的特征信号峰(峰g或f)与葡聚糖骨架单元中特征信号峰(峰a或b)的积分面积比可以得到产物的环氧取代度。同时,由于交联副产物的生成,使得峰h的积分面积增大。通过计算产物中峰h与峰g或f的积分面积比可以得到产物中交联产物的比例。结果发现,该产物中约有25%交联副产物,使得侧链的有效环氧化率有所降低。
2.2 环氧化葡聚糖的分子量及其分布(表1)

表1 葡聚糖和环氧化葡聚糖的分子量及其分布Tab.1 Molecular weight and its distribution of dextran and epoxy-activated dextran
由表1可以看出,由于侧链基团的引入,产物环氧化葡聚糖的分子量相对于原料葡聚糖而言有所增加,分子量分布宽度也有所变大;且对应的GPC淋出曲线均呈单峰分布(图略),证明所得产物中没有产生大的交联物。
2.3 反应条件对环氧取代度的影响
2.3.1 投料比(Dex与BDE的摩尔比,下同)对环氧取代度的影响
在碱性条件下,醇羟基引发BDE上的环氧基团发生开环反应;再将活性环氧基团引入到葡聚糖的侧链中,得到环氧化葡聚糖。通过采用过量BDE的方法,减少交联葡聚糖副产物的生成。
在37℃、不同pH值条件下反应4h得到的环氧化葡聚糖的环氧取代度随投料比的变化见图3。
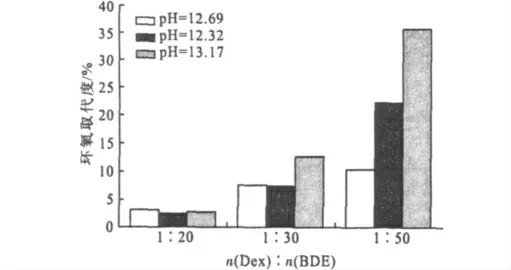
图3 不同pH值条件下,投料比对环氧取代度的影响Fig.3 Effect of molar ratio of Dex to BDE on epoxy degree at different pH values
由图3可以看出,随着BDE用量的增加,产物的环氧取代度明显升高。这是因为,BDE两端各带有一个环氧基团,为保证葡聚糖侧链上引入环氧基团,BDE上只能有一端环氧基团参加反应,因此,BDE的用量要过量。当BDE用量较少时,两端环氧基团均参加反应的几率增大,从而使交联副产物的比例提高,环氧化目标产物的量相应减少;增加BDE用量,反应体系中环氧基团过量程度提高,交联反应的几率就会减小,环氧取代度相应升高。因此,通过增加BDE的用量,可以有效提高产物的环氧取代度,降低交联几率。综合考虑,确定适宜的投料比n(Dex)∶n(BDE)为1∶30。
2.3.2 pH值对环氧取代度的影响
在37℃、投料比n(Dex)∶n(BDE)=1∶30的条件下,反应4h得到的环氧化葡聚糖的环氧取代度随pH值的变化见图4。

图4 pH值对环氧取代度的影响Fig.4 Effect of pH value on epoxy degree
由图4可以看出,环氧取代度随pH值的增大先升高后降低;在pH值为12.6~12.7时,环氧取代度达到最高。这是因为,增大pH值,有利于诱导环氧基的开环,与葡聚糖的反应变得容易,环氧取代度相应升高;但进一步增大pH值,可使剩余的环氧基团相继开环,甚至可进一步诱导葡聚糖间的交联,反而导致环氧取代度降低。因此,确定适宜的pH值为12.6。
2.3.3 反应时间对环氧取代度的影响
在37℃、n(Dex)∶n(BDE)=1∶30、pH值为12.6的条件下,反应不同时间(2~48h)得到的环氧化葡聚糖的环氧取代度见图5。

图5 反应时间对环氧取代度的影响Fig.5 Effect of reaction time on epoxy degree
由图5可以看出,环氧取代度随反应时间的延长先升高后降低;在反应12h时,环氧取代度达到最高;12h以后,由于反应基本完成,随反应时间的继续延长,产物侧链中的环氧基团发生进一步开环反应,使交联反应的几率增大,从而导致环氧化目标产物不断减少,环氧取代度相应降低。因此,确定适宜的反应时间为12h。
2.4 环氧化葡聚糖在水中的稳定性(图6)

图6 环氧化葡聚糖在4℃水中的稳定性Fig.6 The stability of epoxy-activated dextran in water at 4℃
由图6可以看出,30d内环氧化葡聚糖中环氧基团的含量基本保持不变,说明低温下(4℃)环氧化葡聚糖在水中的稳定性良好。
3 结论
以葡聚糖(Dex)为原料、1,4-丁二醇二缩水甘油醚(BDE)为环氧化试剂,在碱性条件下,通过BDE的开环反应得到环氧基团修饰的环氧化葡聚糖,并且通过改变反应条件可得到取代度可控、稳定的环氧化葡聚糖,在37℃、投料比n(Dex)∶n(BDE)=1∶30、pH=12.6、反应时间为12h的条件下,环氧取代度高达16%,且4℃的低温下环氧化葡聚糖在水中的稳定性良好。
[1]罗成果.改性葡聚糖和蛋白质作为高分子功能材料的研究[D].郑州:郑州大学,2006.
[2]Torres P,Batista-Viera F.Immobilization of β-galactosidase from Bacillus circulans onto epoxy-activated acrylic supports[J].Journal of Molecular Catalysis B:Enzymatic,2012,74(3-4):230-235.
[3]Torres P,Batista-Viera F.Improved biocatalysts based on Bacillus circulansβ-galactosidase immobilized onto epoxy-activated acrylic supports:Applications in whey processing[J].Journal of Molecular Catalysis B:Enzymatic,2012,83:57-64.
[4]Assem E,Tania Y,Ibrahim S,et al.A one step separation of immunoglobulin G from bovine serum by pseudobioaffinity chromatography on histidine grafted to epoxy activated sepharose[J].Biotechnology and Bioprocess Engineering,2012,17(3):584-590.
[5]Gómez S A,Alcalde M,Yates M,et al.Immobilization of dextransucrase from Leuconostoc mesenteroides NRRL B-512Fon Eupergit C supports[J].Biotechnol Prog,2004,20(5):1414-1420.
[6]Hajdukiewicz J,Boland S,Kavanagh P,et al.An enzyme-amplified amperometric DNA hybridisation assay using DNA immobilised in a carboxymethylated dextran film anchored to a graphite surface[J].Biosensors and Bioelectronics,2010,25(5):1037-1042.
[7]Sundberg L,Porath J.Preparation of adsorbents for biospecific affinity chromatography:I.Attachment of group-containing ligands to insoluble polymers by means of bifunctional oxiranes[J].Journal of Chromatography,1974,90(1):87-98.

