选择性椎-基底动脉造影和经颅多普勒对兔蛛网膜下腔出血脑血管痉挛的评价
黄德章 李壮志 张学军 王 亮 潘 杰 王雅栋
(威海市立医院神经外科,山东 威海 264200)
对于蛛网膜下腔出血(SAH)后脑血管痉挛(CVS)的研究主要通过动物实验,而对动物CVS的检测手段主要是选择性脑血管造影(DSA)、经颅多普勒(TCD),但因实验动物如兔体积小,血管细,操作有一定难度,限制了其在动物实验中的应用,另外有关TCD与DSA在检测动物CVS方面的相关性研究较少,为此,我们通过枕大池二次注血法[1]制成兔SAH后CVS模型来研究DSA和TCD对兔SAH后CVS的检测方法和效度,现报道如下。
1 材料与方法
1.1实验动物分组及模型制备 新西兰大白兔20只(山东大学实验动物中心提供),雄性,体重3.0~3.5 kg,分为实验组15只,对照组5只。适应性喂养1周后,用10%水合氯醛(3 ml/kg,腹腔注射)和速眠新(0.2 ml/kg,肌肉注射)麻醉。采用枕大池二次注血的方法制成兔SAH后CVS模型,动脉血来自耳中央动脉(0.5 ml/kg),对照组注入生理盐水(0.5 ml/kg),两次注血/生理盐水间隔48小时,第二次注血/生理盐水后24小时为术后第1天,以此类推。
1.2选择性椎-基底动脉造影 实验组15只兔分别在首次注血前1天和术后3天、5天经股动脉入路行选择性椎-基底动脉造影。兔麻醉(10%水合氯醛,3 ml/kg,腹腔注射)后,仰卧位固定于操作台上,腹股沟区备皮,常规消毒铺巾,在无菌条件下行右侧腹股沟斜行切口3~4 cm,钝性分离,暴露并游离右侧股动脉约2 cm,放置2根4号线分别置于游离动脉两端,动脉下面放置一宽刀柄将其稍向上挑起,用眼科剪在动脉前壁上做一小口,将事先准备好的带有SilverSpeed 0.014微导丝的22G针头从切口上穿入动脉内,进微导丝,撤出刀柄,稍提起近端的4号线(止血),然后撤出空针头,置入Prower-14微导管。在X光透视下,微导管在微导丝的导引下依次经髂动脉、腹主动脉、降主动脉、主动脉弓导入左锁骨下动脉,推注0.5 ml造影剂(碘海醇)判断左侧锁骨下动脉及椎动脉的走行,并制作Road-mapping(示踪图)。然后在Road-mapping指引下微导管与微导丝相互配合,将微导管插至左侧椎动脉,拔出微导丝,微导管内注入0.5 ml肝素生理盐水,用l ml注射器低压推注1 ml造影剂,行椎动脉内血管造影,每秒3帧,持续8秒,造影结束后拔出微导管,在穿刺部位两侧分别结扎股动脉,后两次造影穿刺部位在对侧股动脉和任意一侧股动脉稍高的位置。对照组分别在注入生理盐水前1天和术后3天、5天按上述方法造影,所用微导管、微导丝、空针头都经肝素生理盐水浸泡冲洗。
1.3TCD 采用VIASYS Healthcare公司生产CompanionⅢ彩色TCD(频谱标度为cm/s)。SAH组15只兔分别在首次注血前1天和术后1、2、3、4、5、6、7天行TCD检测基底动脉血流速度。兔麻醉(10%水合氯醛,3 ml/kg,腹腔注射)后,俯卧位置于兔操作台上,摆体位使其充分暴露颈部且不影响其呼吸,头颈部备皮,将2 MHz连续波探头置于枕外结节下2 cm中线旁,取样容积10 mm,探测深度(27±3)cm,功率为107 mW/cm2,检测基底动脉的血流信号。记录血流频谱,计算动脉平均流速(Vm)。
当下,随着互联网5.0时代的到来,家电行业正在飞速的发展。各种款式多样、功能丰富的新产品层出不穷,导购策略也是纷繁芜杂。虽然消费者们拥有了更多家电产品的选择空间,但在无形中的选购难度也在大大增加。由此,“嘉电”评测项目应运而生。
根据以上结果认为:兔SAH后TCD测得的Vm>33 cm/s则认为出现了CVS,Vm>40 cm/s则肯定发生了CVS,我们按照以上参考标准运用配对四格表资料χ2检验进一步比较了TCD与DSA检测SAH后CVS的有效性,结果两种方法在术后3天、5天比较,P均大于0.05(见表4,5),两种方法在检测CVS方面差别没有统计学意义。
2.2DSA测得基底动脉管径变化 SAH组兔基底动脉管径平均值在术后第3天、5天与术前1天相比有统计学意义,P<0.05,SAH组较对照组也有统计学意义,P<0.01,表明确实有血管痉挛存在,第3天时基底动脉管径平均值为基础值的(70.25±9.15)%,未痉挛的3只,轻度痉挛3只,中度痉挛7只,重度痉挛2只,第5天时基底动脉管径平均值为基础值的(76.75±8.37)%,轻度痉挛5只,中度痉挛3只,重度痉挛3只,而基底动脉管径平均值在术后第3天与第5天相比没有差别,P>0.05,表明基底动脉在术后第3天的痉挛程度较第5天相比无明显差别,对照组在第3天与第5天相比则无统计学意义,P>0.05,具体见表1。
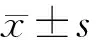
1.5基底动脉管径测量 双盲法分别测量术前1天和术后3、5天的基底动脉直径。以直径为1 cm的钢球作为参照值,采用DSA 机内测量软件,测量基底动脉上、中、下段3处的血管直径,取3点平均值作为基底动脉的直径。以术前1天的基底动脉直径作为基础值,术后3、5天直径为痉挛值,按照Liszczak标准[3]判断CVS的严重程度,痉挛程度以(基础值-痉挛值)/基础值×100%表示,<10%为正常,10%~20%为轻度痉挛,20%~30%为中度痉挛,30%~80%为重度痉挛。
2.4TCD与DSA比较 按照TCD测得的基底动脉平均血流速度与DSA测得的血管直径平均值进行分类统计,结果示:经DSA判断的轻度、中度、重度痉挛与未痉挛者相比,轻度与中度、轻度与重度、中度与重度相比均有差别,P均小于0.05;按照DSA判断的痉挛程度分组经TCD测得的各组血流速度的平均值也进行比较,结果示轻、中、重痉挛与未痉挛者相比,轻度与中度、轻度与重度、中度与重度相比均有差别,P均小于0.05,见表3。
2 结 果
2007年9月29日,中投公司成立。楼继伟亲任董事长兼党委书记,首任总经理是高西庆,另外还有包括汪建熙在内的4位副总经理。
2.1神经功能及进食状况 造模前两组家兔精神状态良好,进食、饮水正常,皮毛洁净,活动自如。造模后约2 h,大部分家兔苏醒。24 h内,有6~7只家兔无明显神经功能缺损,可进食饮水,但量少;其余出现不同程度的昏睡、昏迷,或兴奋、躁动,水平眼球震颤,呼吸增快,以头击笼,易激惹(表现为触动后惊跳、攻击、抽搐)。术后第1~4 天,SAH组家兔逐渐出现了偏瘫,四肢瘫,肢体张力减弱,回缩反应减弱,活动时身体倾斜或立行欲跌,或见旋转爬行,或见肢体震颤,进食明显减少,不自洁。2只在术后逐渐发展为嗜睡,昏迷,第3天死亡。术后第5天时神经功能状况分级为Ⅱ级6只,Ⅲ级5只,Ⅳ 级2只;摄取食物情况,Ⅱ级3只,Ⅲ级7只,Ⅳ 级3只。对照组神经功能状况和摄食较术前无明显改变。
1.4家兔进食及神经功能观察 按照Endo[2]神经功能评分标准,对家兔SAH前后进食量和神经功能损害进行评分,持续12 d(术前2天,制模3天,术后7天)。所有实验动物给予标准颗粒饲料和自来水喂养,昼夜室温控制在18~20℃,观察每只兔子制模前后的进食量并比较。将SAH后兔进食量减少的程度分为4级: Ⅰ级为全量(100% ),Ⅱ级为>50%但<100%,Ⅲ级为<50%,Ⅳ 级为0。通过观察兔的平面运动将神经功能障碍分为以下4级: Ⅰ级为正常(无神经功能障碍) ,Ⅱ级为轻度或可疑神经功能障碍(嗜睡、活动减少),Ⅲ级为中度神经功能障碍(肢体无力、跛行),Ⅳ 级为重度神经功能障碍(划圈运动或行走困难)。

表1 血管造影测得的基底动脉管径平均值(mm)
注:用方差分析,与术前1天比较,*P<0.05,**P<0.05;与相应天数的对照组比,*P<0.01,**P<0.01。
2.3TCD测得基底动脉平均血流速度 SAH组与对照组相应天数的基底动脉的平均血流速度(Vm)比较,P均小于0.05,SAH组术前1天与术后1、2、3、4、5、6、7天相比,P值均小于0.05,表明确实有脑血管痉挛存在,制模成功;SAH组术后各天之间比较,术后第1天与第2天无差别,术后第3、4、5天之间也没有差别,P均大于0.05,但是术后第3、4、5天与第1、2天相比有差别,术后第6、7天与第5天相比有差别,P均小于0.05,可知在术后第1天平均血流速度开始加快,第3天达高峰,直至第5天,以后开始下降;对照组的各组数值比较无统计学意义,P>0.05。具体数据见表2。
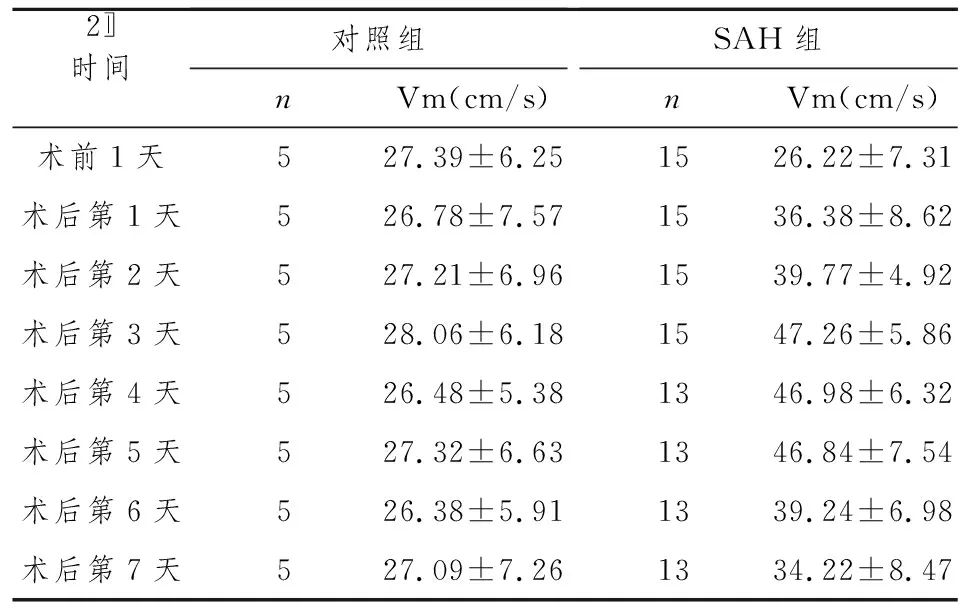
表2 TCD测得基底动脉平均血流速度
为解决填埋场内渗沥液的四处扩散,需对垃圾堆体四周进行垂直阻隔,从而阻断渗沥液与地下水的直接联系,然而,渗沥液具有腐蚀性,传统刚性垂直防渗墙极易受到腐蚀,在效果上很难达到 10-7cm/s的水平[6]。
新媒体有一个独有的优势特点,那就是 “即时反馈”,对于新闻爆点能做到根据相应的点击率、转发量、评论数等,快速地判断出某条新闻线索有无报道的价值,大大避免了错漏,或者看似平常却在网上引发很大关注的事件。当然,相对于传统的纸媒来说,新媒体发布的消息易流于片面、媚俗、猎奇、标题党、主观,甚至是虚假的现象。因此,传统纸媒在新媒体上寻求爆点时不能一味追求点击量、评论量、关注度等,对于报纸编辑要切实具有去伪存真的眼光,披沙拣金的能力,不能过于为了博人眼球而放弃职业操守,这点正是很多媒体欠缺的原因所在。
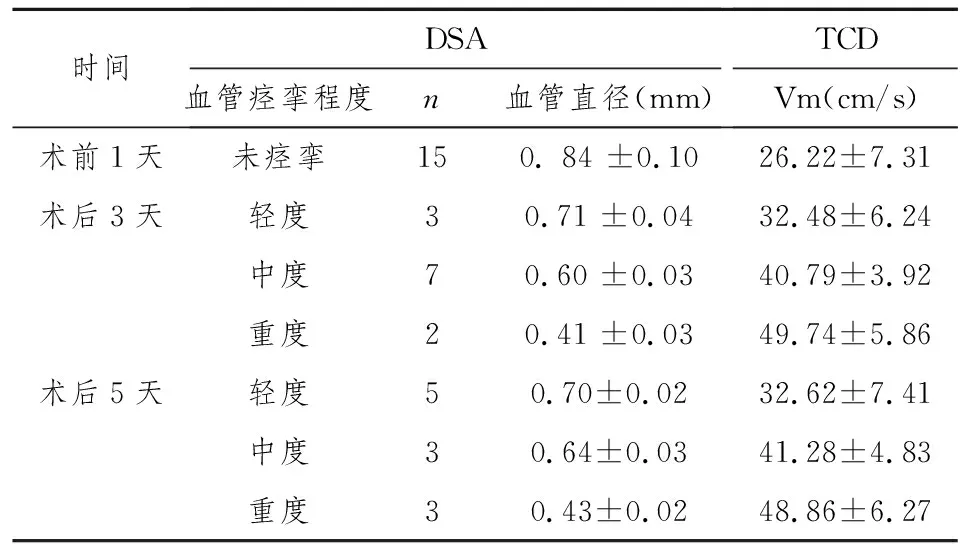
表3 SAH组DSA与TCD比较
阿勇表示,他咨询过律师,律师认为,法律没有规定罚金非要一次交清不可,实际上,对于罚金数额较多,罪犯无力一次缴纳的情况,是可以限期分期缴纳的。这么做,也有利于罚金刑的执行。但审判长林灿岗拒绝了他分期缴纳罚金的请求。
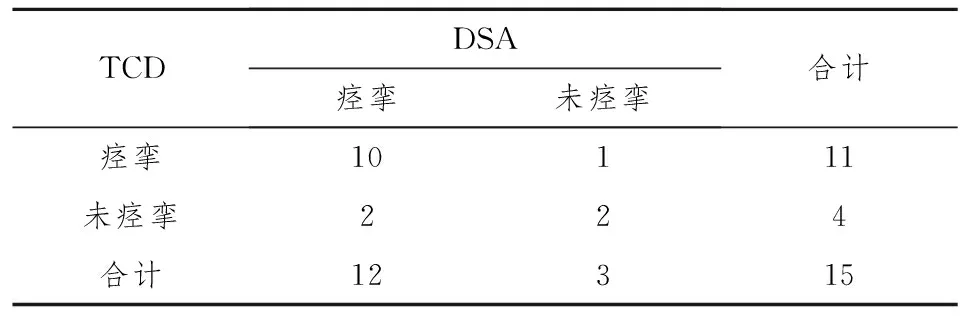
表4 SAH组术后第3天DSA与TCD比较
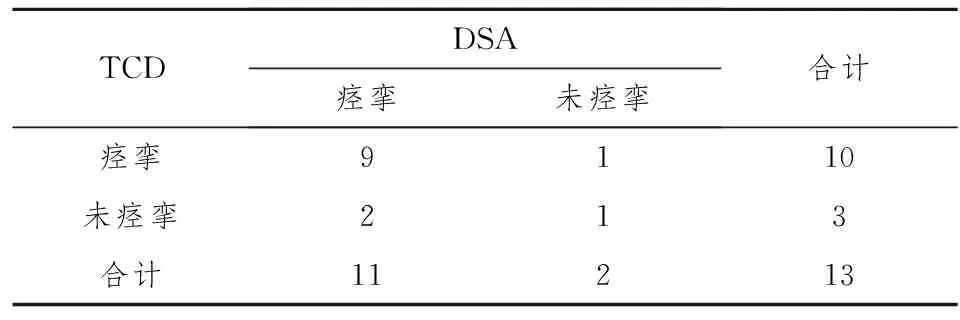
表5 SAH组术后第5天DSA与TCD比较
3 讨 论
目前,对于SAH后CVS的研究主要通过动物实验进行。选择的实验动物主要有大鼠、兔、猫、猪、犬及灵长类,其中兔因血管类型较狗、鼠等更接近于人,SAH 后出现CVS的临床表现更趋向于人,病死率低,操作相对简单, 费用低,使其在SAH后CVS的研究中得到广泛应用[4]。制作动物模型的方法有很多,目前应用最广泛,最肯定的是枕大池二次注血法[5]。而对于SAH后CVS的检测方法主要有观察动物术后的饮食及神经功能状况、DSA、TCD,其中DSA最为可靠,是“金标准”,但因其操作难度大,动物血管相对较细,穿刺置管困难,限制其在动物实验中的应用,尤其是小动物如兔、鼠等;经颅多普勒属于无创性检查,可以连续检测其动态变化,方便易掌握,使其得到广泛应用。本实验采用枕大池二次注血法建立兔SAH后CVS模型,在术后行TCD和DSA检查,证实CVS存在。
以往行兔脑血管造影多采用经肱动脉入路、锁骨下动脉入路[6]或经颈总动脉将导管逆行送至升主动脉行主动脉弓造影或经股动脉入路将造影管插至或接近右侧椎动脉在锁骨下动脉的开口处[6-8]。这些方法共同的不足之处是由于导管管径太大不能进入椎动脉管腔内,这必然需要高压推注较大量的造影剂,才能使椎-基底动脉显影,而且附近其它血管也同时显影,不能达到真正意义的选择性脑血管造影。近年来随着介入神经放射学的发展,一系列新型导管和导丝不断应用于临床,为选择性脑血管造影创造了条件。本实验经股动脉入路将Prowler-14微导管选择性导入左侧椎动脉,这些微导管远端的外径在0.6~0.7 mm之间,在椎动脉内可以较容易地操作微导管。本实验采用Road-mapping下导丝导向超选择性插管技术,此外SilverSpeed微导丝前端由于涂有亲水性材料而更加柔软,减少了对血管壁的损伤,可以更容易达到微导丝选择性进入远端弯曲血管的目的,同时为微导管滑行提供支撑力。本实验能够在小动物如兔上成功完成椎动脉内选择性插管,我们认为Road-mapping指引下导丝导向技术和新材料的应用是两个不可缺少的重要因素,在Road-mapping下可以清楚地判断微导丝和微导管在血管内的走行情况,导管到位的准确性明显优于单纯X光透视下的操作,这是我们能够完成以往认为操作难度大的椎动脉选择性造影的主要原因。本实验在DSA示踪图指引下采用导丝导向插管技术,将微导管选择性插入左侧椎动脉行选择性椎基底动脉造影,可以从血管影像上较直观地判断血管痉挛的严重程度。另外,对于小动物如兔股动脉较细,需要特制的导管鞘,而我们将微导丝放置在22G空针头里,作为穿刺针进行穿刺,可以省去导管鞘;在游离动脉的两端各放置一根4号线,在穿刺动脉后将其稍微向上提起来进行止血。该法简单方便,效果肯定,并且能大大减少实验难度和费用,有利于选择性脑血管造影技术在小动物模型中的应用。
由于DSA具有一定损伤性,使其不易重复,不便用于小体形动物血管痉挛的连续监测。应用TCD技术连续或间断的监测脑血流,既无创伤性,又可重复观测血流变化。我们应用TCD连续监测的结果表明: 术后24小时血流速度即有升高,第3天达到高峰,持续至术后第5天,随后开始下降,符合兔SAH后CVS的发生规律;血管造影呈轻、中、重度痉挛的动物其血流速度较注血前明显增快,轻、中、重度痉挛的动物间平均血流速度也有差异。
参照DSA结果,我们对相应的实验动物进行TCD、DSA对比研究,结果显示,正常兔基底动脉的平均血流速度为18~32 cm/s,平均值为26.22 cm/s,轻度痉挛时,脑血流就发生明显改变,其参数值在26~38 cm/s之间,均值为32.57 cm/s,中、重度痉挛时,平均血流速度分别为40.94 cm/s、49.20 cm/s。因此我们认为,在兔发生SAH后,如果其TCD结果超过33 cm/s,就应高度怀疑CVS的发生;若超过40 cm/s,基本可以肯定CVS的发生。这就为TCD检测、诊断CVS提供了重要的参数依据。
本研究表明, 经兔股动脉入路行选择性椎-基底动脉造影是完全可行的,采用TCD连续监测SAH兔基底动脉血流速度变化,其变化程度和发展过程与选择性脑血管造影结果一致,TCD与DSA具有良好相关性,可早期发现及动态观测CVS的发生、发展过程,间接反映脑动脉的管径变化,因而在兔SAH动物模型的实验研究中,TCD具有其优越性,可应用于SAH后CVS的诊断和疗效观察。
[1] Megyesi J F, Vollrath B, Cook DA, et al. In vivo animal models of cerebral vasospasm: a review[J]. Neurosurgery,2000,46(2):448-461.
[2] Endo S,Branson PJ,Alksne JF.Experimental model of symptomatic vasospasm in rabbits [J].Stroke,1988,19(11):1420-1425.
[3] Liszezak TM,Varsos VG,Black PM,et al.Cerebral arterial constriction after experimental subarachnoid hemorrhage is associated with blood components within the arterial wall [J].J Neurosurg,1983,58(1):18-26.
[4] Otsuji T, Endo S, Hirashima Y, et al. An experimental model of symptomatic vasospasm induced by oxyhemoglobin in rabbits[J]. Stroke, 1994, 25(3): 657-662.
[5] Gules I, Satoh M, Clower BR, et al. Comparison of three rat models of cerebral vasospasm[J]. Am J Physiol Heart Circ Physiol, 2002, 283(6): 2551-2559.
[6] Baker KF,Zervas NT,Pile-Spellman J,et al.Angiographic evidence of basilar artery constriction in the rabbit:a new model of vasospasm[J].Surg Neurol,1987,27(2):107-112.
[7] Endo S,Branson PJ,Alksne JF.Experimental model of symptomatic vasospasm in rabbits[J].Stroke,1988,19(11):1420-1425.
[8] Vorkapie P,Bevan RD,Bevan JA.Longitudinal time course of reversible and irreversible components of chronic cerebrovasospasm of the rabbit basilar artery[J].J Neurosurg,1991,74(6):951-955.

