老年性聋患者不同刺激模式下失匹配负波特征分析
李宝环 李富德 林鹏 梁瑞敏 陈晨 张静平
老年性聋是指由于年龄增长使听觉器官衰老、退变而出现的双耳对称、缓慢进行性的感音神经性听力减退,其特征为言语交流困难。Schuknecht将老年性聋分为四型,分别为感音型、神经型、代谢型及机械型,Welsh又补充了中枢型,临床上常遇到的老年性聋一般为上述两种或更多种的混合改变[1]。因此,老年性聋存在听觉传导通路衰老及听觉中枢功能减弱两种机制[2]。近年来国内外有研究报道利用失匹配负波(mismatch negativily,MMN)客观评价听神经病患者的言语辨别率[3~5]、感音神经性聋者听皮层的可塑性变化[5,6]以及听力正常的老年人与成年人听皮层之间的差别[7,8]等,但对于老年性聋患者MMN的研究甚少。本研究旨在对临床诊断为老年性聋患者的频率差异MMN与持续时间差异MMN的潜伏期及波幅与听力正常老年人及听力正常的青年人进行比较分析,报告如下。
1 资料与方法
1.1研究对象 老年性聋组:选择于2012年1月~2012年6月在天津市第一中心医院耳鼻咽喉头颈外科确诊为老年性聋的患者30例(60耳),男19例,女11例,年龄51~75岁,平均为63.54±4.54岁,1 000、2 000 Hz纯音听阈分别为20~65 dB HL、20~75 dB HL,分别平均为35.22±7.14、43.70±9.57 dB HL,鼓室导抗图均为“A”型,患者均主诉“听力逐渐下降,能听到声音,但听不清内容”,病程均大于6个月;听力正常老年组:选择工作于天津市第一中心医院职工及家属26名(522耳),男15名,女11名,年龄50~76岁,平均为62.43±6.43岁,1 000、2 000 Hz纯音听阈分别为5~20 dB HL,分别平均为12.43±4.73、15.54±3.37 dB HL,鼓室导抗图均为“A”型。对照组:天津医科大学学生30名(60耳),男18名,女12名,年龄20~30岁,平均为25.59±2.64岁,1 000、2 000 Hz纯音听阈分别为-5~20 dB HL,分别平均为10.23±5.73、8.57±6.37 dB HL,鼓室导抗图均为“A”型)。所有入选对象均无其他耳科疾病史。
1.2MMN测试方法 测试在符合GB/T16403( l996)的隔声电屏蔽室进行。应用美国智听公司SmartEP诱发电位系统分别对两组对象进行MMN测试。测试时受试者取坐位,全身放松,保持安静,嘱受试者观看无声影片,无需注意耳内给声。眉间接地极,前额正中靠近发迹按记录电极,双耳垂按参考电极,极间电阻小于5 kΩ,增益50.0 kHz,滤波带通1~30 Hz。测试采用Oddball模式,标准刺激和偏差刺激出现概率分别为80%和20%,偏差刺激以随机方式出现,单耳给声,刺激声为短纯音。两种刺激模式分别为:①频率差异MMN的标准刺激频率为1 000 Hz,偏差刺激频率为2 000 Hz,两种刺激持续时间为均50 ms,刺激间隔为849 ms;②持续时间差异MMN的标准刺激时间为50 ms,偏差刺激时间为100 ms,频率为1 000 Hz,刺激间隔为849 ms(标准刺激与标准刺激之间)或809 ms(标准刺激与偏差刺激之间)。正常受试者给声强度为60 dB nHL,老年性聋患者给声强度为90 dB nHL。经过脑电分析、去除伪迹、滤波、基线矫正以及叠加平均等,用记录到的偏差刺激的波形减去标准刺激的波形,获得的波形在100~300 ms间出现的偏向负侧的波形定为MMN。
1.3统计学方法 用SPSS17.0统计软件处理所有结果。对三组受试者的频率差异MMN和持续时间差异MMN结果进行多重极差检验。
2 结果
2.1各组频率差异MMN和持续时间差异MMN潜伏期、波幅比较(表1) 各组老年性聋组与听力正常老年组及对照组频率差异MMN潜伏期比较差异有显著统计学意义(P值分别为0.004和0.003,均P<0.05),而波幅差异无显著统计学意义(P值分别为0.175和0.127,均P>0.05)。
老年性聋组与听力正常老年组及对照组持续时间差异MMN潜伏期比较差异有统计学意义(P值分别为0.000和0.001,均P<0.05),波幅与听力正常老年组比较差异无统计学意义(P值为0.134,P>0.05),与对照组比较差异有显著统计学意义(P=0.023,P<0.05);听力正常老年组潜伏期与对照组比较差异有统计学意义(P=0.001,P<0.05),而波幅差异无统计学意义(P=0.086,P>0.05)。
2.2频率差异MMN与持续时间差异MMN结果比较(表1) 老年性聋组频率差异MMN潜伏期与持续时间差异MMN的潜伏期相比差异有显著统计学意义(P=0.000,P<0.05),但波幅差异无显著统计学意义(P=0.072,P>0.05)。对照组频率差异MMN与持续时间差异MMN的潜伏期及波幅差异均无统计学意义(P值分别为0.091和0.023,均P>0.05),听力正常老年组频率差异MMN潜伏期与持续时间差异MMN潜伏期比较差异有统计学意义(P=0.016,P<0.05),波幅比较差异无统计学意义(P=0.129,P>0.05)。
老年性聋患者与对照组不同刺激模式下的失匹配负波如图1所示。

表1 三组频率差异及持续时间差异MMN潜伏期、波幅比较
注:*与听力正常老年组及对照组比较,P<0.05;△与对照组比较,P<0.05;#与频率差异MMN潜伏期比较,P<0.05
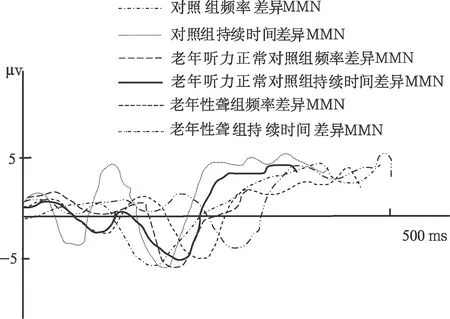
图1 老年性聋组和正常对照组频率差异及持续时间差异MMN波形图
3 讨论
MMN是一种皮层事件相关电位,是在连续相同的标准刺激中加入一种偏差刺激时,在N1后出现的偏向负侧的波,常于刺激后100~300 ms 之间出现,可客观反映听皮层的功能状态及大脑对变异刺激信号的自动处理功能。
马峰杰等[7]及Oates等[6]在研究感音神经性聋患者失匹配负波时发现感音神经性聋者与正常人相比MMN的潜伏期长,波幅低,分析其原因为感音神经性聋使传入的声信号减少,导致听觉皮层发生可塑性变化[7],使皮层对变异刺激信号的加工能力下降,引出的MMN发生变化。本研究发现老年性聋组频率差异MMN潜伏期也较听力正常老年组及对照组延长,与上述研究结果相似,可能是因为老年性聋也属感音神经性聋,故其MMN具备一般感音神经性聋的特征。
Gabriela等[8]在研究听力正常老年人的MMN的特征时,发现老年人的频率差异MMN潜伏期及波间期与健康青年人相比均无差别;但Bertoli等[9]在利用MMN来研究听力正常的老年人和青年人的时间辨别力时发现,相同的时间间隔,正常青年人更容易引出MMN。本研究中老年听力正常组与对照组的持续时间差异MMN相比潜伏期延长,波幅无差异,而老年性聋组与对照组相比持续时间差异MMN波幅减小,潜伏期延长,提示老年性聋影响时间相关MMN,其原因可能是老年人的听皮层自动比较过程延迟,且记忆痕迹较容易消退[2],这些都与时间相关。
从文中结果看,老年性聋组频率差异MMN与持续时间差异MMN相比潜伏期延长,但波幅之间的差别无统计学意义,而正常对照组频率差异和持续时间差异MMN的潜伏期及波幅均无差异。原因可能为不同刺激模式在中枢的加工部位不同,已经有研究利用fMRI证明持续时间MMN所需要的皮层下网状组织较频率MMN多,基底神经节、额叶及右侧顶叶皮层能够被时间(持续时间)感知并激活,但却不能被音调的变化(频率变异)所激活,所以持续时间MMN中枢涉及的范围较广泛,较频率MMN敏感,对于变化的刺激更容易产生变化[9]。所以可推断出老年性聋患者不仅听皮层发生了变化,皮层下、基底神经节、额叶等部位也随年龄的增长发生了变化,这可为进一步研究老年性聋的病变部位提供依据。
本研究中老年性聋组、老年听力正常组与对照组频率差异MMN的波幅及老年性聋组频率差异MMN与持续时间差异MMN波幅差异无统计学意义,这与国内外的研究结果不一致[10~12],其可能原因有:①分组原因造成[13],一般来讲,MMN波幅反映的是听皮层的功能状态,本研究中老年性聋组听力损失较轻的占比例较大,且年龄相对其他研究较小,导致从群体水平看听皮层状态的差异未能显示出来;②研究例数不多,可能出现结果的偏倚;③持续时间MMN更敏感,容易受注意、意识状态及清醒程度等的影响,尽管本研究实施过程中尽量让受试者避免关注耳内给声,但仍不能避免每位受试者在依从性方面存在一定差异。
总之,老年性聋患者由于长时间的听力损失,导致听皮层发生了可塑性变化,且皮层下网状结构及基底节等部位也同样发生变化,这些能够利用不同刺激模式的MMN检测出来,可为进一步研究老年性聋的机制提供依据。另外,随着MMN研究方法的不断发展,有望在以后的研究中结合主观言语辨别率的测试来评估老年性聋或者言语辨别力下降的耳聋患者的听力损失情况,还可以通过对听皮层状态的反应,对人工耳蜗植入术后患者的言语辨别力恢复的观察提供客观依据。
4 参考文献
1 胡岢.老年性耳聋的研究进展[J].中国听力语言康复科学杂志,2005(2):8.
2 Green KM,Julyan PJ,Hastings DL,et al.Auditory cortical activation and speech perception in cochlear implant users: effects of implant experience and duration of deafness[J].Hearing Research,2005,205: 184.
3 郭明丽,周娜,兰兰,等,听神经病患者失匹配负波特征与言语识别率的关系[J].听力学及言语疾病杂志,2006,14:16.
4 Rance G,Cone-Wesson B,Wunderlich J,et al.Speech perception and cortical event related potentials in children with auditory neuropathy[J].Ear Hear,2002,23:239.
5 Starr A,Picton TW,Sininger Y,et al.Auditory neuropathy[J].Brain,1996,119:741.
6 Oates PA,Kurtzberg D,Stapells DR.Effects of sensorineural hearing loss on cortical event- related potential and behavioral measures of speech- sound processing[J].Ear and Hearing,2002,23: 399.
7 马峰杰,刘莎,鲜军舫.感音神经性耳聋失匹配负波分析[J].听力学及言语疾病杂志,2009,17:20.
8 Gabriela B,Marcella BB,Cristiane F,et al.Mismatch Negativity (MMN) response studies in elderly subjects[J].Braz J Otorhinolaryngol,2009,75:831.
9 Bertoli S,Smurzynski J,Probst R.Temporal resolution in young and elderly subjects as measured by mismatch negativity and a psychoacoustic gap detection task[J].Clin Neurophysiol,2002,113:396.
10 黄选兆,汪吉宝,孔维佳,等.实用耳鼻咽喉头颈外科学[M].第二版.北京:人民卫生出版社,2010.994~996.
11 Näätänen R, Kujala C, Escera T,et al.The mismatch negativity (MMN) A unique window to disturbed central auditory processing in ageing and different clinical conditions[J].Clinical Neurophysiology,2012.123,424.
12 李兴启,郑杰夫,郗昕,等.听觉诱发反应及应用[M].北京:人民军医出版社,2007.198~203.
13 Manuela R,Cornelia P,Debora B,et al.Sensory memory du-ring physiological aging indexed by mismatch negativity (MMN)[J].Neurobiology of Aging,2012,625:21.

