Egr-1的诱骗性寡脱氧核苷酸抑制大鼠颈总动脉损伤后MMP-2的表达
孙晓花 刘闺男 张 晶
(中国医科大学附属第一医院心血管内科,沈阳110001)
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)已经成为再灌注治疗方法的主流[1],然而支架术后再狭窄(in-stent restenosis,ISR)的发生严重影响了PCI的治疗效果。近年来随着分子生物学进展,基因治疗很可能成为防治PCI术后RS的一种新策略。Egr-1在正常的动脉中表达很低或不表达,但机械损伤后快速上调其表达[2],诱导VSMC的分裂、增殖和内膜增生。诱骗寡脱氧核苷酸(decoy oligodeoxynucleotides,decoy ODNs)技术是将人工合成双链寡核苷酸导入细胞内,竞争性诱骗转录因子(transcription factors,TF)与其结合,使TF所调控的能促进细胞增殖的下游基因表达受到抑制,从而在转录水平上达到抑制细胞增殖的目的[3]。
MMP-2又称为明胶酶A,在人动脉粥样硬化病变部位和不同动物模型的新生内膜形成过程中高度表达[4-7]。为了研究 Egr-1 decoy ODNs抑制血管内膜增生的作用机制以及观察Egr-1和MMP-2在球囊损伤后内膜增生过程的作用,本实验设计了针对大鼠Egr-1基因序列的诱骗寡脱氧核苷酸,作用于损伤后的颈总动脉内膜,观察其对大鼠颈总动脉损伤后内膜增生的抑制作用及其对MMP-2表达的影响,为血管损伤术后再狭窄的防治提供一个新的靶点。
材料和方法
1.材料的准备
健康雄性Wistar大白鼠96只,体重350-400g,由中国医科大学实验动物中心提供,喂食标准饲料,自由饮水。2F Fogarty导管购自美国Baxter healthcare corporation;转染试剂FuGENE6购自Roche公司;兔抗大鼠 MMP-2单克隆抗体、SABC数据盒购自武汉博士德公司;Decoy ODN由上海博亚生物技术公司合成。
2.针对Egr-1基因序列的Decoy ODN的合成
Decoy ODN有上海博亚生物技术有限公司合成,经聚丙烯酰胺凝胶电泳法(PACE)C纯化,冻干保存。
Egr-1的诱骗寡脱氧核苷酸(decoy ODNs)的基因序列为:

Egr-1的诱骗对照寡脱氧核苷酸(decoy ODNs SCR)基因序列为:同诱骗序列类似的错配双链寡脱氧核苷酸:

在其3′和5′端进行硫代修饰,部分寡核苷酸的5′用FITC标记,以便于在荧光显微镜下观察转染后基因的分布情况。
3.实验分组
96只雄性 Wistar大白鼠随机分为4组,每组24只。假手术组:只进行颈总动脉结扎,但不插入导管,即不造成动脉内膜损伤。对照组(Fu Gene6+MgCl2):球囊拉伤左颈总动脉后局部注入200μl含30μl Fu Gene6 转 染 试 剂 的 1mmol/L MgCl2液。SCR组(decoy ODNs SCR+ FuGene6+MgCl2):下文也称杂码组,球囊拉伤左颈总动脉后,应用微量注射器局部释放200μl含有500μg FITC标记的对照 decoy ODNs SCR、30μl Fu Gene6 转染试剂的1mmol/L MgCl2溶液,使其在局部作用20min。诱骗组:(decoy ODNs+ Fu Gene6+MgCl2):球囊拉伤做颈总动脉后,应用微量注射器局部释放200μl含有500μg FITC 标记的对照 decoy ODNs、30μl FuGene6转染试剂的1mmol/L MgCl2溶液,使其在局部作用20min。于术后3、7、14、21d分别处死各组动物6只,处死前心脏采血备用。
4.动物模型的制备
10%水合氯醛腹腔注射(30mg/kg)麻醉后,颈正中切开,钝性分离左颈总动脉,血管夹暂时阻断左颈总动脉近心、远心端血流,用2F导管从颈外动脉插入左颈总动脉内,推入0.2ml生理盐水充盈气囊,反复抽拉球囊三次,造成做颈总动脉内膜损伤。应用微量注射器将含有FITC标记的Decoy ODNs局部注入至损伤的血管节段内,使其在局部作用20min。术后结扎颈外动脉,恢复血流,缝合颈部创口。使用青霉素预防感染,喂食标准饲料,自由饮水。
5.在体decoy ODNs转染
室温下分别将500μg decoy ODNs及对照基因与30μl转染试剂Fu Gene6充分混合成复合物后溶于170μl的1mmol/L MgCl2溶液中,在制作血管球囊损伤模型的同时,从颈外动脉给与。可在荧光显微镜下观察转染情况。转染治疗24h后处死大鼠2只(对应组术后第3d处死4只动物),立即取治疗局部的血管放入液氮罐中,经冰冻切片(片厚5μm)后,避光于荧光显微镜下观察。
6.血管形态学检测
于不同时间点取材,病变血管标本经10%中性福尔马林固定后,经60%、70%、80%、90%、100%梯度酒精脱水,二甲苯透明,浸蜡,石蜡包埋,制成腊块,连续切片(片厚4μm),行HE染色观察血管内膜、中膜的厚度改变,并分组进行计算机图像分析。图像分析由操作熟练但不知情者操作。
7.免疫组织化学检查
基质金属蛋白酶2(MMP-2)免疫组织化学染色采用SABC法。依照试剂盒说明操作。以磷酸盐缓冲液代替一抗作为阴性对照。MMP-2阳性着色表现为胞浆染成浅黄色、棕黄色或棕褐色。每个标本选取4个切片,每张切片随机选取6个不同视野,在400倍光镜下计数阳性细胞的百分比,计算平均值。
8.统计学处理
所有数据采用SPSS11.0软件包进行统计分析,计量资料以均数±标准差(±s)表示,多组之间的比较采取单因素方差分析,P<0.05则认为统计学上差异有显著性。
结 果
1.在体转染效果观察
转染治疗基因24h后,取治疗局部血管的冰冻切片置于荧光显微镜下观察,可见残存血管内膜及中膜有大量绿色荧光分布,证明转染成功(图1)。
2.形态学检查结果
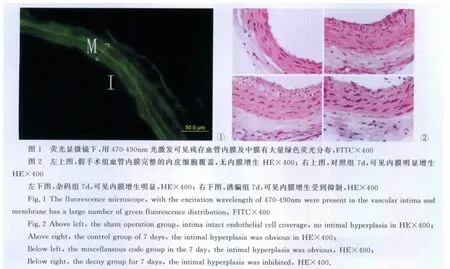
大鼠颈总动脉拉伤后,可见内皮剥脱,说明球囊拉伤动物模型成功;在假手术组,血管内膜由一层完整的内皮细胞覆盖,无内膜增生;在对照组和杂码组3d内膜开始增生,7d时可见内膜增生明显,14d、21d时内膜增生更明显,内膜及中膜层有大量的增生细胞,排列紊乱,内弹力板模糊(图2),两组对照差异无显著性。诱骗组与同一时间点对照组和杂码组相比,内膜增生受到抑制,两者之间差异有显著性(P<0.01)。
表1 血管球囊损伤后内膜、中膜的变化(±s,n=24)Table 1 Change of vessel after balloon jnjury of intima and media(±s,n=24)
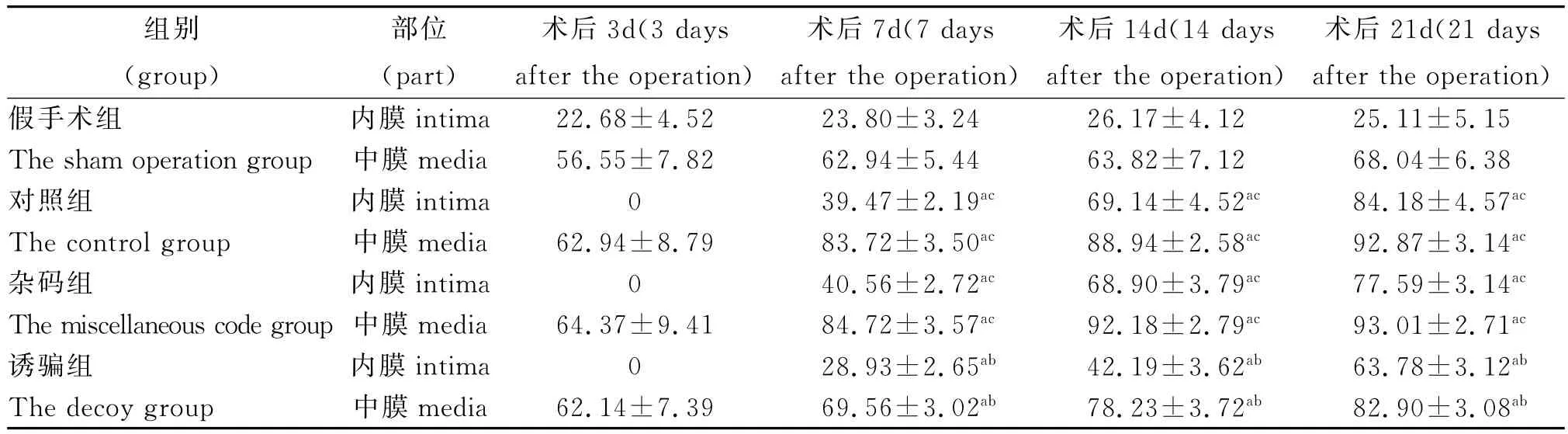
表1 血管球囊损伤后内膜、中膜的变化(±s,n=24)Table 1 Change of vessel after balloon jnjury of intima and media(±s,n=24)
*与假手术组比较,ac P<0.01;(Compared with the sham operation group,ac P<0.01)与对照组及杂码组比较,ab P<0.01。(Compared with the control group and miscellaneous code group,ab P<0.01)内膜、中膜厚度单位:μm。(The thickness of the intima and media units:μm)
组别(group)部位(part)术后3d(3 days after the operation)术后7d(7 days after the operation)术后14d(14 days after the operation)术后21d(21 days after the operation)假手术组 内膜intima 22.68±4.52 23.80±3.24 26.17±4.12 25.11±5.15 The sham operation group 中膜media 56.55±7.82 62.94±5.44 63.82±7.12 68.04±6.38对照组 内膜intima 0 39.47±2.19ac 69.14±4.52ac 84.18±4.57ac The control group 中膜media 62.94±8.79 83.72±3.50ac 88.94±2.58ac 92.87±3.14ac杂码组 内膜intima 0 40.56±2.72ac 68.90±3.79ac 77.59±3.14ac The miscellaneous code group 中膜media 64.37±9.41 84.72±3.57ac 92.18±2.79ac 93.01±2.71ac诱骗组 内膜intima 0 28.93±2.65ab 42.19±3.62ab 63.78±3.12ab The decoy group 中膜media 62.14±7.39 69.56±3.02ab 78.23±3.72ab 82.90±3.08ab
表2 血管球囊损伤后MMP-2水平变化(±s,n=24)Table 2 Changes in MMP-2 levels after vascular balloon injury(±s,n=24)

表2 血管球囊损伤后MMP-2水平变化(±s,n=24)Table 2 Changes in MMP-2 levels after vascular balloon injury(±s,n=24)
*与假手术组相比,ac P<0.01;(Compared with the sham operation group,ac P<0.01)与对照组及杂码组比较,ab P<0.01。(Compared with the control group and miscellaneous code group,ab P<0.01)单位:%。(units:%)
组别(group) 3d(3 days) 7d(7 days) 14d(14 days) 21d(21 days)假手术组The sham operation group 6.96±1.34 6.96±1.34 6.96±1.34 6.96±1.34对照组 The control group 9.72±5.78 48.62±3.14ac 29.67±2.15ac 14.01±2.35ac杂码组 The miscellaneous code group 10.07±4.52 46.76±2.54ac 30.46±1.27ac 13.67±2.35ac诱骗组 The decoy group 8.43±3.61 29.14±2.85ab 15.43±2.13ab 10.03±1.52ab
3.免疫组织化学染色结果
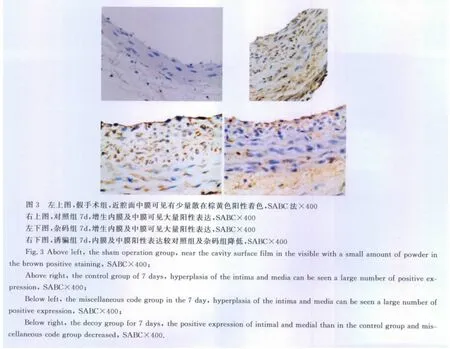
在假手术组近腔面中膜可见MMP-2有少量散在阳性表达;在对照组及杂码组动脉损伤后3d,在近腔面中膜,有少量阳性表达,与假手术组相比,阳性表达指数上升。7d时在新生内膜和靠近新生内膜处中膜表达达到高峰,14d后表达逐渐下降(图3)。诱骗组动脉中 MMP-2阳性表达下降,与对照组和杂码组相比有显著差异(P<0.01)。
讨 论
自从Gruenting(1977年)进行首例经皮冠状动脉腔内成形术(PTCA),PTCA已逐渐成为冠心病的主要治疗方法之一,但是PTCA术后6个月大约有30%-50%的患者出现术后再狭窄(restenosis,RS)[8]。即使PTCA后采用支架术也有10% -20%的RS率。许多学者认为,再狭窄过程是一个血管损伤反应,是新生内膜增生与血管重构的过程[9]。新生内膜平滑肌细胞的迁移、增殖与细胞外基质的沉积可能共同导致ISR的发展[10]。正常情况下,体内的VSMC被体内的基质所包围,基质发挥生物学和机械屏障限制 VSMC的运动[11]。MMP-2由多种细胞产生,如血管平滑肌细胞、内皮细胞等[12],其调节基质的降解及平滑肌细胞的迁移,有文献表明,MMP-2在血管机械损伤后高度表达,因此,MMP-2在血管再狭窄的发病机制中起一定的作用[10,13]。
早期生长反应因子-1是立早基因(IEGs)家族的一员,是一种锌指结构转录因子和DNA粘附蛋白,其调控着多种与VSMC增殖相关基因的表达,诱导VSMC的分裂、增殖和内膜增生等。有学者指出,抑制Egr-1的表达,在动脉粥样硬化和血管再狭窄的发生过程中均起到一定的作用。我们之前的研究也发现[14]:针对Egr-1的DNA合成酶能够提高血管内皮功能,抑制内膜增生,上调一氧化氮合成酶(NOS)表达,下调转化因子β(TGF-β)等。
诱骗寡脱氧核苷酸,又称为顺势元件的寡脱氧核苷酸技术是将与TF靶相相结合位点序列相同的人工合成双链寡核苷酸导入体内,TF decoy ODNs能竞争性结合活化的TF序列特异识别结构域,快速有效的抑制TF与启动子调控序列的特异性结合,从而抑制下游基因的转录起始[3,15]。有报道称在体转染针对Egr-1的decoy ODNs能够降低Egr-1依赖性基因的表达,抑制球囊损伤后高胆固醇家兔颈动脉新生内膜的厚度[16]。韩伟等[17]证实Egr-1 decoy ODNs能够有效地诱骗早期生长因子与其结合,进而抑制大鼠颈动脉球囊损伤后的血管平滑肌细胞增殖和内膜增生。而我们的实验不仅成功地制作了大鼠颈动脉损伤模型,稳定地转染了Egr-1 decoy ODNs,还进一步揭示了动脉损伤后内膜的增生与MMP-2的表达可能有一定关系,且两者均在第7d时表达明显增高,此外,我们还指出Egr-1引起血管内膜增厚可能与激活MMP-2的表达有关。
我们的数据可以看出:动脉损伤后 MMP-2水平的升高伴随有内膜增生程度的增加,7d时表达明显,以后逐渐下降,转染Egr-1 decoy ODNs治疗后,在各个时间点内膜增厚程度减轻,MMP-2蛋白表达减少,与对照组比较差异有显著性(P<0.01),其作用机制可能是Egr-1decoy ODNs与下游基因启动子区域的内源性顺式作用元件竞争性地结合转录因子 Egr-1,抑制了 MMP-2的激活[18-21],从而抑制了VSMC的迁移及血管重塑发生,进一步抑制了AS的发生。而人们已在肺成纤维细胞[22]和肿瘤细胞[23]中证实 Egr-1可调控 MMP-2的表达。为今后深入研究血管损伤后再狭窄的防治提供一条新的途径。
[1]Andreas Indermuehle,Rahul Bahl,Alexandra J Lansky,et al.Drug-eluting balloon angioplasty for in-stent restenosis:a systematic review and meta-analysis of randomised controlled trials.Heart,2013,99:327-333
[2]Liang KW,Ting CT,Yin SC,et al.Berberine suppresses MEK/ERK-dependent Egr-1 signaling pathway and inhibits vascular smooth muscle cell regrowth after in vitro mechanical injury.Biochem Pharmcol,2006,71(6),806-817
[3]Ryuichi Morishita,Jitsuo Higaki,Naruya Tomita,et al.Application of Transcription Factor"Decoy"Strategy as Means of Gene Therapy and Study of Gene Expression in Cardiovascular Disease.Circulation Research,1998,82:1023-1028
[4]Li Z,Li L,Zielke HR,et al.Increased expression of 72-kd type IV collagenase(MMP-2)in human aortic atherosclerotic lesions.Am J Pathol,1996,148:121-128
[5]Kuzuya M,Kanda S,Sasaki T,et al.Deficiency of gelatinase a suppresses smooth muscle cell invasion and development of experimental intimal hyperplasia.Circulation,2003,108:1375-1381
[6]Kuzuya M,Nakamura K,Sasaki T,et al.Effect of MMP-2 deficiency on atherosclerotic lesion formation in apoE-deficient mice.Arterioscler Thromb Vasc Biol,2006,26:1120-1125
[7]Takeshi Sasaki,Kae Nakamura,Kumiko Sasada,et al.Matrix metalloproteinase-2 deficiency impairs aortic atherosclerotic calcification in ApoE-deficient mice.Atherosclerosis,2013,227:43-50
[8]王日胜,霍勇.血管成形术后血管壁细胞表型的改变与再狭窄.中国介入心脏病学杂志,2000,8(2):107-109
[9]Cassells W,Engler D,Willerson J,et al.Mechanism of restenosis.Tex Heart Inst J,1994,21:68-77
[10]Katharina M Katsaros,Stefan P Kastl,Gerlinde Zorn,et al.Drug-Eluting Stents in Patients With Elevated Serum Activity of Matrix Metalloproteinase-2 and-9.Cardiovascualr Interventions,2010,3(1):90-97
[11]Jenkins GM,Crow MT,B ilato C,et al.Increased expression of membrane type Matrix metalloproteinase and preferential localization of matrix metalloproteinase2 to the neointima of balloon injured rat carotid arteries.Circulation,1998,97(1):82-90
[12]Galis ZS,Khatri JJ.Matrix metalloproteinases in vascular remodeling and atherogenesis:the good,the bad,and the ugly.Circ Res,2002,90:251-262
[13]Pasterkamp G,Schoneveld AH,Hijnen DJ,et al.Atherosclerotic arterial remodeling and the localization of macrophages and matrix metalloproteinases 1,2 and 9 in the human coronary artery.Atherosclerosis,2000,150:245-253
[14]Liu GN,Teng YX,Yan W.Transfected synthetic DNA enzyme gene specifically inhibits Egr-1 gene expression and reduces neointimal hyperplasia following balloon injury in rats.International Journal of Cardiology,2008,129(1):118-124
[15]Mann MJ,Dzau VJ.Therapeutic applications of transcription factor decoy oligo-nucletides.J Clin Invest,2000,106:1071-1075
[16]Ohtani K,Egashira K,Usui M,et al.Inhibition of neointimal hyperlasia after balloon injury by cis-element"decoy"of early growth response gene-1 in hyper-cholesterolemic rabbits.Gene Therapy,2004,11:126-132
[17]Han W,Liu GN.EGR-1 decoy ODNs inhibit vascular smooth muscle cell proliferation and neointimal hyperplasia of balloon-injured arteries in rat.J Life Sciences,2010,86(7-8):234-243
[18]Haas TL,Stitelman D,Davis SJ,et al.Egr-1 mediates extracellular matrix-driven transcription of membrane type 1 matrix metalloproteinase in endothelium.J Biol Chem,1999,274:22679-22685
[19]Denhardt DT,Feng B,Edwards PR,et al.Tissue inhibitor of metalloproteinases (TIMP,aka EPA):Structure,control of expression and biological functions.Pharmacol Ther,1993,59:329-341
[20]Murphy G,Willenbrock F,Ward RV,et al.The C-terminal domain of 72 k Da gelatinase A is not required for catalysis,but is essential for membrane activation and modulates interactions with tissue inhibitors of metalloproteinases.Biochem J,1992,267:637-641
[21]Strongin AY,Marmer BL,Grant GA,et al.Plasma membrane-dependent activation of the 72-k Da type IV collagenase is prevented by complex formation with TIMP-2.J Biol Chem,1993,268:14033-14039
[22]Wen Ning,Yingying Dong,Jingxia Sun,et al.Cigarette Smoke Stimulates Matrix Metalloproteinase-2 Activity via EGR-1 in Human Lung Fibroblasts.Am J Respir Cell Mol Biol,2007,36:480-490
[23]Zcharia E,Atzmon R,Nagler A,et al.Inhibition of matrix metalloproteinase-2 by halofuginone is mediated by the Egr1 transcription factor.Am J Respir Cell Mol Biol,2007,36(4):480-490

