子宫内膜样腺癌中胰岛素样生长因子的基因表达与雌激素受体相关性探讨
梁元姣,郑大东,郝 群,季爱华,王建东
(临床研究)
子宫内膜样腺癌中胰岛素样生长因子的基因表达与雌激素受体相关性探讨
梁元姣,郑大东,郝 群,季爱华,王建东
目的 胰岛素样生长因子(insulin-like growth factor,IGF)是多肽类生长激素中的一类,是细胞增生、分化过程中的促有丝分裂因子。有研究表明IGF在肿瘤细胞的增生分裂中起很重要的作用。文中探讨IGF-1和2及其受体基因在子宫内膜样腺癌中的表达模式,分析它们与雌激素受体(estrogen receptor,ER)亚型α、β间的关系以及临床病理意义。 方法选取58例患者临床不同期的子宫内膜样腺癌组织标本(内膜癌组),同时选取癌旁组织31例(癌旁组)、正常内膜组织42例(对照组),采用TRizol一步法提取总RNA。TaqMan荧光实时定量PCR检测3组患者的IGF-1、IGF-2、IGF-1受体(insulin-like growth factor-1 receptor,IGF-1R)、IGF-2R、胰岛素样生长因子结合蛋白-3(insulin-like growth factor binding protein-3,IGFBP-3)、ERα、ERβ的mRNA表达,分析3组标本中的表达差异以及在内膜癌组织中的表达模式和相关关系。结论IGF-1、IGF-1R、IGF-2、IGF-2R、IGFBP-3的mRNA表达量在内膜癌组中分别为1.19±0.79、6.23±3.98、2.44±2.32、4.32±2.98、14.47± 12.31,在癌旁组中分别为2.66±1.73、35.34±22.02、8.59±7.13、0.39±0.36、8.28±4.57,均明显高于对照组中0.58± 0.30、0.54±0.32、0.33±0.19、0.04±0.03、4.58±3.35,差异均有统计学意义(P<0.05)。癌旁组与内膜癌组比较,IGF-1、IGF-1R、IGF-2的 mRNA量明显升高,而 IGF-2R、IGFBP-3的 mRNA则下降,差异均有统计学意义(P<0.05)。ERα、ERβ-mRNA表达水平在内膜癌组分别为10.67±7.63、31.44±25.22;对照组中分别为16.24±10.10、50.10±21.60(P<0.05),癌旁组中分别为45.54±33.58、529.62±296.70,较对照组及内膜癌组均显著增加,差异有统计学意义(P<0.05)。对照组中,ER与IGF之间无相关性。内膜癌组中ERα与IGF-1、IGF-2呈高度正相关,r分别为0.6439、0.5228;与IGF-2R呈轻度正相关,r为0.297 0;ERβ与IGF-1、IGF-2、IGF-2R呈轻度正相关,r分别为0.415 5、0.355 5、0.275 6;癌旁组中,ERα与IGF-1R、ERα与IGF-2、ERβ与IGF-2呈高度正相关,r分别为0.5545、0.8502、0.9327,均有统计学意义(P<0.05),其他均显示无相关性。在内膜癌组织中IGF-1、IGF-2、IGF-2R、ERα、ERβ-mRNA表达量随着分期、分级以及浸润深度的增加呈下降趋势,而IGF-1R、IGFBP-3-mRNA表达量变化不明显;IGF-1、IGF-2、ERα、ERβ-mRNA与内膜癌分期、分级以及肌层浸润深度呈高度负相关,IGF-2R与分期、分级、浸润深度呈轻度负相关(P<0.05),IGF-1R和IGFBP-3与上述临床病理特征间相关性分析无统计学意义。结果癌旁组织和癌组织中IGF-1、IGF-2、IGF-1R的基因呈明显高表达,尤以癌旁组织中更明显;癌旁组织中ERα、ERβ的基因活性亦明显高于癌组织,癌组织中ERα、ERβ与IGF-1及IGF-2呈高度正相关,提示IGF-1和IGF-2可能激活ERα/ERβ,是正常内膜发生癌变的重要机制之一。IGF-1、IGF-2、IGF-2R、ERα、ERβ-mRNA高表达可能提示子宫内膜样腺癌预后良好。
子宫内膜样腺癌;胰岛素样生长因子;雌激素受体亚型;逆转录聚合酶链反应
0 引 言
子宫内膜癌是常见的妇科恶性肿瘤之一,80%以上的组织类型属于子宫内膜样腺癌。随着社会老龄化以及人们生活方式的改变,子宫内膜样腺癌的发生率和死亡率呈逐年上升趋势[1]。子宫内膜样腺癌确切发病机制尚不明了,已知与过多的无孕激素对抗的雌激素刺激有关,但单纯抗雌激素治疗不能全部抑制癌细胞的生长,故推测内膜癌细胞内除了雌激素-雌激素受体通路的作用外,还有其他信号分子的作用,特别是IGF可能参与内膜癌的发生。然而IGF在子宫内膜癌组织中的表达模式及其与ER亚型之间的相关关系研究很少。本研究旨在探讨IGF-1和IGF-2以及它们的受体在子宫内膜样腺癌中的表达模式,同时分析它们的表达与ER亚型之间的关系,以及IGF和ER的基因表达与临床病理特征间的相关性。
1 资料与方法
1.1 研究对象 选择2007年1月至2009年7月在我院妇科住院治疗的病理类型为子宫内膜样腺癌的患者58例,年龄33~79岁,中位数年龄为61岁。手术病理分期按2009年国际妇产科联盟(FIGO)的标准进行分期,其中Ⅰ期33例、Ⅱ期15例、Ⅲ期10例、Ⅳ期0例;病理分级:G114例、G231例、G313例。同时选取远离癌灶的内膜组织为癌旁组,共31例患者,年龄30~69岁,中位数年龄59岁,表现为不典型增生内膜24例,复杂性增生内膜4例,增生期内膜3例。选取因非子宫内膜疾病行子宫切除术,病理证实为正常子宫内膜组织的42例患者作为对照组,年龄33~68岁,中位数年龄58岁,与内膜癌组比较无显著性差异,其中增生期内膜24例,分泌期内膜18例。所有标本均经病理切片HE染色明确诊断,所有患者术前均未接受放、化疗及激素治疗。所有患者在接受治疗前均签署知情同意书。
1.2 主要试剂及仪器 TRIzol试剂(Invitrogen公司),DNA Marker(杭州博飞公司),5×AMV Buffer (美国Promega公司),dNTPs(美国Promega公司),RNAsin(美国Promega公司),AMV反转录酶(美国Promega公司),ABIPrism7000型荧光定量PCR仪(美国应用生物系统公司)等。
1.3 标本收集与处理 子宫组织离体后即刻用无菌手术刀取内膜至肌层薄片梭形标本,放入经过处理的无菌冻存管中,速冻于液氮中,然后转移至-80℃保存。
1.4 组织标本总RNA的提取 采用TRIzol一步法提取总RNA。RNA分离纯化所用的器皿均经过DEPC的处理,所用试剂按标准配置。
1.5 逆转录cDNA 将符合以上要求的RNA转录成cDNA,并进行cDNA扩增。取2μg RNA逆转录为cDNA第1链。反应体系为:5×AMV Buffer 5 μl、10 mmol/L dNTP 2.5 μl、RNAsin 1 μl(110 U/μl)、AMV反转录酶1 μl(10 U/μl),加无核酸酶水至25 μl。42℃反应10min,95℃灭活5min,-20℃保存待用。
1.6 子宫内膜样癌组织标本中IGF等5个因子及ERα、ERβ-mRNA的检测 在Genbank上查找人地目标基因mRNA序列,引物序列设计见表1,利用管家基因3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参。目标基因引物和探针由上海英捷生物公司设计及合成。管家基因GAPDH的引物及探针序列由我院病理科王建东博士提供,由上海英捷生物公司合成。反应体系包括10×Buffer 3 μl、dNTP(10 mmol/L)3 μl、上游引物(10 pmol/L)2 μl、下游引物(10 pmol/L)2 μl、Taq-Man探针1 μl,热启动酶(5 U/μl)0.2 μl、cDNA模板2 μl,加无核酸酶水至30 μl,PCR反应条件均为: 95℃预变性120 s,94℃变性30 s,退火温度30 s,72℃延伸60 s,共40个循环。每个标本重复3次,取平均值。按照上述PCR反应体系和反应条件在ABIPrism7000型荧光定量PCR仪进行扩增反应,自动生成目标基因及管家基因的标准曲线。
1.7 目的基因相对定量的计算 以GAPDH为内参,采用 1、10-1、10-2、10-3和 10-4浓度梯度对cDNA进行实时定量 PCR扩增制备标准曲线。IGF-1、IGF-1R、IGF-2、IGF-2R、IGFBP-3、ERα、ERβ和GAPDH标准曲线的R2值(PCR仪中软件自动计算)分别为:0.999717、0.999867、0.996122、0.998614、0.992139、0.993 873、0.990 499和0.999 909,均>0.99,表明良好的线性关系,标准扩增曲线均提示目的基因达到荧光阈值的循环数,即Ct值在18~30之间。根据标准曲线可得斜率(a)和截距(b),再通过目的基因Ct值和线性方程式Ct=a×logX+b计算目的基因的表达量X,最后计算目的基因相对定量=X目的基因/XGAPDH。
1.8 统计学分析 采用SPSS17.0软件进行统计学分析,计量资料采用均数±标准差()表示。各指标3组间均值的初步比较采用单向方差分析(one-way ANOVA),如果方差齐性检验显示方差不齐,则选用Welch近似方差分析。如方差分析结果有统计学意义,则进一步进行组间两两比较,方差齐采用LSD法,否则采用Tamhane's T2法。相关关系分析采用Speaman等级相关,计算相关系数rs。以P≤0.05为有显著性统计学意义。

表1IGF、ER基因引物及TaqMan探针序列Table 1 Primers and TaqMan probes of the IGF and ER genes
2 结 果
2.1 IGF-1、IGF-1R、IGF-2、IGF-2R、IGFBP-3、ERα、ERβ-mRNA在3组中的表达值 IGF中5个成员的mRNA表达值在内膜癌组和癌旁组中均明显高于对照组(P<0.05);癌旁组与内膜癌组比较,IGF-1、IGF-1R、IGF-2的mRNA量明显升高,IGF-2R、IGFBP-3的mRNA值则下降(P<0.05)。ERα、ERβ的mRNA表达水平内膜癌组较对照组低,癌旁组中2种亚型基因表达水平显著高于对照组和内膜癌组(P<0.05)。见表2。
2.2 ER亚型与IGF基因表达之间的相关性分析对照组中,ERα、ERβ与IGF 5个成员之间无相关性。内膜癌组中ERα与IGF-1、IGF-2呈高度正相关,与IGF-2R呈轻度正相关;ERβ与IGF-1、IGF-2、IGF-2R呈轻度正相关,均有统计学意义(P<0.05);癌旁组中ERα与IGF-1R及IGF-2、ERβ与IGF-2呈高度正相关(P<0.05)。其他均显示无相关性。见表3。
2.3 内膜癌组各指标基因表达与分期、分级及肌层浸润深度的关系
2.3.1 与手术病理分期的关系 IGF-1、IGF-2、IGF-2R-mRNA表达量随着分期的增加呈下降趋势(P<0.05),但Ⅱ期中IGF-2与Ⅲ期比较无差异,Ⅰ期中IGF-2R的表达与Ⅱ期比较无统计学意义,IGF-1R及IGFBP-3在分期中变化不大。ERα、ERβ-mRNA随分期的增加明显减少(P<0.05)。见表4。
2.3.2 与癌细胞分化程度的关系 按癌细胞分化程度分组,IGF-1、IGF-2、IGF-2R-mRNA表达量随着分化程度变差而下降,G1与G3、G2与G3比较差异有统计学意义(P<0.05),G1和G2比较差异无统计学意义;IGF-1R和IGFBP-3的基因表达在细胞分化中变化不明显。ERα、ERβ-mRNA表达量随癌细胞分化程度的下降明显减少(P<0.05)。见表4。
2.3.3 与肌层浸润深度的关系 按肌层浸润深度分≤1/2肌层和>1/2肌层2组,IGF中除IGF-1R和IGFBP-3外,它们的基因表达量随浸润深度加深而明显下降,ERα、ERβ的基因表达也呈相同的趋势(P<0.05)。见表4。
2.4 内膜癌组各指标基因表达与分期、分级、浸润深度的相关性分析 IGF-1、IGF-2-mRNA与内膜癌分期、分级以及肌层浸润深度呈高度负相关,IGF-2R与分期、分级、浸润深度呈轻度负相关(P<0.05),IGF-1R和IGFBP-3与上述临床病理特征无相关性; ERα、ERβ-mRNA与分期、分级、浸润深度呈高度负相关。见表5。
表2IGF、ER的mRNA在各组中的表达值)Table 2 Expressions of IGF and ER mRNA in the three groups)

表2IGF、ER的mRNA在各组中的表达值)Table 2 Expressions of IGF and ER mRNA in the three groups)
与内膜癌组比较,*P<0.05;与癌旁组比较,△P<0.05
组 别 n IGF-1 IGF-1R IGF-2 IGF-2R IGFBP-3 ERα ERβ对照组 42 0.58±0.30*△ 0.54±0.32*△ 0.33±0.19*△ 0.04±0.03*△ 4.58±3.35* 16.24±10.10*△ 50.10±21.60*△内膜癌组 58 1.19±00.79△ 6.23±3.98△ 2.44±2.32△ 4.32±2.98△ 14.47±12.31△10.67±7.63△ 31.44±25.22△癌旁组 31 2.66±01.73* 35.34±22.02* 8.59±7.13* 0.39±0.36* 8.28±4.57* 45.54±33.58* 529.62±269.70*
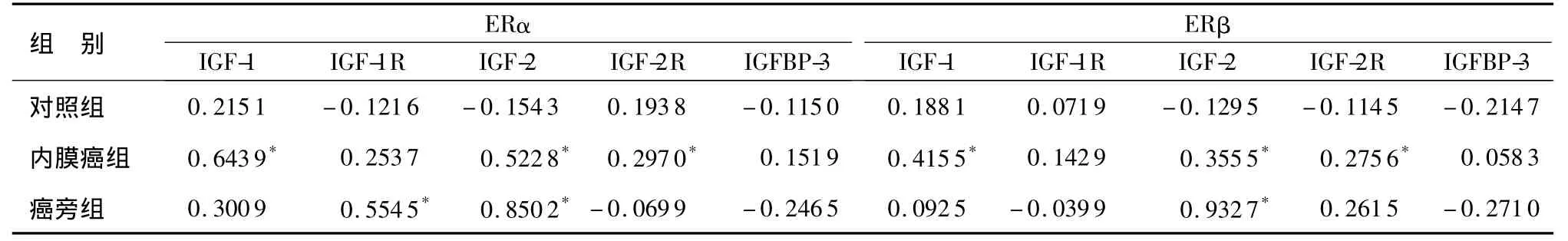
表3 3组中ER亚型与IGF基因表达的相关性分析Table 3 Correlation of ER subtypes with the expression of IGF in the three groups
表4 内膜癌中IGF、ER-mRNA表达量与分期、细胞分级及肌层浸润深度的关系()Table 4 Relationship of the expressions of IGF and ERmRNA with the stage,cell grade and depth of infiltration in endometrioid adenocarcinoma()

表4 内膜癌中IGF、ER-mRNA表达量与分期、细胞分级及肌层浸润深度的关系()Table 4 Relationship of the expressions of IGF and ERmRNA with the stage,cell grade and depth of infiltration in endometrioid adenocarcinoma()
与Ⅱ期比较,*P<0.05;与Ⅲ期比较,△P<0.05;与G2比较,#P<0.05;与G3比较,★P<0.05;与>1/2组比较,▲P<0.05
临床病理特征 n IGF-1 IGF-2 IGF-1R IGF-2R IGFBP-3 ERα ERβ手术病理分期Ⅰ期 33 1.70±0.73*△ 3.28±2.17*△ 1.62±0.86 4.97±2.77 14.91±13.03 16.57±4.10*△ 42.04±23.28Ⅱ期 15 0.58±0.09△ 1.73±2.47 1.84±0.96 4.70±2.96△ 13.25±13.32 4.33±2.39△ 25.70±24.47△Ⅲ期 10 0.44±0.02 0.72±1.31 1.50±0.79 1.60±2.50 14.83±16.79 0.72±0.33 5.07±2.11细胞分级G1 14 1.44±0.24★ 3.25±2.27★ 1.53±1.92 4.75±3.01★ 16.22±14.47 16.85±4.37#★ 41.93±26.78★G2 31 1.39±0.95★ 2.53±2.38★ 1.32±0.99 4.92±2.63★ 11.78±11.27 11.70±6.94★ 35.08±23.96★G3 13 0.47±0.07 1.34±2.02 1.66±0.84 2.42±3.27 18.99±16.87 1.55±1.79 11.47±16.42肌层浸润深度≤1/2 39 1.47±0.79▲ 3.14±2.27▲ 1.55±0.90 5.26±2.68▲ 15.82±12.78 14.28±5.64▲ 41.48±24.10▲>1/2 19 0.63±0.46 0.98±1.76 1.15±0.78 2.39±2.75 11.69±15.01 3.26±5.86 10.83±12.55
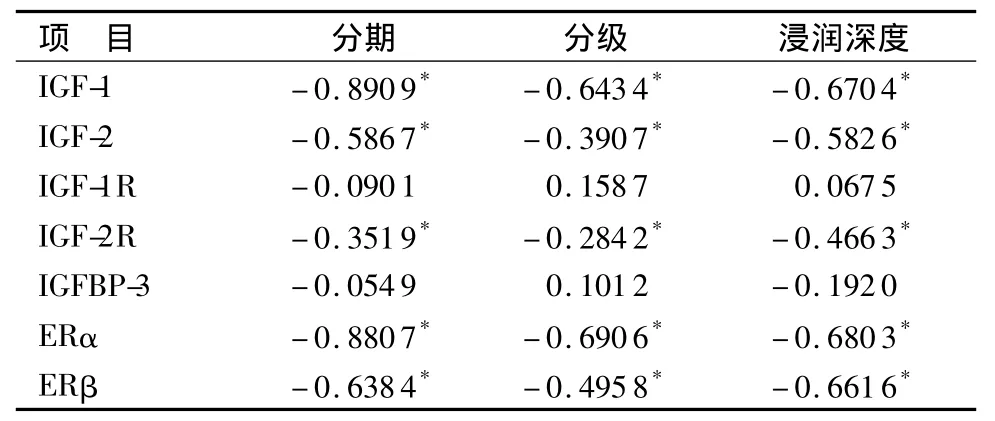
表5 内膜癌组各指标基因表达与分期、分级、浸润深度的相关性分析Table 5 Relationship of the mRNA expressions of 7 factors with the clinical stage,grade and depth of infiltration in endometrioid adenocarcinoma
3 讨 论
子宫内膜样腺癌是最常见子宫内膜癌的组织类型,发病机制不明,通常认为与过多的雌激素(estrogen,E)持续刺激有关。肥胖、糖尿病和多囊卵巢综合症患者是内膜癌的高危人群,她们共同的特点是高雌激素水平、高胰岛素血症和高浓度IGF-1,因此,血清IGF浓度增加也是内膜癌发病的风险因素[2]。IGF是多肽类生长激素中的一类,包括IGF-1、IGF-2、IGF-1R、IGF-2R、IGF结合蛋白1-6。IGF-1和IGF-2都是有效的丝裂原,参与细胞的增生、分化和凋亡过程的调节[3]。IGF在内膜癌中的作用机制不明,有研究表明,IGF在内膜癌中平衡失调,导致组织局部高活性或血液高浓度的IGF,与内膜癌的发生发展密切相关[4-6]。IGF-1和IGF-2由子宫内膜基质细胞产生,以自分泌和旁分泌的方式调节细胞的增生和分化[7]。它们都可与IGF-1R结合而激活IGF-1R,IGF-1R是一种酪氨酸激酶受体,属于夸膜受体,在子宫内膜间质细胞和上皮细胞中表达,它激活磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase PI3K)/Akt途径发挥一系列效应[3]。相反,IGF-2R并不具有酪氨酸激酶活性,而是阳离子依赖的细胞膜受体,选择性地与IGF-2结合,通过细胞吞噬作用将血液循环中多余的 IGF-2清除[8]。Roy等[9]用RT-PCR研究IGF-1、IGF-2及其受体在子宫内膜癌中的表达,观察到在正常子宫内膜中,IGF-1与IGF-1R mRNA表达呈正相关,而在子宫内膜癌中却未见这种关系;在2种内膜癌组织中(Ⅰ型雌激素依赖型内膜癌和Ⅱ型非激素依赖型内膜癌),IGF-1R与IGF-2R mRNA含量均高,而IGF-1、IGF-2仅在Ⅰ型内膜癌中高表达,而在Ⅱ型内膜癌中表达较低。因此,在2种不同类型的内膜癌中IGF的活性可能不同。McCampbell等[10〛研究说明,在不典型增殖内膜组织中IGF-1R的基因呈高表达,而且导致 IGF-1信号通路下游分子的激活,即PI3K/Akt的磷酸化,可能是增殖内膜向内膜癌进展的机制之一[10]。
本实验利用实时荧光定量RT-PCR方法,检测了58例子宫内膜样腺癌组织中 IGF-1、IGF-1R、IGF-2、IGF-2R、IGFBP-3共5个因子的mRNA水平,结果表明,IGFs 5个成员的mRNA表达值在内膜癌组及癌旁组中均明显高于对照组。癌旁组与内膜癌组比较,IGF-1、IGF-1R、IGF-2的mRNA量明显升高,IGF-2R、IGFBP-3的mRNA值则下降。说明在正常内膜组织中这5个成员的mRNA水平较低,而在癌组织中IGF 5个成员mRNA活性均增加,尤以IGF-1和IGF-2的基因活性增加为突出。我们在采集标本的过程中,选取子宫腔内远离癌灶的肉眼观正常的内膜作为癌旁组,病理结果显示其中大部分为子宫内膜腺体增殖或不典型增生,极少部分为正常内膜。在癌旁组中,IGF-1、IGF-2、IGF-1R表达量在3组中处于最高水平,即超过癌组织。癌旁组织可能是正常内膜向癌进展的过渡阶段,IGF-1、IGF-2的明显增加使细胞增生活跃,甚至达到不可遏制,这些基因的改变可能是内膜癌发生的早期信号;直至癌发生时,这些基因的表达可能受其他因素的影响而发生了改变。
IGF基因表达与子宫内膜样腺癌的手术病理分期、细胞分级以及肌层浸润深度的关系尚无定论。有资料表明,血清IGF-1增高与肿瘤复发及转移有关,IGF-1增高者5年生存率显著低于低IGF-1浓度者[10-11]。Kim等[12〛研究表明,IGF-1R是原发性乳腺癌患者的独立预后因子,IGFBP-3的表达则提示预后不良。本研究中,内膜癌组按手术病理分期、细胞分级、肌层浸润深度分组,比较各个指标的mRNA值间的差异,结果提示IGF-1、IGF-2的基因表达随分期、分级、浸润深度的增加而减少,IGF-1R以及IGFBP-3的基因表达并不随分期、分级以及浸润深度而变化。说明IGF-1、IGF-2的基因被异常激活是在内膜癌发生的早期,或主要是在癌前病变期,它们的表达上调,说明内膜癌预后较好。
子宫内膜样腺癌属于雌激素依赖型肿瘤,雌激素通过与ER结合发挥生物学效应。已知ER有2种亚型,即ERα和ERβ。目前,ER和孕激素受体(progesteron receptor,PR)已经作为子宫内膜癌的预后因子,并对术后的内分泌治疗具有指导意义[12]。有研究发现,在肿瘤分化程度低、恶性程度高、发生肌层浸润和淋巴结转移的内膜癌中,ER和PR表达水平愈低,推测当肿瘤发展到一定阶段时,受体的产生和作用受到损伤,组织逐渐失去ER和PR,其基因表达静默会导致肿瘤对激素治疗的敏感性差,所以预后差[13]。ERα、ERβ在内膜癌中的作用机制尚不明确,多数研究者认为,分期愈早、分化程度愈高,ERα的表达阳性率愈高,在子宫内膜样腺癌中的阳性率高于其他类型,无淋巴结转移者高于有淋巴结转移者[14-15]。ERβ的基因表达意义尚不明确,有学者认为,ERβ较ERα发挥更大的致癌作用[16]。本实验中比较癌组织与正常组织,发现ERα、ERβ在正常组织中的基因表达量高于癌组织,2组差异有统计学意义。纳入癌旁组织后,ERα、ERβ的表达量在癌旁组织中均达到最高,与前2组比较差异均有统计学意义,推测癌旁组织中ER亚型基因异常活跃,可能是长期雌激素刺激的结果。已如前述,癌旁组织的大部分病理类型为不典型内膜增殖,是内膜癌的癌前病变,ER亚型的高表达可能是细胞进一步异常的早期信号。
子宫内膜从正常组织至癌旁组织,再从癌旁组织至癌组织,ER的表达水平均呈现出先上升后下降的趋势。这个趋势说明子宫内膜由正常至发生癌变的过程中,ER的异常高表达是造成雌激素异常高效应的原因之一,这也是子宫内膜成为肿瘤浸润高危组织的部分原因;但当组织癌变后,受体的产生和作用受到损伤,癌变组织会逐渐失去ER,而周围的癌旁组织中受体明显增加,继而成为肿瘤进一步浸润的靶组织。这与以往的研究结果有相似之处。
在雌激素依赖型肿瘤中,E-ER是主要的信号通路,它与其他信号分子如IGF之间存在紧密的联系。乳腺癌中IGF-1R的过度表达与ER的表达呈正相关[17],体外实验中,IGF-1能刺激ER阳性的乳腺癌细胞增生,如果加入雌二醇IGF-1的活性增加,ER的表达也增加[11]。动物实验表明,IGF-1R和雌二醇具有协同作用,共同促进乳腺上皮细胞的增生[12]。Richardson等[18〛的研究结果表明,乳腺癌细胞中IGF-2通过与IGF-1R及胰岛素受体(insulin receptor,IR)结合,激活ERα和ERβ的基因表达[19]。子宫内膜样腺癌中,IGF-1、IGF-2及其受体均有过度表达,它们的作用受雌激素的调节,也受一些癌基因和抑癌基因的影响,但它们的表达与ER亚型之间的关系研究较少。本实验利用Spearman方法分析ER亚型与IGF之间的相关关系,结果表明正常内膜组织中ER与IGF之间无相关关系,而在癌组织中ERα与IGF-1、IGF-2呈高度正相关;癌旁组织中,ERα与IGF-2、IGF-1R高度正相关,ERβ与IGF-2高度正相关。由此可见,癌旁组织中,IGF-1、IGF-2及IGF-1R的活性增加,同时刺激 ER亚型的基因活性,而在癌组织中ER与IGF相关关系发生了变化,可能存在很复杂的机制。与其他研究者结果不同的是,内膜癌组织中未见ER与IGF-1R的正相关,而IGF-2R的表达似乎也显得很重要。因为IGF-2R正常情况下与部分IGF-2结合,通过细胞吞噬作用使IGF-2灭活,间接调控 IGF-2活性,癌旁组织中IGF-2R mRNA表达减少,调控IGF-2的功能减弱,内膜发生癌变后,它的表达增加,又与ER亚型呈轻度正相关,其间可能存在相互影响。
本研究中,内膜癌组按手术病理分期、细胞分级、肌层浸润深度分组,比较各指标mRNA值间的差异,同时进行相关性分析,结果提示IGF-1、IGF-2与内膜癌的分期、分级、浸润深度呈负相关,也就是分期愈晚、细胞分化愈差,浸润深度愈深,IGF-1、IGF-2的mRNA表达量逐渐减少,而IGF-2R与上述临床病理特征呈轻度负相关,IGF-1R及IGFBP-3在本研究中与分期、分级、浸润深度未显示有相关性。说明IGF-1、IGF-2的基因被异常激活是在内膜癌发生的早期或主要在癌前病变,它们的表达上调,说明内膜癌预后较好,同时IGF-2R也是不可忽略的预后因素。另外,癌组织中ERα、ERβ与分期、分级及浸润深度呈高度负相关,提示ER亚型的表达随着分期、分级、浸润深度的增加而减少,ERα、ERβ同时高表达是内膜癌预后良好的指标,也提示其对激素治疗敏感。但这只是基因表达的结果,确切的意义还要结合基因转录后蛋白质表达的情况,有待更加深入的研究。
从相关关系分析的结果看来,IGF-1、IGF-2、IGF-2R及ERα、ERβ都与内膜癌细胞的分化程度、侵蚀能力密切相关,亦与患者预后有关。IGF-1、IGF-2、ERα、ERβ基因异常激活可能发生在内膜癌早期或在癌前变化阶段,如果能早期发现和诊断内膜癌或内膜不典型增生,再针对上述基因进行靶向性治疗,可能对有生育要求的患者多一种治疗选择。目前,针对雌激素及ER的制剂(如选择性ER调节剂、芳香化酶抑制剂等)不断更新换代,新的制剂层出不穷,但针对IGF-1R的拮抗剂还处于实验研究阶段。乳腺癌已将IGF-1R拮抗剂用于Ⅱ期临床试验,相信不久的将来会取得更大的进展。
[1] Sorosky JI.Endometrial cancer[J].Obstet Gynecol,2008,111(2P1): 436-447.
[2] Gunter MJ,Hoover DH,Yu H,et al.A prospective evaluation of insulin-like growth factor-1 as risk factor for endometrial cancer[J].Cancer Epidermiol Biomarkers Prev,2008,17(4):921-929.
[3] Pavelic J,Matijevic T,Knezevic J.Biological&physiological aspects of action of insulin-like growth factor peptide family[J].Indian J Med Res,2007,125(4):511-522.
[4] Werner H,Bruchim I.The insulin-like growth factor-I receptor as an oncogene[J].Arch Physiol Biochem,2009,115(2):58-71.
[5] Hamelers IH,Steenbergh PH.Interactions between estrogen and insulin-like growth factor signaling pathways in human breast tumor cells[J].Endocrine-Related Cancer,2003,10(2):331-345.
[6] 张慧明,梁元姣,郝 群,等.雌激素受体相关受体α与雌激素受体在子宫内膜癌组织中的表达[J].医学研究生学报,2010,23(2):171-174.
[7] McCampbell AS,Walker CL,Broaddus RR,et al.Developmental reprogramming of IGF signaling and susceptibility to endometrial hyperplasia in the rat[J].Lab Invest,2008,88(6):615-626.
[8] Hebert E.Mannose-6-phophate/insulin-like growth factorⅡ receptor expression and tumor development[J].Biosci Rep,2006,26(1):7-17.
[9] Roy RN,Gerulath AH,Cecutti A,et al.Effect of tamoxifen treatment on endometrial expresion of human insulin-like growth factors and their receptor mRNAs[J].Mol Cell Endocrinol,2000,165(1-2):173-178.
[10] McCampbell AS,Broaddus RR,Loose DS,et al.Overexpression of the insulin-like growth factor 1 recepter and activation of the AKT pathway in hyperplastic endometrium[J].Clin Cancer Res,2006,12(21):6373-6378.
[11] Yu H,Rollan T.Role of the Insulin-like growth factors family in cancer development and progression[J].J Natl Cancer Inst,2000,92(18):1472-1489.
[12] Kim JH,Cho YH,Park YL,et al.Prognostic significance of insulin growth factor-I receptor and insulin growth factor binding protein-3 expression in primary breast cancer[J].Oncol Rep,2010,23(4):989-995.
[13] Singh M,Zaino M,Filiaci VJ,et al.Relationship of estrogen and progesterone receptors to clinical outcome in metastatic endometrial carcinoma:a Gynecologic Oncology Group Study[J].Gynecol Oncol,2007,106(2):325-333.
[14] Hu K,Zhong G,He F.Expression of estrogen receptors ERalpha and ERbeta in endometrial hyperplasia and adenocarcinoma[J].Int J Gynecol Cancer,2005,15(3):537-541.
[15] 梁元姣,张慧明,郝 群,等.胰岛素样生长因子受体及雌激素受体在子宫内膜样腺癌中的表达及临床病理意义[J].医学研究生学报,2011,24(5):472-476.
[16] Wilder JL,Shajahan S,Khattar NH,et al.Tamoxifen-associated malignant endometrial tumors:Pathologic features and expression of hormone receptors estrogen-alpha,estrogen-beta and progesterone;a case controlled study[J].Gynecol Oncol,2004,92(2): 553-558.
[17] Huang GS,Arend RC,Li M,et al.,Tissue microarray analysis of hormonal signaling pathways in uterine carcinosarcoma[J].Am J Obstet Gynecol,2009,200(4):457-459.
[18] Richardson AE,Hamilton N,Davis W,et al.Insulin-like Growth Factor-2(IGF-2)Activates Estrogen Receptor-α and-β via the IGF-1 and the Insulin Receptors in Breast Cancer Cells[J].Growth Factors,2011,29(2-3):82-93.
[19] 王巧莲,梁元姣,吴元赭,等.来曲唑对人子宫内膜癌细胞作用的研究[J].医学研究生学报,2007,20(6):627-631.
[20] 王书奎.胰岛素样生长因子2的基因组印迹及与肿瘤关系的研究进展[J].医学研究生学报,2010,23(2):113-116.
Expressions of insulin-like growth factors in endometrioid adenocarcinoma and estrogen receptor subtypes
LIANG Yuan-jiao1,ZHENG Da-dong2,HAO Qun1,JI Ai-hua1,WANG Jian-dong3
(1.Department of Obstetrics and Gynecology,2.Department of Ranking Health Protection,3.Department of Pathology,School of Medicine,Nanjing University/Nanjing General Hospital of Nanjing Military Command,PLA,Nanjing210002,Jiangsu,China)
Objective The insulin-like growth factor(IGF) is one of the polypeptide growth hormones and plays an important role in many physiological activities,but its signal transduction disorder or abnormal expression can lead to carcinogen development.This studyaimed to investigate the expressions of IGFs-mRNA in endometrioid adenocarcinoma and their relationship with estrogen receptor(ER) subtypes ERα and ERβ,as well as their clinicopathological implications. Methods We collected 58 specimens of endometrial adenocarcinoma(EA group),31 specimens of paracancerous tissue(PT group)and 42 specimens of normal endometrial tissue(NE group),extracted total RNA using One-Step Trizol,and detected the expressions of IGF-1,IGF-1R,IGF-2,IGF-2R,IGFBP-3,ERα and ERβ by TaqMan fluorescence real-time quantitative PCR.We analyzed the differential expressions in the three groups and the correlation among the expression patterns in endometrial carcinoma. Results The expression levels of IGF-1,IGF-1R,IGF-2,IGF-2R and IGFBP-3 were 1.19±0.79,6.23±3.98,2.44±2.32,4.32±2.98 and 14.47±12.31 in the EA group and 2.66±1.73,35.34± 22.02,8.59±7.13,0.39±0.36 and 8.28±4.57 in the PT group,significantly higher than 0.58±0.30,0.54±0.32,0.33±0.19,0.04±0.03 and 4.58±3.35 in the NE group(P<0.05).The levels of IGF-1,IGF-1R and IGF-2-mRNA were remarkably increased,while the levels of IGF-2R and IGFBP-3-mRNA markedly decreased in the PT group compared with the EC group(P<0.05).The expressions ERα and ERβ mRNA were lower in the EC(10.67±7.63 and 31.44±25.22)than in the NE group(16.24±10.10 and 50.10±21.60)(P<0.05),but higher in the PT(45.54±33.58 and 529.62±296.7)than in the NE and EA groups(P<0.05).There was no correlation between the mRNA expressions of ER and IGF in the NE group.In the EA group,the expression of ERα mRNA was highly positively correlated with those of IGF-1 and IGF-2(r=0.6439 and 0.5228),and slightly with that of IGF-2R(r=0.2970) (P<0.05).ERβ showed a slightly positive correlation with IGF-1,IGF-2 and IGF-2R(r=0.4155,0.3555 and 0.2756).In the PT group,the expression of ERα mRNA was highly positively correlated with those of IGF-2 and IGF-1R(r=0.5545 and 0.8502,P<0.05),and so was ERβ with IGF-2(r=0.9327,P<0.05).In the EA group,the mRNA expressions of IGF-1,IGF-2,IGF-2R,ERα and ERβ were negatively correlated with the stage,grade and depth of infiltration(P<0.05),while the expressions of IGF-1R and IGFBP-3 exhibited no correlation with them. Conclusion The activities of the IGF-1,IGF-2,IGF-1R,ERα and ERβ genes were markedly increased in paracancerous and cancerous tissues,and ERα and ERβ had a highly positive correlation with IGF-1 and IGF-2 in the cancerous tissue,which suggests that IGF-1 and IGF-2 could activate ERs in the endometrial carcinogen process.The overexpressions of IGF-1,IGF-2,IGF-2R,ERα and ERβ-mRNA might predict a good prognosis of endometrioid adenocarcinoma.
Endometrioid adenocarcinoma;Insulin-like growth factor;Estrogen receptor subtype;RT-PCR
R737.33
A
1008-8199(2012)08-0813-07
江苏省第七批“六大人才高峰”C类基金
210002南京,南京大学医学院临床学院(南京军区南京总医院)妇产科[梁元姣(医学博士)、郝 群、季爱华],干部保健科(郑大东),病理科(王建东)
2012-01-10;
2012-03-16)
(责任编辑:张 锐;英文编辑:罗永合)

