胰岛素样细胞生长因子-1、碱性成纤维细胞生长因子及转化生长因子α对人表皮干细胞增殖的影响
陈建国,孟庆楠,赵德梅,谭 谦
(基础研究)
胰岛素样细胞生长因子-1、碱性成纤维细胞生长因子及转化生长因子α对人表皮干细胞增殖的影响
陈建国,孟庆楠,赵德梅,谭 谦
目的 表皮干细胞是组织工程化皮肤的“种子细胞”。文中研究碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、胰岛素样细胞生长因子-1(insulin-like growth factor-1,IGF-1)和转化生长因子α(transforming growth factor α,TGFα)对人表皮干细胞增殖的影响。 方法 采用两步酶消化法和Ⅳ型胶原差速贴壁相结合的方法获得人原代表皮干细胞,将表皮干细胞分为A组(K-SFM)、B组(K-SFM+bFGF)、C组(K-SFM+IGF-1)及D组(K-SFM+TGFα)进行培养。比较不同组之间表皮干细胞的克隆形成率、生长增殖、生长曲线和细胞周期等指标。结论B组、C组及D组培养的表皮干细胞在细胞增殖、细胞克隆率方面检测结果均明显高于A组(P<0.05);流式细胞仪检测B组、C组与A组及D组处于G0/G1细胞比例比较差异有统计学意义(P<0.05)。结果IGF-1、bFGF及TGF-α均对表皮干细胞的增殖有促进作用,IGF-1及bFGF对表皮干细胞表型的维持有较好的作用。
胰岛素样细胞生长因子-1;碱性成纤维细胞生长因子;转化生长因子α;表皮干细胞;增殖
0 引 言
表皮干细胞是组织工程化皮肤的“种子细胞”,但由于自体表皮干细胞的来源数量少,体外培养中细胞的大量扩增是一个关键性的难题,并对组织工程化皮肤的临床应用产生了阻碍。本研究通过向培养基中分别添加bFGF、IGF-1和TGFα等不同的细胞因子,观测表皮干细胞的生物学特性,获得对表皮干细胞体外扩增具有促进作用的细胞因子,以期为进一步研究表皮干细胞体外大量扩增提供依据。
1 材料与方法
1.1 材料与试剂 皮肤取自本院泌尿外科16~22岁行包皮环切术患者,患者无泌尿系统感染等疾病。患者均知情同意。实验试剂包括中性蛋白水解酶、胰蛋白酶+EDTA、Ⅳ型胶原(Sigma公司),角质形成细胞无血清培养基(K-SFM)(Gibco公司),PBS液、Ck19单克隆抗体、β1整合素单克隆抗体(博士德公司),IGF-1、bFGF及TGFα(PeproTech公司),CCK-8试剂盒(同仁公司)。
1.2 方法
1.2.1 表皮干细胞的分离与培养 取得的新鲜包皮在含有青、链霉素的PBS液洗涤数次至洗涤液纯净,无菌条件下去除皮下组织,并将皮片剪成1cm× 1 cm大小,加入1U/ml中性蛋白水解酶,4℃冰箱过夜。次日,用 PBS液清洗3次,分离表皮和真皮。获得的表皮放入0.05%胰蛋白酶+EDTA的消化液中,室温消化5 min后终止消化,经200目细胞筛过滤,获得角质形成细胞悬液。将角质形成细胞悬液800 r/min离心8min,离心半径15cm。弃上清液,加入K-SFM5 ml,接种于已经用Ⅳ型胶原包被过25 cm2培养瓶,37℃、5%CO2孵箱中培养约20 min,去除悬浮的细胞和杂质,继续孵箱内培养,隔天换液。待细胞约70%~80%融合时,消化、收集细胞,调整密度为1×105/ml,再接种在已包被Ⅳ型胶原的培养皿中继续培养。
1.2.2 实验分组 按添加细胞生长因子的不同分为4组,依次为A组(K-SFM)、B组(K-SFM+10 ng/ml bFGF)、C组(K-SFM+10 ng/ml IGF-1)、D组(K-SFM+10 ng/ml TGF-α)。
1.2.3 培养细胞的鉴定 取生长良好的第2代培养细胞进行细胞爬片。细胞生长达到适当的密度时,用冷丙酮4℃固定20min,PBS冲洗,按照博士德ABC免疫组化染色试剂盒说明进行抗体的免疫组化染色。DAB显色,室温10 min,PBS洗中止显色反应,苏木精衬染,逐级酒精脱水后二甲苯透明,中性树胶封片。一抗为Ck19单抗及β1整合素单抗。
1.2.4 细胞生长曲线测定 取第2代生长良好的表皮干细胞,以2×103密度接种于96孔板中,分成4组,每组6孔,分别加入相应的培养基。用MTT法测定波长490 nm下A值,计算平均值,连续计数7次,未计数细胞换液1次/2 d。
1.2.5 细胞克隆形成率的测定 取第2代表皮干细胞,按200个/孔接种至预先用Ⅳ型胶原包被过的24孔板中,分成4组并加入相应培养基培养,每组6孔。培养1周后,记录克隆数(细胞数≥50个记为1个克隆)。

1.2.6 细胞增殖的测定 利用CCK-8试剂盒检测观察培养第5天的细胞增殖情况,每种不同细胞因子每次测定6孔。取第2代表皮干细胞,按10000个/孔接种于96孔板,每组6孔,隔天换液,于第7天用CCK-8测定450 nm下A值。
1.2.7 细胞周期分析 0.25%胰酶 +0.02% EDTA消化,制备细胞悬液;PBS洗涤2次,70%乙醇4℃固定过夜,用流式细胞仪进行细胞周期分析,每组4个样本。
2 结 果
2.1 免疫细胞化学染色结果 β1整合素、CK19免疫细胞化学染色显示培养细胞的细胞质内出现棕黄色的阳性表达,表明所培养细胞为表皮干细胞,见图1。

图1 培养的细胞CK19及β1整合素免疫组化染色(×200)Figure 1 Cultured cells stained by immunohistochemistry on CK19 and β-integrin(×200)
2.2 细胞生长曲线 从图2可以看出,4组细胞的生长曲线均呈倒“S”形,细胞在第5天进入倍增期。未添加细胞因子组ESC在第9天达到高峰。而所有添加细胞因子ESC组在第11天时进入平台期。
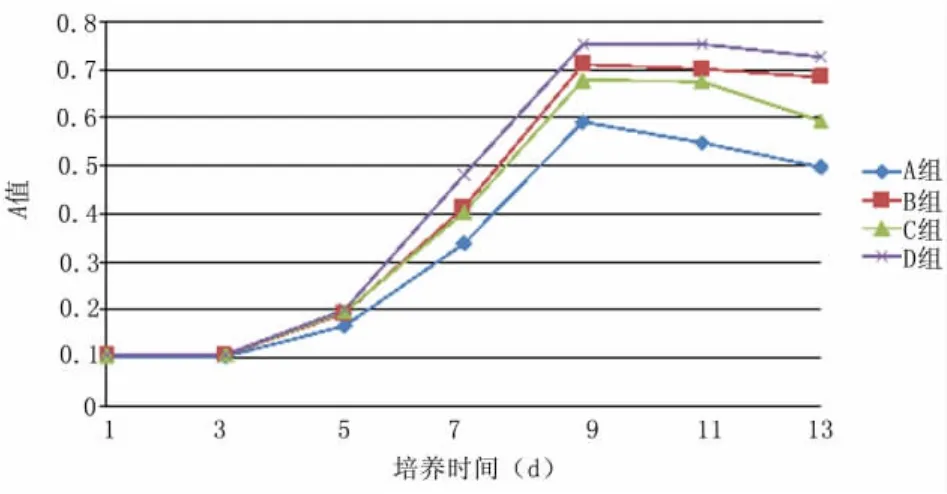
图2 各组表皮干细胞的生长曲线Figure 2 The growth curve of the epidermal stem cells in different groups
2.3 细胞克隆形成率 A组细胞克隆形成率为(10.0±0.7)%,B组细胞克隆形成率为(14.0± 0.9)%,C组细胞克隆形成率为(13.7±0.6)%,D组细胞克隆形成率为(16.4±0.9)%。B、C及D组细胞克隆率明显高于A组(P<0.05);而D组细胞克隆率明显高于B组及C组(P<0.05);B组与C组之间差异无统计学意义(P>0.05)。
2.4 CCK-8检测吸光度A值 第7天时,B、C及D组A值均明显高于A组(P<0.05);而D组高于B组及C组(P<0.05);B组及C组之间差异无统计学意义(P>0.05),见表1。
表1 各组表皮干细胞第7天检测的A值(,n=6)Table 1 The absorbance value of the epidermal stem cells in different groups at 7 d(,n=6)

表1 各组表皮干细胞第7天检测的A值(,n=6)Table 1 The absorbance value of the epidermal stem cells in different groups at 7 d(,n=6)
与A组比较,*P<0.05;与D组比较,#P<0.05
组别 A值A组0.502±0.006 B组 0.603±0.013*# C组 0.584±0.015*# D组 0.677±0.027*
2.5 细胞周期分析 B组及C组G0/G1细胞比例明显高于A组及D组(P<0.05);而B组与C组之间及A组与D组之间差异无统计学意义(P>0.05),见表2。
表2 各组表皮干细胞细胞周期分析(,n=4)Table 2 The cell cycle of the epidermal stem cells in different groups(,n=4)

表2 各组表皮干细胞细胞周期分析(,n=4)Table 2 The cell cycle of the epidermal stem cells in different groups(,n=4)
与A组比较,*P<0.05;与D组比较,#P<0.05
组别 G0/G1期细胞 G2/M期细胞 S 期细胞A组55.6±2.1 15.3±4.2 29.1±5.4 B组 62.8±2.4*# 6.5±2.3 30.8±2.6 C组 63.3±2.3*# 13.6±2.2 23.2±1.9 D组 56.0±1.0*6.9±2.6 37.1±2.7
3 讨 论
表皮干细胞在皮肤的维护及修复中具有重要作用[1]。表皮干细胞是皮肤创伤修复再生理想的种子细胞,具有强大的可塑性,同时免疫原性较低,适合作为组织工程化皮肤的种子细胞[2-3]。目前多采用Rheinwald和Green[4]建立培养角质化细胞的方法培养表皮干细胞[11]。但利用少量的表皮干细胞培养增殖达到足够数量的细胞较为困难,干细胞的自我更新及分化发育与其周围的组织微环境密切相关[5-7]。
生长因子是指具有调控细胞生长、发育的一类生物活性物质。它们通过自分泌和旁分泌方式调节各种细胞的增殖和分化,多种生长因子已证明对干细胞的体外培养具有作用。bFGF是一种肝素结合的多肽类丝裂源,广泛分布于垂体、脑、神经、视网膜、肾上腺和胎盘等组织中,可刺激多种细胞增殖[8]。IGF-1是一种类胰岛素的细胞生长因子,具有促合成代谢作用,又有促生长作用的多肽,能增加葡萄糖和氨基酸的吸收,抑制蛋白质降解,刺激各种细胞的增殖和分化,对多种组织和细胞起有丝分裂源作用[9-10]。TGFα是与组织、细胞生长发育有关的一种促生长因子,可在多种组织和细胞中产生,以自分泌、旁分泌和邻分泌的方式发挥作用,通过作用于细胞膜表皮生长因子受体发挥作用,刺激多种细胞合成DNA[11]。
通过改变培养基中的细胞因子种类改变表皮干细胞生长的微环境可以影响细胞的增殖及表型的维持。本实验结果显示,未添加细胞生长因子的表皮干细胞在第9天出现接触抑制,而所有添加细胞生长因子的表皮干细胞则继续增殖,第11天时才出现接触抑制;另外CCK-8的检测结果及细胞克隆率的检测结果均表明添加细胞因子组细胞增殖能力明显高于未添加细胞因子组细胞,这表明bFGF、IGF-1及TGFα均可促进表皮干细胞的增殖,且检测数据显示TGFα效果最为显著。细胞周期分析显示,添加bFGF和IGF-1组G0/G1细胞比例明显高于未添加细胞生长因子组,而添加TGFα组G0/G1细胞比例与未添加细胞生长因子组无明显差异,从而表明bFGF和IGF-1在表皮干细胞表型维持方面有较好效果。
本研究结果证明,需要使更多表皮干细胞维持低分化状态时宜应用bFGF及IGF-1。而当组织工程需要短时间获得大量细胞时应用bFGF、IGF-1及TGFα均可,但以TGFα效果较好。该结论可为组织工程化皮肤细胞的大量获取提供依据。
[1] Zhang CP,Fu XB.Therapeutic potential of stem cells in skin repair and regeneration[J].Chin J Traumat,2008,11(4):209-221.
[2] 费 阳,张翠萍,付小兵.不同来源的表皮干细胞促进皮肤创面愈合的研究[J].中华实验外科杂志,2011,28(2):215-217.
[3] 谭 谦.再生医学与组织工程[J].医学研究生学报,2011,24(2):113-116.
[4] Rheinwald JG,Green H.Serial cultivation of strains of human epidermal keratinocytes:The formation of keratinizing colonies from single cells[J].Cell,1975,6(3):331-344,
[5] 孙晓艳,付小兵,盛志勇,等.胚胎组织提取液影响表皮干细胞表型变化的初步研究[J].中国病理生理杂志,2008,24 (2):883-887.
[6] Morasso ML,Tomic-Canic M.Epidermal stem cells:the cradle of Epidermal determination,differentiation and wound healing[J].Bio Cell,2005,97(3):173-183.
[7] Moore KA,Lemischka IR.Stem cells and their niches[J].Science,2006,311(5769):1880-1885.
[8] Keller R.Stem cells on the way to resto rativemedicine[J].Immunol Lett,2002,83(1):1212.
[9] 王书奎.胰岛素样生长因子2的基因组印迹及与肿瘤关系的研究进展[J].医学研究生学报,2010,23(2):113-116.
[10] 赵海波,罗丽兰,刘 义.胰岛素样生长因子一1对卵母细胞成熟度、受精力及卵裂力的影响[J].中华妇产科杂志,1997,32(10):586-588.
[11] Rothenberg ML,Lafleur B,Levy DE,et al.Randomized phaseⅡtrial of the clinical and biological effects of two dose levels of gefitinib in patients with recurrent colorectal adenocarcinoma[J].J Clin Oncol,2005,23(36):9265-9274.
Effects of insulin-like growth factor-1,basic fibroblast growth factor and transforming growth factor α on the proliferation of human epidermal stem cells
CHEN Jian-guo,MENG Qing-nan,ZHAO De-mei,TAN Qian
(Department of Plastic and Burns,Drum Tower Hospital Affiliated to Nanjing University Medical School,Nanjing210008,Jiangsu,China)
Objective Epidermal stem cells are"seed cells"of the tissue-engineered skin.We studied the effects of IGF-1,bFGF and TGF α on the proliferation of epidermal stem cells. Methods We obtained primary epidermal stem cells using the twostep enzyme digestion and type-IV collagen coated chosen methods.We cultured the epidermal stem cells in K-SFM(group A),K-SFM+10ng/ml bFGF(group B),K-SFM+10ng/ml IGF-1(group C)and K-SFM+10 ng/ml TGF-α(group D),and compared their proliferation ability,cell growth curve,colony-forming rate and cell cycle in different media. Results The proliferation ability and colony-forming rate of the epidermal stem cells were significantly higher in groups B,C and D than in A(P<0.05),and so was the proportion of the cells of the G0/G1phase in groups B and C than in A and D(P<0.05). Conclusion IGF-1,bFGF and TGF α promote the proliferation of epidermal stem cells,and IGF-1 and bFGF can effectively maintain their phenotype.
Insulin-like growth factor-1;Basic fibroblast growth factor;Transforming growth factor α;Epidermal stem cell; Proliferation
Q28
A
1008-8199(2012)08-0789-04
江苏省"333高层次人才培养工程"科研项目(NJGL-2007116)
210008南京,南京大学附属鼓楼医院整形烧伤外科[陈建国(医学硕士研究生)、孟庆楠、赵德梅、谭 谦]
谭 谦,E-mail:njtanqian@163.com
2012-04-12;
2012-06-29)
(责任编辑:闻 浩;英文编辑:罗永合)

