针刺对神经干细胞海马内移植老年性痴呆大鼠行为学和NPY 表达的影响*
杨春壮 马 英 刘艳翠 徐永良 郑海兴 陆迪 任宝松 李俊俊 牡丹江医学院(牡丹江157011)
老年性痴呆(Alzheimer Disease,AD)多发生在老年,以近期记忆障碍为主要临床症状,其病因及发病机理尚不清楚,多种治疗方法目前正在探索中。NSCs具有自我更新能力,并有向多细胞(神经元、星形胶质细胞和少突胶质细胞等)分化的潜能[1]。目前NSCs对AD 的治疗具有潜在的治疗前景[2-3]。而针刺对NSCs移植后的影响文献报道较少。本实验采用β-AP向海马CA1区定向注射制做AD 模型,利用体外分离培养的NSCs移植入AD 大鼠,探讨针刺对NSCs移植后对AD 大鼠海马NPY 表达的影响,改善AD 鼠的学习记忆能力。
1 材料和方法 1.1 仪器和试剂 KWD-808Ⅱ型电针仪(上海),脑立体定位仪,NPY 免疫组化试剂盒(武汉博士德生物工程有限公司)。DMEM/F12(1∶1)培养基和B27无血清添加剂、表皮生长因子(EGF)和碱性成纤维细胞生长因子(bFGF)、β—AP(美国Sigma公司)。
1.2 AD 动物模型的制备 健康成年雄性Wistar大鼠60只,体重(300±50)g[由黑龙江中医药大学实验动物中心提供,实验动物合格证号:SCXK(黑)2008004],随机分为5组,正常对照组(正常组)12 只,其余单侧(左侧)海马注射β-AP 制作AD 模型。制做痴呆模型后,将剩余48只随机分成4组:模型组12只,针刺组12只,NSCs移植组(移植组)12只,移植后针刺组(移植针刺组)12只。大鼠用20%乌拉坦(0.55mL/kg)行腹腔注射,动物麻醉后采用平头颅位固定于脑立体定位仪上,按脑立体定位图谱(AP=2.22mm ML=3.0mm DR=2.8mm)向海马注射1μLβ—AP(恒温培养箱37℃卵育1W,临用前生理盐水配制成5μg/μL浓度)。缓慢匀速推注,时间不少于5min,再留针3min。正常组不注射。
1.3 NSCs的分离和纯化 取新生24h以内的Wistar大鼠在无菌条件下分离海马,经胰蛋白酶消化、吹打制成单细胞悬液,以(4~6)×104/mL的细胞浓度加入含B27、表皮生长因子(EGF)和碱性成纤维细胞生长因子(bFGF)(终浓度均为10 ng/mL)的DMEM/F12无血清培养基的培养瓶中,置于37℃、5%CO2培养箱内培养。每天镜下观察,待原代克隆形成后机械分离成单细胞悬液,按上述条件继续培养。以后每5~7d分离克隆传代一次,方法同前。
1.4 海马内NSCs移植 将传至第4代的NSCs球悬液移入10mL的离心管内,吹打制成单细胞悬液,调整细胞浓度至1×104/μL 备用。动物模型建立后,行同侧(左侧)海马NSCs移植。坐标为:AP=2.22mm ML=3.0mm DR=2.8mm,用10μL的微量注射器吸取5μL 细胞悬液,将注射器固定于脑立体定位仪上,在20min内注射完毕,留针5 min。缓慢拔出针头,缝合皮肤。
1.5 针刺方法 采用30号1寸毫针,选取大鼠百会、大椎、人中三个穴位,直刺0.5寸,接通KWD—808Ⅱ型电针仪,刺激参数:疏密波,频率10Hz,电压1.5V,留针10min,持续电刺激,每日1次,连续30d。
1.6 跳台实验 针刺后,隔日进行跳台实验。实验时,将大鼠放入装置中,使其适应3min,然后通以40V 交流电。大鼠受电击后,其正常反应是跳到安全台躲避电击。记录通电后大鼠受电击至跳上跳台的时间,作为反应期。
1.7 组织切片 跳台实验测试完毕后隔日麻醉动物,经左心室-升主动脉罐注200mL生理盐水和250mL 含4%多聚甲醛的磷酸缓冲液(PB)。取脑后固定2~4h,依次入含15%蔗糖和30%蔗糖PB液中置4℃冰箱过夜,沉底备用。用冰冻切片机将海马作冠状连续切片,片厚5μm。
1.8 免疫组化步骤 ①脱蜡、水化组织切片。②3% H2O2去离子水孵育5~10min,阻断内源性过氧化物酶。蒸馏水洗3次。③热修复抗原:将切片浸入0.01M 枸椽酸盐缓冲液(1000mL)蒸馏水中(C6H5Na3O7·2H2O 3g,C6H8O7·H2O 0.4g,PH 为6.0),微波炉加热至沸腾后断电,间隔10 min后,反复2 次。冷却后0.1M PBS(100mL 蒸馏水中加NaCl 9g,NaHPO4·12H2O 6g,Na2HPO4·2H2O 0.4g,PH7.2~7.4)洗涤2次。④滴加一抗(兔抗大鼠NPY),工作浓度1:50,放入湿盒4℃过夜。⑤滴加生物素化羊抗兔IgG,37℃30min。0.1MPBS洗2min×3次。⑥DAB显色:使用DAB显色试剂盒(ED1022)。取1mL蒸馏水,加试剂盒中A、B、C 试剂各1滴,混匀后加至切片。室温显色,镜下控制反应时间,一般在5~10min之间。蒸馏水洗涤。⑦苏木素轻度复染脱水、透明、封片。显微镜观察并拍照。
2 结 果 2.1 针刺后各组大鼠学习成绩
表1 针刺后各组大鼠学习成绩的比较(±s单位:s)

表1 针刺后各组大鼠学习成绩的比较(±s单位:s)
与模型组比较△P<0.05 与正常组比较▲P<0.01
组 别n 反应期正常组12 5.25±4.71模型组12 10.68±8.96▲移植组12 6.76±10.65△针刺组12 5.91±6.21△移植针刺组12 5.76±7.52△
2.2 针刺对各组大鼠海马NPY 表达的影响
表2 针刺对各组大鼠海马NPY 表达影响的比较(±s mm2)
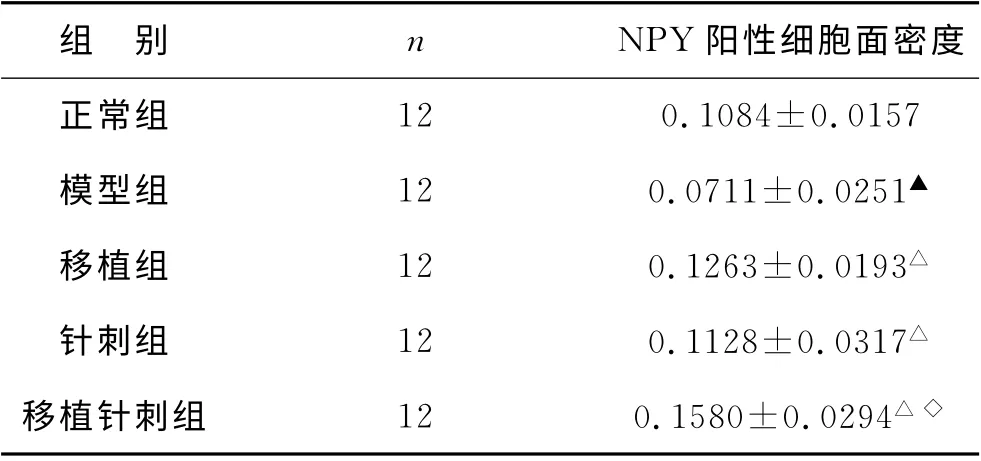
表2 针刺对各组大鼠海马NPY 表达影响的比较(±s mm2)
与模型组比较△P<0.01 与正常组比较▲P<0.05与移植组比较◇P<0.05
组 别n NPY 阳性细胞面密度正常组12 0.1084±0.0157模型组12 0.0711±0.0251▲移植组12 0.1263±0.0193△针刺组12 0.1128±0.0317△移植针刺组12 0.1580±0.0294△◇
3 讨 论 老年性痴呆(AD)是由多种原因引起的脑退行性疾病,临床常伴随有学习记忆能力的下降,病理检查发现海马、皮层、杏仁核中NPY 免疫反应阳性神经元显著减少,同时还伴有[3H]NPY 结合水平显著下降[4]。现已知,NPY 是哺乳动物神经系统中含量最丰富的多肽之一,对动物的学习记忆过程有着明显的调节作用[5]。NPY 在中枢神经系统中主要分布在大脑皮层、海马结构、丘脑、下丘脑及脑干等处,尤以海马结构中浓度最高,而海马结构是调节学习和记忆的关键部位[6]。在海马结构中,大量的NPY 神经元存在于CA1区的锥体细胞层、CA2与CA3区的多形层以及齿状回的门区。已有多项研究结果发现,在伴有学习记忆损害的疾病中可见到中枢神经系统NPY 免疫阳性神经元数量的明显减少[7]。NSCs治疗AD 的目的主要通过两种途径:①内源性途径,即诱导内源性NSCs增殖与分化,使受损伤的中枢神经系统进行自我修复;②外源性途径,即直接替代缺损组织或植入基因工程细胞,这一类细胞能分泌促进干细胞增殖与存活的因子[8]。NSCS移植治疗改善大鼠的空间学习记忆能力的机制目前还不完全清楚,可能的机制有:①移植的NSCs使基底前脑胆碱能神经元数目明显增加,代替溃变的胆碱能神经元,同时提高了中枢胆碱能系统的活性,改善隔区、海马等记忆中枢的功能。②移植的NSCs通过与宿主细胞的相互作用使脑内核酸和蛋白质的合成增加,提高了大脑的兴奋状态。③移植的细胞在体内分泌一些细胞因子和神经营养物质,从而促进神经元的存活和神经纤维的再生,形成侧支发芽,提高胆碱能纤维的数量。④证据表明,无论是在发育、成熟还是在衰老过程中,突触都处于不断的退化和重建的动态过程之中,NSCs通过诱导宿主脑突触的可塑性使退变的组织细胞产生新的突触。
现代研究认为,针刺主要通过以下四个方面达到延缓衰老目的:一是提高机体免疫功能;二是可改善脑的氧代谢和血流量;三是可调整神经生化代谢的紊乱;四是可减少自由基的产生。中医文献中无“老年性痴呆”的病名,根据其临床表现认为本病属中医“呆病”、“健忘”、“癫证”等范畴。其病因病机为肝肾亏虚、气滞血瘀,以肾气虚衰、髓海空虚、脑神失养为其根本。临床研究表明针灸治疗AD 疗效显著。针刺治疗AD 的原则是补肾活血、醒神开窍。补肾活血以治其本,醒神开窍以治其标。标本同治,尽早缓解症状,提高患者生存质量。
在上述治疗原则的指导下,本实验选取百会、大椎、人中三穴。百会穴为督脉和足太阳膀胱经的交会穴,具醒神开窍之功,为治疗老年性痴呆的主要穴位,经临床证实对于本病可能出现的精神、神志异常均有一定的疗效。大椎出自《素问·气府》,属督脉经穴位,是手足六阳经的交会穴,为“诸阳之会”,可通调诸经,增强各脏腑经络之功效,促使阴阳平衡。人中位于鼻下嘴上,鼻通天气,嘴通地气,该穴位于天地之间,正是“诸阳之海”的督脉与“诸阴之海”的任脉交会点,具有调合阴阳之功,能涤荡蒙蔽、醒脑开窍、疏经通络的作用。取此三穴,可通督调神、调合阴阳,有畅行血脉、行气化痰、活血生精、藏精生髓之功。AD 最早最重要的症状之一即近期记忆障碍,基于此,本实验采用大鼠跳台实验,以验证其学习记忆功能。跳台实验是一次性回避反应实验,操作简单,能够比较客观地反映动物经过一次刺激后记忆的获得能力。实验表明针刺能够减少AD 大鼠的跳台反应期,改善学习记忆。结合AD 病变中海马NPY免疫反应阳性神经元显著减少,本实验以免疫组化方法定量测定了NPY 的表达。结果显示,移植针刺组大鼠海马NPY 表达比模型组增加(P<0.01),同时与移植组比较有显著性差异,说明针刺结合干细胞移植比单纯干细胞移植效果更好。
[1] Fibiger HC.Cholinergic mechanisms in learning,memory and dementia:a review of recent evidence[J].Trends Neurosci,1991,14(6):220-223.
[2] Chow S Y,Moul J,Liu Y,et al.Survival and differentiation of rat spinalcord stem cells grafted into normal and in-jured adult spinal cord[J].SocNeurosci Abstr,1998,23(2):905-918.
[3] Asahara T,Kalka C,Isner JM.Stem cell therapy and gene transfer forregeneration[J].Gene Ther,2000,7:451-457.
[4] Redrobe,JP,Dumont Y St-Pierre JA,et al.Multiple receptors for neuropeptide Y in the hippocampus:putative roles in seizures and cognition[J].Brain Res,1999,848(1-2):153-66.
[5] 池 霞.神经肽Y 与学习记忆的研究进展[J].国外医学:儿科学分册,2002,29(2):67-70.
[6] 林 鸿,季 迁,李敏,等.海马损伤对大鼠学习和记忆的影响[J].中国临床康复,2002,6(13):1912.
[7] Bracci-Laudiero L,Aloe L, Lundeberg T, et al.Altered levels of neuropeptides characterize the brain of lipus prone mice.Neurosci Lett 1999,275:57-60.
[8] 武 强,李露斯.神经干细胞治疗阿尔茨海默病研究进展[J].中国康复理论与实践,2006,12(10):871-874.

