基质金属蛋白酶-13、白细胞介素-1在大鼠退变腰椎间盘组织中的表达及意义
孙东良 张胜强 于灵灵
河北省唐山市唐海县医院神经外科,河北唐山 063200
大鼠切除卵巢(OVX)模型与绝经后妇女骨质疏松症最为相似,OVX大鼠由于骨量丢失,椎间盘应力发生变化,从而导致椎间盘退化,但确切的分子机制还不很清楚,因此,本实验建立OVX大鼠OP模型,通过组织学、形态学及相关因子的观察探讨椎间盘退变的机制。
1 材料与方法
1.1 实验动物及分组
选择健康3月龄雌性SD大鼠30只,体重(210±32)g(河北联合大学实验动物中心,Ⅱ级)。按体重随机分为三组,每组10只,其中,基础对照(BL)组,实验前处死大鼠取标本;去卵巢手术(OVX)组采用10 mL/L戊巴比妥钠(40 mg/kg)腹腔注射麻醉,在无菌条件下大鼠行背部入路双侧卵巢切除手术;假手术(sham)组大鼠暴露卵巢但不切除。术后3 d每日1次肌注青霉素20万单位/只,所有大鼠在同等条件下饲养,喂养12周后脱颈椎处死,处死前第10天和第4天分别皮下注射盐酸四环素(30 mg/kg)和钙黄绿素(6 mg/kg)。
1.2 标本处理
分别按“1.1”中时段对动物进行脱颈椎处死,切开大鼠背部皮肤,锐刀分离所有的软组织,切除棘突、横突等附件组织,切取L2椎体,用低速锯在近端作矢状面剖开骨髓腔,置于10%福尔马林中性缓冲液中准备硬组织切片,L4~5椎体及椎间盘置于10%福尔马林中性缓冲液中准备行HE常规染色、特殊染色及免疫组化。
1.3 硬组织切片制作
将刀片和标本块用40%的酒精适当浸润,碳化钨钢刀控制切片速度,用软毛刷和把针将切片放置载玻片展平,用75%酒精将载玻片适当湿润,放置塑料薄膜,酒精纸吸干多余的酒精,推压切片使之进一步平整、贴附,加盖一张载玻片保护首片,置于40℃~50℃烤箱中过夜,次日晨取出,荧光标记切片避光保存,每个标本切3张片,其中,两张进行VonKossa、Gemisa染色,另一张行荧光指标测量,并采用Leica Dmlb2荧光/光学显微镜及LeicaDC300数码摄像系统进行观察并摄取图像。
1.4 VG特殊染色方法
组织常规脱蜡至水,采用Weiger铁苏木素染液染5~10 min,稍水洗,1%盐酸酒精迅速分化,流水冲洗数分钟;VanGieson染液染1~2 min,倾去染液直接用95%的酒精急速分化数秒,无水酒精脱水,二甲苯透明,中性树胶封固。
1.5 椎间盘退变程度评分
根据Wang等[1]的评分方法对大鼠的退变椎间盘进行评分。见表1。

表1 腰椎间盘组织学评分
1.6 骨密度测量
①应用Norland-XR36双能X线骨密度测量仪(DEXA,美国),采用小物体扫描模式,准确度为0.01%,扫描速度为60 mm/s,分辨率(resolution)为1.0 mm×1.0 mm,扫描宽度为5.0 cm的参数值,进行L2~4腰椎整体骨密度的测量。②为了评价精确度,随机选取1例,在位置不变的情况下,连续测量tBMD 5次。③精确度用变异系数(CV)表示。
1.7 统计学方法
实验数据建立EXCEL数据库,采用SPSS 11.5统计学软件进行数据分析,计量资料数据用均数±标准差表示,各组数据经过Shapiro-Wilk正态性检验和Bartlett方差齐次检验后,利用单因素方差分析(ANOVA)和t检验比较各组之间的差异,以P<0.05表示差异有统计学意义。
2 结果
2.1 各实验组大鼠骨密度比较
骨密度测量的CV值为0.51%,这与Wang等[1]测量的精确度基本一致。OVX组较sham组骨密度显著下降(P<0.05)。见表2。
表2 各组大鼠骨密度比较(±s)
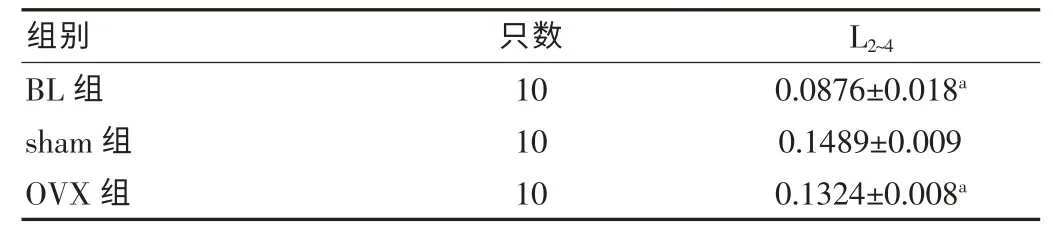
表2 各组大鼠骨密度比较(±s)
注:与sham组比较,aP<0.05
组 别 只数 L2~4 BL组sham组OVX组10 10 10 0.0876±0.018a 0.1489±0.009 0.1324±0.008a
2.2 骨形态计量学比较
与sham组相比,OVX组大鼠的静态骨形态学的骨量指标显著性下降(BV/TV和Tb.N),而骨小梁分离度(Tb.Sp)和反映破骨细胞指标的Oc.No/BV和Oc.Pm/BS显著性提高(表3);反映矿化骨表面(MS/BS)和骨形成率(MAR,BFR/BS和BFR/BV)的动态指标,OVX组明显高于sham组(表4)。
表3 两组椎体松质骨静态骨形态计量学指标比较(±s)

表3 两组椎体松质骨静态骨形态计量学指标比较(±s)
注:与sham组比较,aP<0.05
组别 只数 BV/TV(%)Tb.N(/mm)Tb.Th(μm)Tb.Sp(μm)Oc.No/BV(/mm2)Oc.Pm/BS(%)sham组OVX组10 10 18.98±3.77 8.86±2.67a 2.73±0.47 1.24±0.36a 74.67±6.46 68.22±7.13 305.57±65.4 779.38±31.25a 8.76±0.70 12.48±1.30a 0.40±0.03 0.64±0.10a
表4 两组椎体的松质骨动态骨形态计量学指标(±s)

表4 两组椎体的松质骨动态骨形态计量学指标(±s)
注:与sham组比较,aP<0.05
组别 只数 sL.Pm(mm)dL.Pm(mm)MS/BS(%)MAR(μm/d)BFR/B(μm/d×100)BFR/BV(%year)sham组OVX组10 10 2.13±0.86 1.44±0.28 0.98±0.11 0.62±0.27a 5.45±1.34 7.46±3.54a 1.35±0.13 1.98±0.10a 9.25±3.13 15.22±7.36a 79.54±33.47 116.60±38.76a
2.3 组织学表现和椎间盘组织学评分
BL组软骨细胞分层排列清晰,关节软骨终板由多层成熟软骨细胞组成的透明软骨,胞质丰富,髓核由大量细胞核清晰的脊索细胞组成,主要集中在髓核中部,纤维环胶原纤维排列规则,内层纤维环较薄。sham组软骨细胞排列规则,与椎体相邻部有大量软骨组织舌样突出,关节软骨终板透明,组织结构清晰,细胞排列有序,软骨陷窝存在,与继发性骨化中心相连的透明软骨钙化,潮标清晰可见,虽然较BL组出现软骨下骨班板增厚和部分软骨终板骨化,但软骨终板内分布有大量粗大的血管,髓核内脊髓细胞呈羽毛状或团块样分布,细胞形态完整,纤维环内层纤维软骨较BL组有显著的增生变厚,外层纤维环胶原纤维排列规则。OVX组关节软骨终板成熟软骨细胞变性坏死,数量较对照组减少,细胞排列紊乱,关节软骨终板厚度变薄,在软骨终板和髓核之间的过渡区内的软骨细胞被纤维环内层增生的纤维软骨细胞所代替,基质内出现大量排列的胶原纤维,在靠近次级骨化中心的关节软骨基底层出现大量增生活跃的小软骨细胞,次级骨化中心增生并向终板中央侵入,使透明软骨终板面积减少,骨化增加,增厚的骨板血管腔明显减少,与之毗邻的髓核脊索细胞明显减少,被软骨样细胞取代或发生黏液样变。
sham组、OVX组椎间盘组织学评分较BL组显著性提高(P<0.05),OVX组的评分较sham组提高,但差异无统计学意义(P>0.05)。见表5。
2.4 MMP-13、IL-1蛋白表达情况
光镜下观察显示,MMP-13蛋白的表达在胞浆,呈棕黄色颗粒状,OVX组的表达明显高于sham组和BL组(P<0.05),sham表达组高于BL组,但两组间差异无统计学意义(P>0.05)。免疫组化平均灰度值结果,见表6。
表5 各组大鼠椎间盘组织学评分比较(±s)

表5 各组大鼠椎间盘组织学评分比较(±s)
注:与BL组比较,aP<0.05;bP<0.05
组别 只 数 L4~5 BL组sham组OVX组10 10 10 0.10±0.28 1.48±0.67a 4.55±1.34a
表6 MMP-13、IL-1蛋白表达情况(±s)

表6 MMP-13、IL-1蛋白表达情况(±s)
注:与sham组比较,aP<0.05
组别 只数 MMP-13 IL-1 BL组Sham组OVX组10 10 10 229.3±7.289 220.2±5.545 179.6±6.438a 215.7±8.664 210.1±3.785 151.5±7.438a
3 讨论
3.1 雌激素与椎间盘退变
多项研究证实,雌激素缺乏使破骨细胞的功能处于活跃状态,破骨增强,成骨细胞的功能由于缺乏雌激素的刺激处于部分抑制状态,导致骨代谢转换率增加,由此带来骨的分解代谢,使骨小梁变薄变细,其结果为骨组织减少,引起骨质疏松。雌激素可抑制由成骨细胞产生IL-1、TNF-α、IL-6等炎性因子对破骨细胞的增殖、分化和活化[2]。在失去雌激素的作用后,软骨骨基质成分减少,软骨细胞合成Ⅱ型胶原的能力下降,整个软骨层产生退变现象。同时破骨细胞大量生成,吞噬软骨下骨,使骨小梁变细,排列紊乱,使骨的强度下降。钙化软骨层出现破骨细胞,可能是加速软骨退变的主要因素之一[3]。OVX大鼠由于骨量丢失,椎间盘应力发生变化,从而导致椎间盘退化。
本研究结果表明:OVX组SD大鼠的子宫体和子宫角较sham组明显萎缩,发育不全;大鼠腰椎骨密度的变化显示,OVX组椎体骨量下降,成功复制了卵巢切除大鼠骨质疏松动物模型,并验证卵巢切除大鼠的骨量丢失是由于雌激素缺乏导致骨形成和骨吸收均明显增加,但破骨细胞活力增强,导致骨吸收大于骨形成,使骨量丢失。本研究发现:OVX组大鼠腰椎间盘发生严重退变,表现在椎间盘髓核脊索细胞数量减少,出现软骨样细胞,髓核黏液变,裂隙生成,软骨终板变薄,软骨细胞数量减少、钙化,甚至完全骨化,纤维环后部结构排列紊乱,厚度变薄,间隙增宽,椎体边缘骨赘增生,椎间盘组织学评分提高。
3.2 MMP-13、IL-1与椎间盘退变
MMP-13主要来源于软骨细胞,主要降解Ⅱ型胶原。虽然都是胶原酶,但是MMP-13对Ⅱ型胶原的催化效率大概是MMP-1对Ⅱ型胶原催化效率的5倍。MMP-13在退变椎间盘中的表达增强机制目前还不清楚,但是一系列的研究结果提示,MMP-13在椎间盘中的表达受到多方面因素的调节。以前的研究己经证明应力负荷可以诱发椎间盘退变,而最近的很多研究提示应力负荷可能与椎间盘退变中MMP-13的表达增强有关。MMP-13与椎间盘内的其他作用也可能具有协同效应,产生放大作用。有实验证实在人的正常椎间盘内存在MMP-2、MMP-3的表达,而且在退变椎间盘中MMP-2、MMP-3的 表 达 更 为 明 显。而MMP-2、MMP-3可 以 提 高MMP-13的活性,因此,它们之间可能具有一定的协同作用。国外学者在动物及人体实验中发现,退变椎间盘的MMP-13阳性率明显较正常椎间盘高[4-5]。正是因为MMP-13对软骨细胞的Ⅱ型胶原有重要的降解作用,所以研究其在椎间盘退变中的表达可能具有重要意义。本实验结果有力地支持了这一设想。本实验结果表明:退变腰椎间盘中MMP-13的蛋白表达较对照组明显增强,说明MMP-13在腰椎间盘退变中具有重要调节作用。
IL-1是炎症反应的关键酶,可促进前列腺素、白三烯、血栓素、血小板活化因子等重要炎性介质的分泌,另外以通过酶解细胞膜磷脂,可直接造成细胞膜损害。IL-1可促进体外培养的椎间盘细胞产生PGE2且呈一定程度的剂量依赖关系,后者被认为在疼痛产生中起到相当重要的作用。另外IL-1又可影响基质中的蛋白多糖的代谢,小剂量的IL-1对软骨基质中的蛋白多糖的合成具有抑制作用,而较大剂量对蛋白多糖的降解具有刺激作用。Shinmei等[6]用免疫组化方法观察到退行性骨关节病患者软骨IL-1染色为阳性反应。本实验结果也显示,OVX大鼠椎间盘组织中IL-1表达高于其他组。
MMP-13、IL-1在退变椎间盘中表达增强的机制目前还不清楚,在椎间盘退变过程中,MMP-13、IL-1分别起到了重要的作用,很多研究也证实了MMP-13、IL-1是椎间盘基质分解的重要因子,MAPKs家族中的P38和NF-κB在MMPs合成过程中发挥重要作用,并可能在椎间盘退变病程中发挥重要作用,证实椎间盘退变可能为细胞因子的减少和致炎因子增多导致MMPS活性增加,加剧细胞退变。IL-1是MMP-13的有效诱导剂,IL-1使处理过的椎间盘细胞中MMP-13的基因表达增强,Ⅱ型胶原基因表达下降[7]。
综上所述,本实验证实了MMP-13、IL-1表达的增加是椎间盘退变的重要因素,为临床治疗提供了理论依据,但具体的信号传导途径还有待于进一步研究。
[1]Wang T,Zhang L,Huang C,et al.Relationship Between Osteopenia and Lumbar Intervertebral Disc Degeneration in Ovariectomized Rats[J].Calicif Tissue Int,2004,75:205-213.
[2]Shevde NK,Bendixen AC,Dienger KM,et al.Estrogens suppress RANK ligand-induced osteoclast differentiation via a stromal cell independent mechanism involving c-Jun repression[J].Proc Natl Acad Sci USA,2000,97:7829-7834.
[3]Szuwart T,Kierdof H,Kierdof U,et al.Histochemical and ultrastructural studies of cartilage resorption and acid phosphatase activity during antler growth in fallow deer[J].Anat Rec,2002,268:66-72.
[4]Anderson DG,Izzo MW,Hall DJ,et al.Comptsaration gene expression profiling of normal and degenerative discs:analysis of a rabbit annular laceration model[J].Spine,2002,27:1291-1296.
[5]Roberts S,Caterson B,Menage J,et al.Matrix metalloproteinases and aggrecanase:their role in disorders of the human intervertebral disc[J].Spine,2000,25:3005-3013.
[6]Shinmei M,Masuda K,Kikuchi T,et al.Production of cytokins by chondrocytes and its role in proteoglycan degradation[J].Rheumato(Suppl),1991,27:89-91.
[7]Guiot BH,Fessler PG.Molecular biology of degeneration disc disease[J].Neurosurgery,2000,5:1034-1040.

