内皮型一氧化氮合酶和亚甲基四氢叶酸还原酶基因多态性与早发冠心病的关系
马 娟 陈吉丽 许 峰 张鸿青
昆明市第一人民医院,云南昆明 650011
随着现代医学的迅速发展,从基因水平阐明冠心病(coronary heart disease,CHD)尤其是早发CHD发病机制成为医学研究的热点[1]。早发CHD是冠心病的一种特殊形式,指冠心病发生时男性≤55岁,女性≤65岁[2]。国外人群研究显示内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)及亚甲基四氢叶酸还原酶(methylenete trahydro folate reductase,MTHFR)的基因变异可能参与CHD的发生发展,为进一步探讨这两种基因多态性与早发CHD发病的相关性,笔者应用先进的基因芯片技术进行研究,现报道如下:
1 对象与方法
1.1 对象
收集2007年1月~2009年12月在我院住院和门诊就诊的患者,根据缺血性心脏病(IHD)的命名和诊断标准入选CHD患者,入选人群之间无血缘关系。均行冠状动脉造影证实冠状动脉病变,至少一支主要血管狭窄程度≥50%。共完成基因芯片检测24例,其中女4例,男20例,平均年龄(49.60±6.23)岁,以男≤55岁及女≤65岁患冠心病为早发冠心病组;对照组入选65例,其中女22例,男43例,平均年龄(69.16±7.79)岁,以男>55岁及女>65岁患冠心病为迟发冠心病组。对两组的一般情况进行比较,早发CHD组年龄显著低于对照组(P=0),三酰甘油显著高于对照组(P=0.003),性别比列、总胆固醇、高密度脂蛋白、低密度脂蛋白、左室舒张末径、左室收缩末径、左室射血分数差异均无统计学意义(P>0.05)。见表1。
1.2 基因多态性检测
用上海百傲生物技术有限公司提供的基因芯片,可同时检测eNOS298、MTHFR667两个位点基因多态性。
1.2.1 标本采集 用一次性无菌注射针头采集被检者静脉血0.5 mL,将血样放入含50μL的2% EDTA溶液的无菌1.5 mL离心管中,盖上管盖,上下颠倒数次使混匀。
1.2.2 模板DNA的提取 取全血200μL加入红细胞裂解液600μL,混匀,静置8 min;6 000 r/min离心,弃上清;加入红细胞裂解液100μL,混匀,2 500 r/min离心,弃上清;加入裂解液100μL,混匀,沸水浴中15 min,10 000 r/min离心10 min后取上清备用。
1.2.3 PCR扩增反应体系 YN扩增液21μL,Taq酶0.8μL,模板DNA 3μL。
表1 两组一般情况比较(±s)
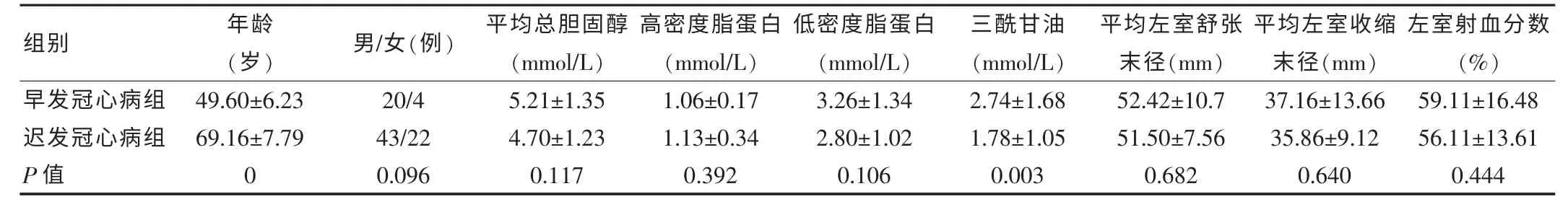
表1 两组一般情况比较(±s)
组别 年龄(岁)男/女(例)平均总胆固醇(mmol/L)高密度脂蛋白(mmol/L)低密度脂蛋白(mmol/L)三酰甘油(mmol/L)平均左室舒张末径(mm)平均左室收缩末径(mm)左室射血分数(%)早发冠心病组迟发冠心病组P值49.60±6.23 69.16±7.79 0 20/4 43/22 0.096 5.21±1.35 4.70±1.23 0.117 1.06±0.17 1.13±0.34 0.392 3.26±1.34 2.80±1.02 0.106 2.74±1.68 1.78±1.05 0.003 52.42±10.7 51.50±7.56 0.682 37.16±13.66 35.86±9.12 0.640 59.11±16.48 56.11±13.61 0.444
1.2.4 PCR扩增参数 预变性94℃5 min,变性94℃25 s,退火56℃25S,延伸72℃25S,热循环数40,后延伸72℃5 min。
1.2.5 PCR扩增产物的检测 用2%的琼脂糖凝胶电泳分离PCR扩增产物,溴乙啶(BE)染色,Gel Doc 2000 TM凝胶成像分析仪分析判断结果。
1.2.6 预杂交 取PCR扩增产物2.5~5.0μL,加入预杂交液55μL,98℃热变性5 min后置入冰盒,-20℃保存备用。
1.2.7 杂交 ①在基因芯片杂交舱中加入杂交液220μL,于45℃静置5 min,弃去杂交液。②加160μL杂交缓冲液于预杂交的PCR扩增产物中,混匀,再加入到杂交舱中。③将基因芯片放入45℃恒温箱中,保温30 min。④取出基因芯片,弃去杂交舱中溶液。⑤在杂交舱中加入预热的洗液①,45℃保温5 min,弃去,重复此步骤两次。
1.2.8 显色 在杂交舱中加入洗液②220μL,室温放置2 min;弃去杂交舱中液体,再加入标记抗体220μL,室温放置20 min;弃去杂交舱中液体,加入洗液②220μL,室温放置2 min,重复此步骤一次;加入洗液③220μL,室温放置1 min,弃去杂交舱中液体,加入显色液220μL,45℃避光放置30 min。
1.2.9 检测 弃去杂交舱中液体,揭除杂交舱,用蒸馏水冲洗芯片显色区,置45℃烘干后在生物芯片识读仪中识读,用Array Doctor 2.0软件进行图像扫描和分析,输出检测结果。
1.3 质量控制
在上述操作过程中,用上海百傲生物技术有限公司提供的eNOS298基因芯片检测为eNOS298TT型控制品为阳性参考品,eNOS298EE型为阴性参考品。MTHFR667基因芯片检测为MTHFR667TT型控制品为阳性参考品,MTHFR667CC型为阴性参考品。随同实验进行质量控制。
1.4 统计学方法
采用统计软件SPSS 15.0对实验数据进行分析,计量资料数据以均数±标准差表示,采用方差分析,两两比较采用LSD-t检验。用直接计数法计算eNOS298、MTHFR667位点的基因型和等位基因的人群分布频率。样本的代表性用基因型多态性频率的Hardy-Weinberg平衡χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 早发和迟发CHD组一般情况比较
早发和迟发CHD组一般情况比较显示,两组年龄、三酰甘油水平差异有高度统计学意义(P<0.01)。见表1。
2.2 两组eNOS Glu298Asp多态性检测
早发CHD组及迟发CHD组基因型频率适合度检测显示皆达到Hardy werberg平衡。早发CHD组及迟发CHD组eNOS298基因型均以EE型最常见,ED型次之,早发CHD组无DD基因型出现,两组基因型分布比较差异无统计学意义(P=0.821),早发CHD组D等位基因频率与迟发CHD组比较差异无统计学意义(8.33% vs 10.77%,P=0.821)。提示eNOS298基因多态性与冠心病的早发可能无相关性。见表2。

表2 eNOS Glu298Asp基因型分布及等位基因频率分布
2.3 两组MTHFR667基因多态性检测
早发CHD组及迟发CHD组基因型频率适合度检测显示皆达到Hardy werberg平衡。两组MTHFR667基因型均以CC型最常见,早发CHD组未见TT基因型出现,迟发CHD组未见CC型及TT基因型出现;两组基因型分布比较差异无统计学意义(P=0.098);早发CHD组T等位基因频率与迟发CHD组比较差异无统计学意义(47.92% vs 50.00%,P=0.805)。提示MTHFR667基因多态性与冠心病的早发可能无相关性。见表3。
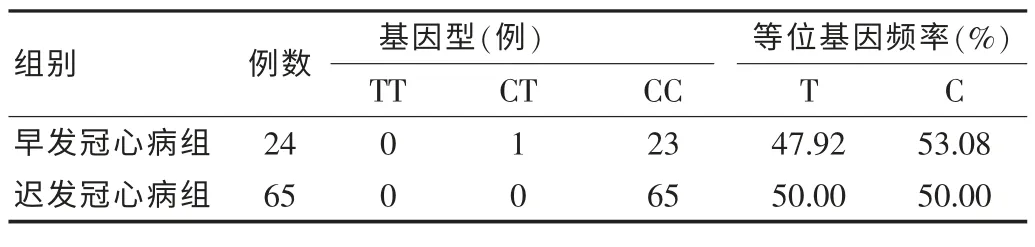
表3 MTHFR667基因型分布及等位基因频率分布
2.4 eNOS298DD与MTHFR667TT基因型联合情况
两组病例中均未发现eNOS298DD与MTHFR667TT基因型联合出现。
3 讨论
目前,国内外对eNOS基因多态性与冠心病之间的关系研究较多,但各个研究结果报道不一。部分研究[3-4]发现eNOS等位基因4a是冠心病的发病的危险因素,并且eNOS基因第7外显子第78位碱基即编码序列第894位碱基发生G突变为T与冠心病及急性心肌梗死的发生显著相关。但也有研究显示[5-6],eNOS基因多态性与冠心病无显著性相关。本研究结果显示,eNOS Glu298Asp基因型在CHD组及对照组均以EE型最多见,DE型次之;两组比较,eNOS Glu298Asp基因型分布及D等位基因频率差异无统计学意义(P>0.05),Glu 298Asp基因变异与冠心病的发病可能无相关性,D等位基因不是冠心病的遗传标记。
流行病学调查研究表明,血浆同型半胱氨酸(HCY)水平升高与动脉粥祥硬化性血管疾病危险增加有关,且两者之间存在着一种强烈的剂量依赖关系,HCY被认为是冠状动脉粥样硬化的独立危险因素之一。MTHFR是HCY再甲基化途径中的关键酶,该酶基因C677T是在HCY代谢途径中最为常见的突变。目前,MTHFR基因C677T多态性与CHD的关系尚存在很大分歧。欧洲、日本等研究者[7-8]发现MTHFR基因C677T突变与冠心病发病及冠状动脉病变程度有密切关系。而Zheng等[9]及Rothenbacher等[10]研究结果则显示,MTHFR基因C677T突变与CHD无显著性相关。本研究显示MTHFR667的变异基因型和T等位基因频率在早发冠心病组与迟发冠心病组之间无统计学差异,提示MTHFR667基因多态性与冠心病的早发无相关性。
早发冠心病的发病与遗传因素密切相关,很多研究也提示多种基因变异促使冠心病早发,但针对不同基因分析所得结论并不完全一致,其原因是否与人选样本地域局限,标准不一及研究技术等因素有关,而且冠心病的基因多态性不仅与种族有关,还与不同的国家、同一国家的不同地区的人群有关。因此,早发冠心病与基因多态性的相关性还需在大量的研究及临床实践中进一步探索。
[1]Hauser ER,Mooser V,Crossman AD,et al.Design of the genetics of early onset cardiovascular disease(GENECARD)study[J].Am Heart J,2003,145(4):602-613.
[2]中华心血管病杂志编委会血脂异常防治对策组.血脂异常防治建议[J].中华心血管病杂志,1997,25(3):169-172.
[3]Matyar S,Attila G,Acarturk E,et al.eNOS gene intron 4 a/b VNTR polymorphism is a risk factor for coronary artery disease in Southern Turkey[J].Clin Chim Acta,2005,354(1-2):153-158.
[4]Colombo MG,Paradossi U,Andreassi MG,et al.Endothelial nitric oxide synthase gene polymorphisms and risk of coronary artery disease[J].Clin Chem,2003,49(3):389-395.
[5]胡茂红,贾崇奇,刘同涛,等.内皮型一氧化氮合酶基因多态性与冠心病关系[J].中国公共卫生,2007,23(1):58-60.
[6]Milutinovic A,Hruskovicova H.The eNOS gene polymorphism does not have a major impact on lipid parameters and premature coronary artery disease in Slovene men(Caucasians)[J].Folia Biol,2005,51(2):47-49.
[7]Meleady K,Ueland PM,Blom H,et al.The rmolabile methylenetetrahydrofolate reductase,homocyteine,and cardiovascμLar disease risk:the European Concerted Action Project[J].Am J Clin Nutr,2003,77(1):63-70.
[8]王苏梅,刘学军,吴爱华.亚甲基四氢叶酸还原酶基因多态性及临床意义[J].国外医学:遗传学分册,2005,28(1):29-32.
[9]Zheng YZ,Tong J,Do XP,et al.Prevalence of methylenetetrahydrofolate reductase C677Tand its associationwith arterial and venousthrombosis in the Chinese popμLation[J].Br J Haematol,2000,109(4):870-871.
[10]Rothenbacher D,Fischer HG,Hoffmeister A,et al.Homocysteine and methylenetetrahydrofolate reductase genotype:association with risk of coronary heart disease and relation to inflammatory,hemostatic,and lipid parameters[J].Atherosclerosis,2002,162(1):193-200.

