杨梅渣红色素的超声提取和微胶囊化工艺研究*
李 帅, 吴丽娇, 范王曼, 张应烙
(浙江师范大学化学与生命科学学院,浙江金华 321004)
杨梅渣是杨梅果加工后的副产物,约占杨梅果的30% ~40%[1].当前杨梅渣均没有被充分利用而大部分被直接废弃,既污染环境又浪费资源.开发利用杨梅渣,不但可以解决其废弃带来的环境污染问题,并且可以延长杨梅的加工产业链,增加杨梅的附加值.廉价的杨梅渣含有丰富的杨梅红色素,是天然红色素的重要来源.
近年来超声波法在食品加工领域受到了广泛的关注,利用超声波产生的强大能量可以加速细胞壁的破裂和物料中有效成分的转移、扩散,从而达到有效提取的目的[2-3].关于杨梅果红色素的溶剂提取及微波提取方法已有报道[4-6],但利用超声波技术进行提取还未见报道.
与合成色素相比,天然色素在诸多方面尚不能尽如人意,特别是对光、热及pH的敏感性较高,对氧化、还原及微生物作用的敏感性较大,如何克服因此带来的褪色、变色等稳定性问题,是天然色素科研的重要课题[7].微胶囊化[8-9]是提高色素稳定性的重要途径之一.该方法是将色素封闭在囊膜内与外界环境隔离,可以改善其对光和氧等的稳定性[10].本实验对超声波辅助提取的杨梅渣红色素,经树脂纯化后对其微胶囊化,并对相关工艺条件进行了研究,以期为杨梅渣红色素的工业化应用提供理论基础.
1 材料与方法
1.1 实验材料
东魁杨梅:2010年6月购于金华市农贸市场.其他试剂均为分析纯.
1.2 主要仪器
JA3003A型电子天平(上海精天电子仪器有限公司);Ultrospec 4000型紫外可见分光光度计(Pharmacia Biotech);SB25-12YDTD型超声清洗仪(宁波市新芝生物科技有限公司);MIKRO-22R型高速冷冻离心机(德国Eppendont);PB-10型pH计(德国Sartorius);DHG-9145A型电热恒温鼓风干燥箱(上海一恒科技有限公司);SB25-12YDTD型超声波仪(河南兄弟仪器设备有限公司);HH-4型数显恒温水浴锅(山东鄄城科源仪器设备厂).
1.3 杨梅渣的获取
将新鲜东魁杨梅去核,经榨汁机榨汁后获得杨梅渣,其含水率为80%.
1.4 杨梅渣红色素的超声提取
1.4.1 杨梅渣提取液最大吸收波长的确定
本实验以杨梅渣提取液在最大吸收波长处的吸光度值表示待测液中色素的含量,从而确定杨梅渣红色素超声波提取的最佳工艺条件.
杨梅渣提取液最大吸收波长的测定方法:取上述杨梅渣0.5 g置于试管中,加入pH=2的HCl水溶液5 mL,室温下超声浸提,离心(12 000 r/min)5 min,上清液稀释5倍.以HCl水溶液作为参比溶液,利用Ultrospec 4000紫外可见分光光度计在400~800 nm波长下进行扫描,确定其最大吸收波长为509.5 nm.
1.4.2 单因素实验
以下单因素实验中每处理均设置3个重复.
1)料液比
取杨梅渣0.5 g于6支试管中,各加入3,4,5,6,7,8 mL pH=2 的 HCl水溶液,在超声波功率为400 W、温度为30℃、提取时间为10 min的条件下超声提取1次,提取液定容至8 mL,离心(12 000 r/min)5 min,取上清液稀释5倍,测定上清液的吸光度.
2)pH
取杨梅渣0.5 g于6支试管中,各加入6 mL pH 为1,2,3,4,5,6 的 HCl水溶液,在超声波功率为400 W、温度为30℃、提取时间为10 min的条件下超声提取1次,离心(12 000 r/min)5 min,取上清液稀释5倍,调pH=2后测定上清液的吸光度.
3)超声波功率
取杨梅渣0.5 g于5支试管中,各加入6 mL pH=2的HCl水溶液,分别在超声波功率为100,200,300,400,500 W 及温度为30 ℃、提取时间为10 min的条件下超声提取1次,离心(12 000 r/min)5 min,取上清液稀释5倍,测定上清液的吸光度.
4)提取时间
取杨梅渣0.5 g于5支试管中,各加入6 mL pH=2的HCl水溶液,在超声波功率为400 W、温度为30 ℃ 及提取时间分别为 10,20,30,40,50 min的条件下超声提取1次,离心(12 000 r/min)5 min,取上清液稀释5倍,测定上清液的吸光度.
1.4.3 正交实验
选取料液比、pH、超声波功率、提取时间4种因素,分别设定3个水平,按L9(34)设计正交实验,对超声波提取杨梅渣红色素的工艺参数进行优化.各因素与水平见表1.
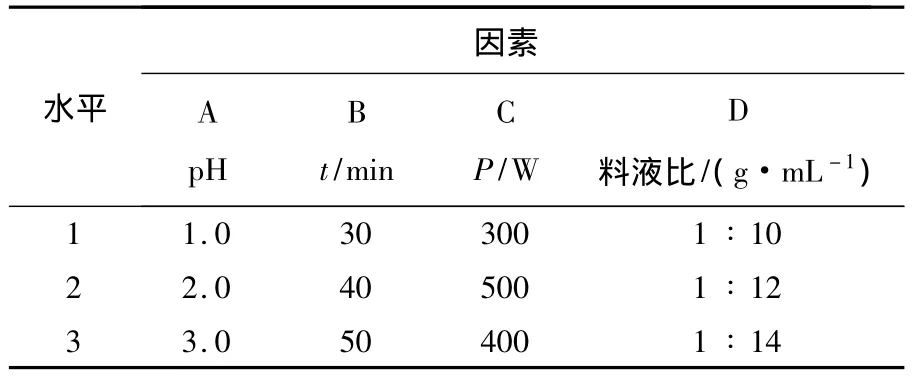
表1 正交实验因素与水平表
1.5 杨梅渣红色素的精制
采用文献[11]的方法,用大孔树脂对杨梅渣提取粗色素进行纯化,得到精制杨梅渣红色素.
1.6 杨梅渣红色素标准工作曲线的绘制
用95%乙醇溶液分别配制0.2~1.0 mg/mL精制杨梅渣红色素溶液,于509.5 nm波长处测定吸光度值.以杨梅渣红色素的质量浓度为横坐标、吸光度值为纵坐标,绘制标准工作曲线.
1.7 杨梅渣红色素的微胶囊化
选用阿拉伯胶和麦芽糊精为壁材、蔗糖脂肪酸酯和吐温-80为乳化剂、普鲁兰多糖为粘稠剂,按照一定的配比加入到10 mL杨梅渣红色素溶液(10 mg/mL)中,摇床摇动(120 r/min)4 h,冷冻干燥24 h,即得微胶囊化杨梅渣红色素.微胶囊化效果用包埋率评定[8-9].

1.7.1 壁材阿拉伯胶与麦芽糊精的比例
在芯壁比(芯材与壁材的比例)为1∶10,乳化剂含量为0.6%,普鲁兰多糖含量为1%,阿拉伯胶与麦芽糊精的比例分别为1∶1,1∶2,1∶3和1∶4的条件下,对杨梅渣红色素进行微胶囊化,考察壁材阿拉伯胶与麦芽糊精的比例对包埋率的影响.
1.7.2 乳化剂蔗糖脂肪酸酯与吐温-80的比例
在壁材阿拉伯胶与麦芽糊精的比例为1∶3,芯壁比为1∶10,普鲁兰多糖含量为1%,乳化剂含量为0.6%,其中蔗糖脂肪酸酯与吐温-80的比例分别为1 ∶0,0 ∶1,1 ∶1,2 ∶1和1 ∶2的条件下,对杨梅渣红色素进行微胶囊化,考察乳化剂中蔗糖脂肪酸酯与吐温-80的比例对包埋率的影响.
1.7.3 芯材与壁材的比例
在壁材阿拉伯胶与麦芽糊精比例为1∶3,蔗糖脂肪酸酯含量为0.6%,普鲁兰多糖含量为1%,芯壁比为 1 ∶6,1 ∶10,1 ∶14,1 ∶16 和1∶18的条件下,对杨梅渣红色素进行微胶囊化,考察芯壁比对包埋率的影响.
1.7.4 普鲁兰多糖的含量
在壁材阿拉伯胶与麦芽糊精比例为1∶3,蔗糖脂肪酸酯含量为0.6%,芯壁比1∶10,普鲁兰多糖含量分别为 0%,0.5%,1.0%,1.5% 和2.0%的条件下,对杨梅渣红色素进行微胶囊化,考察粘稠剂普鲁兰多糖含量对包埋率的影响.
1.8 微胶囊化杨梅渣红色素的稳定性
配制相同浓度的微胶囊化杨梅渣红色素与未微胶囊化杨梅渣红色素水溶液各10 mL,分别在不同温度(60,70,80,90,100 ℃)、不同 pH(1,2,3,4,5)条件下考察两者的耐热性、耐酸性;同时置于阳光下照射,每天光照8 h,每隔一定天数后测定两者的吸光度,7 d后对比分析吸光度的变化,考察两者的耐光性.
2 结果与分析
2.1 杨梅渣红色素超声提取工艺参数确定
2.1.1 单因素实验结果
1)料液比
不同料液比对杨梅渣红色素提取液吸光度的影响如图1所示.结果表明,随提取液体积的增加,杨梅渣红色素提取液的吸光度值逐渐增大,当料液比为1∶12时,其吸光度达到最大值,之后呈下降的趋势.因此,选用料液比为1∶12较好.
2)pH

图1 料液比对杨梅渣红色素提取的影响

图2 提取液pH对杨梅渣红色素提取的影响
3)超声波功率
超声波功率对杨梅渣红色素提取效果的影响如图3所示.结果表明,在实验选定的超声功率范围内,随着超声波功率的增大,杨梅渣红色素提取液的吸光度逐渐增大,但超声功率增加到400 W后,提取液的吸光度增加缓慢,超声功率为400 W时提取液的吸光度与500 W时的相当.
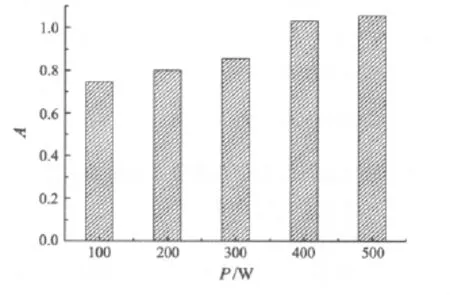
图3 超声波功率对杨梅渣红色素提取的影响
4)提取时间
不同提取时间对杨梅渣红色素提取效果的影响如图4所示.结果表明,随着超声提取时间的延长,杨梅渣红色素提取液的吸光度逐渐增大,至40 min后,提取液的吸光度下降,原因可能是提取时间过长导致红色素稳定性下降而降解.因此,超声提取时间选为40 min较好.
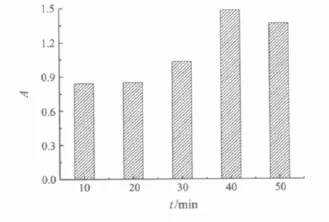
图4 提取时间对杨梅渣红色素提取的影响
2.1.2 正交实验结果

表2 正交实验结果与分析
由表2中极差R的数据可知,各因素对杨梅渣红色素提取效果的影响大小依次是料液比、pH、提取时间、超声波功率.综合分析正交实验结果并考虑成本因素,确定杨梅渣红色素提取的最佳工艺条件为A1B2C3D2,即pH值为1,提取时间为40 min,超声波功率为400 W,料液比为1∶12 g·mL-1.
2.2 杨梅渣红色素的标准曲线
以杨梅渣红色素的质量浓度为横坐标、吸光度为纵坐标绘制的标准曲线见图5,回归方程为
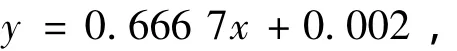
R2=0.992 2.可见,在 0.2 ~1.2 mg·L-1,杨梅渣红色素的质量浓度与其吸光度之间有良好的线性关系.
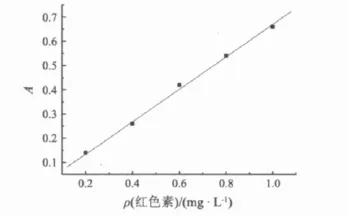
图5 杨梅渣红色素的标准曲线
2.3 杨梅渣红色素微胶囊化工艺研究
2.3.1 壁材阿拉伯胶与麦芽糊精的比例
收集该院90例ICU糖尿病酮症酸中毒患者,数字表法分组,综合护理干预组男患者23例,女患者22例。年龄范围 41~68 岁,平均年龄(53.24±2.34)岁。入院尿酮含量为(2.21±0.81)mmol/L.对照组男患者 24 例,女患者21 例。年龄范围 42~69 岁,平均年龄(53.10±2.71)岁。入院尿酮含量为(2.21±0.82)mmol/L.两组一般资料差异无统计学意义(P>0.05)。
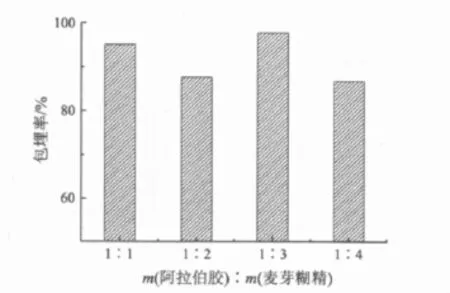
图6 阿拉伯胶与麦芽糊精比例对包埋率的影响
壁材阿拉伯胶中引入麦芽糊精能有效地改善阿拉伯胶壁材的表面性能,能提高产品的玻璃化转变温度,从而延长产品的保质期[12].壁材阿拉伯胶与麦芽糊精的比例对包埋率的影响见图6.由图6可知:在实验设定的范围内,壁材阿拉伯胶与麦芽糊精的比例为1∶3时,微胶囊化包埋率最高,为97.4%;当阿拉伯胶与麦芽糊精的比例高于或低于该比例时,两者的协同性较差,微胶囊化包埋率不理想.故壁材阿拉伯胶与麦芽糊精的比例选择为1∶3.
2.3.2 乳化剂蔗糖脂肪酸酯与吐温-80的比例
乳化剂蔗糖脂肪酸酯与吐温-80的比例对包埋率的影响见图7.由图7可知,当乳化剂为蔗糖脂肪酸酯,且其含量为0.6%时,乳化效果较好,微胶囊化包埋率最高达99.5%.因此,乳化剂选择为0.6%蔗糖脂肪酸酯较好.
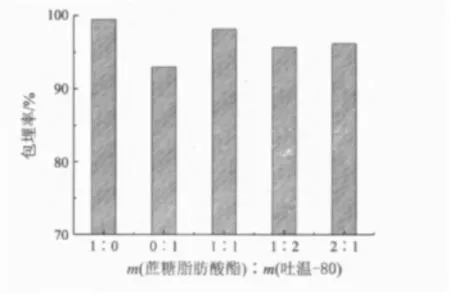
图7 乳化剂蔗糖脂肪酸酯含量对包埋率的影响
2.3.3 芯壁比
芯壁比对微胶囊化包埋率的影响见图8.由图8可知:在本实验选定范围内,当芯壁比例较小时,杨梅渣红色素不能被充分包埋,包埋率较低;随壁材比例增加,微胶囊的壁逐渐变厚,包埋率逐渐升高,当芯壁比为1∶14时,包埋率达到最大值95.5%;当壁材比例进一步增加时,其包埋率反而下降,这与文献[8-9]的实验结果相似.因此,芯壁比选择1∶14较好.
2.3.4 粘稠剂普鲁兰多糖的含量
粘稠剂普鲁兰多糖含量对微胶囊化包埋率的影响见图9.由图9可知,有普鲁兰多糖的包埋率比没有普鲁兰多糖的包埋率要大,这可能与粘稠剂的成膜作用有关,但普鲁兰多糖含量为0.5% ~2.0%的包埋率相近.考虑到生产成本问题,选择普鲁兰多糖含量为0.5%.

图9 普鲁兰多糖含量对包埋率的影响
2.4 微胶囊化杨梅渣红色素稳定性实验
2.4.1 耐热性
不同温度对微胶囊化及未微胶囊化杨梅渣红色素的影响见图10.由图10可知:在70℃以下时,温度的变化对两者吸光度的改变不大;但随着温度的进一步提高,未微胶囊化杨梅渣红色素的稳定性明显下降,而微胶囊化杨梅渣红色素的稳定性几乎不变;到达100℃时,未微胶囊化杨梅渣红色素溶液的吸光度值减小率高达38.7%,而微胶囊化杨梅渣红色素溶液的吸光度值减小率仅为8.6%.由此可知,杨梅渣红色素经微胶囊化后耐热性明显增加.
2.4.2 耐酸性
pH对微胶囊化及未微胶囊化杨梅渣红色素的影响见图11.由图11可知:在本实验选定的酸性范围内,溶液pH值由1变至5时,未微胶囊化杨梅渣红色素溶液的吸光度减少率为61.3%;相同条件下,微胶囊化杨梅渣红色素溶液的吸光度减少率仅为28.2%.目测溶液颜色的变化:随着pH值的增大,前者的颜色由红色变成淡红再变为褐色;而后者的颜色基本未发生变化.对比可知,杨梅渣红色素经微胶囊化后耐酸性明显增加.
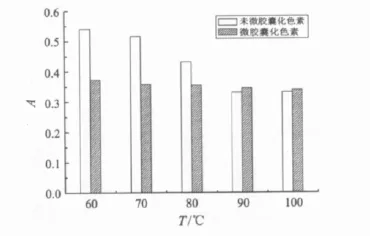
图10 温度对微胶囊化及未微胶囊化杨梅渣红色素稳定性的影响

2.4.3 耐光性
不同光照时间对微胶囊化及未微胶化杨梅渣红色素的影响见图12.由图12可知:未微胶囊化杨梅渣红色素溶液经光照144 h后吸光度减少率达52.5%;而在相同时间内,微胶囊化杨梅渣红色素溶液的吸光度减少率仅为26.6%.因此,杨梅渣红色素经微胶囊化后耐光性明显增强.
3 结论
1)本实验以酸水为提取溶剂,用单因素实验和正交实验设计优化了超声波提取杨梅渣红色素
的工艺.实验结果表明:超声波提取杨梅渣红色素的4个因素影响力大小顺序为料液比、pH、提取时间、超声波功率;最佳工艺条件是料液比为1∶12 g·mL-1,提取液 pH=1,提取时间为40 min,超声波功率为400 W.
2)单因素微胶囊化实验表明:在壁材阿拉伯胶与麦芽糊精比例为1∶3,乳化剂蔗糖脂肪酸酯含量为0.6%,粘稠剂普鲁兰多糖含量为0.5%,芯壁比为1∶14的情况下,杨梅渣红色素微胶囊化效果较好.
3)稳定性实验表明杨梅渣红色素经微胶囊化后耐热性、耐酸性和耐光性均显著提高.
[1]陈学丽,叶立斌,励建荣,等.杨梅渣黄酮类化合物提取及其抗氧化活性研究[J].食品工业科技,2011,32(2):85-91.
[2]刘海洲,刘均洪,张媛媛,等.超声辅助萃取技术在食品工业的应用和研究进展[J].乳业科学与技术,2008,132(5):246-248.
[3]嵇豪,蒋冬花,杨叶,等.响应面法优化超声波辅助提取红曲米中水溶性色素[J].浙江师范大学学报:自然科学版,2011,34(1):91-96.
[4]夏红.杨梅色素提取及性质研究现状[J].食品研究与开发,2007,28(12):190-191.
[5]李颖,朱瑞芬,胡敏杰,等.杨梅色素提取工艺的研究[J].食品工业科技,2005,26(10):164-166.
[6]韩晓祥,应芝,励建荣,等.微波辅助提取杨梅色素及抗氧化作用研究[J].中国粮油学报,2009,24(8):147-151.
[7]乔华.天然食用色素色泽稳定性的研究及应用[D].太原:山西大学化学化工学院,2006.
[8]Ge Xintian,Wan Zhijian,Song Nize,et al.Efficient methods for the extraction and microencapsulation of red pigments from a hybrid rose[J].Journal of Food Engineering,2009,94(1):122-128.
[9]王闯,宋江峰,李大婧,等.叶黄素微胶囊化研究[J].食品科学,2011,32(2):43-47.
[10]刘云海,刘瑛,曹小红,等.天然食用色素花青素的微胶囊化[J].食品工业科技,2004,25(12):109-110.
[11]Zhang Yinglao,Yin Caiping,Kong Lichun,et al.Extraction optimisation,purification and major antioxidant component of red pigments extracted from Camellia japonica[J].Food Chemistry,2011,129(2):660-664.
[12]张碳,谭天伟,凌沛学.微胶囊壁材在食品工业中的研究进展[J].食品与发酵工业,2011,37(5):132-138.

