异氟烷单独或联合咪达唑仑对7日龄大鼠大脑caspase-3表达的影响
燕 琳 桂伶俐 张传汉 邹姮婧 张玥 李大佳 石小云
异氟烷单独或联合咪达唑仑对7日龄大鼠大脑caspase-3表达的影响
燕 琳 桂伶俐*张传汉 邹姮婧 张玥 李大佳 石小云
(华中科技大学同济医学院附属同济医院麻醉科,武汉430030)
目的 观察异氟烷单独或联合咪达唑仑对7日龄大鼠大脑caspase-3表达的影响。方法 7日龄SD大鼠39只,随机分为对照组(C组,n=13),异氟烷组(I组,n=13)和咪达唑仑联合异氟烷组(MI组,n=13)。C组:腹腔注射0.9%生理盐水10ml/kg,吸入30%O26h;I组:在37℃恒温并通入1.5%异氟烷的麻醉小室内维持麻醉6h;MI组:腹腔注射咪达唑仑9mg/kg后,随即置于37℃恒温并通入1.5%异氟烷的麻醉小室内维持麻醉6h。麻醉结束即刻每组取3只大鼠,行动脉血气分析。麻醉结束2h采用Realtime-PCR方法检测皮质和海马组织Caspase-3mRNA水平的变化;并用免疫组织化学SABC法检测大脑Active caspase-3阳性神经细胞的分布情况,计数阳性细胞。结果 ⑴I组和MI组大鼠麻醉结束即刻动脉血气分析结果与C组比较差异无统计学意义(P>0.05)。⑵Realtime-PCR结果显示,I组与 MI组大鼠皮质和海马区Caspase-3 mRNA与对照组相比表达增多,且MI组与I组比较Caspase-3mRNA表达增加(P<0.05)。⑶免疫组化结果也显示:与对照组相比,I组与MI组大鼠在皮质、海马及丘脑部位Active caspase-3阳性神经细胞数量均明显增多 (P<0.05),而 MI组与I组相比,在海马和丘脑部位Active caspase-3阳性神经细胞数量明显增多(P<0.05)。结论 异氟烷麻醉能诱导脑发育高峰期大鼠重要脑区Caspase-3表达增加,联合应用咪达唑仑增加更明显;推测Caspase-3表达增加可能引起凋亡级联反应,导致神经细胞凋亡增加。
异氟烷;咪达唑仑;细胞凋亡;caspase-3
在哺乳动物脑发育高峰期,也称为突触发生期,易受到各种干扰因素的影响。N-甲基-D-天(门)冬氨酸(NMDA)和γ-氨基丁酸(GABA)是CNS两大重要的神经递质,参与形成神经细胞的化学微环境,在CNS发育和稳定中起着重要作用。目前临床上常用的全麻药包括具有NMDA受体拮抗活性(氯胺酮、N2O及氙气)和GABAA受体激动活性(巴比妥类,咪达唑仑,丙泊酚等)及两者兼具的药物(吸入麻醉药异氟烷、七氟烷等),通过调节配体门控离子通道改变突触功能,发挥麻醉效应[1]。突触发生期在人类出生前3个月到出生后2至3年,即妊娠晚期至婴幼儿时期;而在哺乳动物如大鼠主要是出生前1、2天至出生后2周[2],其中7日龄(P7)被认为是大鼠脑发育最高峰期。在此时期使用该类药物对突触发生期大脑发育是否存在毒性作用逐渐引起人们的广泛关注。因此,本研究将临床常用麻醉药异氟烷和咪达唑仑作用于P7大鼠,拟观察异氟烷单独或联合咪达唑仑对其大脑caspase-3表达的影响,探讨异氟烷与咪达唑仑致发育期大鼠的神经毒性作用,为进一步探讨全身麻醉药对新生儿及婴幼儿脑发育的影响提供实验基础。
材料和方法
1.材料
1.1 实验动物
7日龄Sprague-Dawley(SD)大鼠,雌雄不拘,体重13.5-16g,购自华中科技大学同济医学院实验动物学中心。
1.2 主要仪器与试剂
Penlon Prima SP麻醉机(英国)、i-STAT 血气分析仪(美国)、低温恒冷冻切片机(Leica CM 1900,德国)和生物显微镜(NIKON TE2000,日本)、Imageproplus 6.0图像分析软件、实时定量PCR试剂盒(Takara公司,日本)、8453E型紫外分光光度仪(Agilent公司,美国)和LightCycler实时荧光定量PCR仪(Roche公司,美国);异氟烷(批号876115U,上海雅培制药有限公司)、咪达唑仑注射液(批号20110209宜昌人福药业)、多克隆兔抗 Active caspase-3抗体(3015-100,Biovision公司,美国),免疫组化SABC试剂盒由武汉博士德公司提供。
2.方法
2.1 分组及麻醉
分别将39只7日龄新生大鼠随机分为3组(n=13):对照组(C组):腹腔注射0.9%生理盐水10ml/kg;异氟烷组(I组):1.5%异氟烷麻醉6h;咪达唑仑联合异氟烷组(MI组):腹腔注射咪达唑仑9mg/kg后1.5%异氟烷维持麻醉6h。参照Lunardi N 等人[2]的麻醉方法并作改进,使用 Penlon Prima SP麻醉机,连接氧源,在麻醉机输出口接一导管与麻醉小室的进气口相连,麻醉小室的出口处连一细管与外界通风处相通,形成麻醉管路。自制密封麻醉小室置于37℃恒温箱,麻醉小室为长方形,大小为10cm×8cm×8cm。将I组及MI组新生鼠置于自制密封麻醉小室内,持续给予携带1.5%异氟烷浓度的含30%氧气的混合气体(混合气体预充麻醉管路15min)。预实验证实混合后气体经气相色谱仪检测其携带异氟烷浓度与挥发罐刻度一致。C组通入仅含30%氧气的混合气体;气体流量为2L/min。
2.2 血气分析
麻醉过程中均仔细观察新生鼠皮肤黏膜颜色变化,有无缺氧、CO2潴留等表现。实验中每隔30min检测新生鼠麻醉深度,采用针刺、尾钳等方法,每次检测时间不超过15s。麻醉结束后各组分别取3只新生鼠,抽取左心室血行血气分析。其余新生鼠返回母鼠身边继续喂养。
2.3 Real-time PCR检测caspase-3mRNA 水平变化
麻醉结束后2h用Trizol试剂盒提取各组大鼠脑组织皮质区及海马区的总RNA,紫外分光光度计测定RNA浓度,按照实时定量RT-PCR试剂盒说明书取500ng总RNA逆转录合成cDNA,然后以SYBRⅠ作为荧光标记物,在ABI实时荧光定量PCR仪上进行PCR反应。在同一反应体系内对caspase-3 (NM-012922)和 内 参 β-actin (NM-031144)mRNA进行扩增。PCR引物为:caspase-3上游引物5’-GCAGCAGCCTCAAATTGTTGACTA-3’,下 游 引 物 为 5’-TGCTCCGGCTCAAACCATC-3’,PCR产物片段为147bp。β-actin上游引物 为 5’-TGACAGGATGCAGAAGGAGA-3’,下游引物为5’-TAGAGCCACCAATCCACACA-3’,PCR产物片段为104bp。扩增分三步:95℃预变性10s,95℃变性8s,60℃退火及延伸30s。设置反应40个循环,分析融解曲线。以△Ct表示caspase-3的表达,△Ct= Ct(caspase-3)一 Ct(β-actin),△Ct值越高,caspase-3的表达越低。
2.4 免疫组化检测 Active caspase-3的表达
大鼠麻醉结束后2h,10%水合氯醛300mg/g腹腔注射麻醉,快速开胸,暴露肝脏,用一次性头皮静脉针经左心室插管至升主动脉,先用0.9%生理盐水快速灌注,待右心耳流出液变成淡红色,肝脏颜色发白时改用4%多聚甲醛先快后慢灌注固定20min后完整取脑,在上述多聚甲醛液中4℃后固定4-12h后,转入30%蔗糖液中4℃过夜至下沉,从视交叉处连续做冠状位冰冻切片,片厚15um。每只动物取2张切片,行Active caspase-3的免疫组织化学染色。具体操作步骤如下:4%多聚甲醛室温固定15min,0.01MPBS漂洗5min,3次。0.3%TritonX-100破膜30min,0.01MPBS漂洗5min,3次。10%山羊血清封闭液室温孵育40min,倾去勿洗,加入兔抗 Active caspase-3(1:20),放于湿盒内4℃孵育24h。之后按照SABC试剂盒说明完成后续操作。加入适量新鲜配制DAB显色液,镜下观察控制显色时间。待出现红棕色染色后立即终止反应。之后梯度酒精脱水,二甲苯透明,中性树胶封片,镜下观察,照相。对每张切片随机选取海马、皮质、丘脑的10个高倍视野(×400)应用Image-Pro plus 6.0软件计算神经细胞染色细胞数,以阳性细胞数表示 Active caspase-3的表达。
3.统计学分析
采用SPSS12.0统计分析软件,计量资料以均数±标准差(¯x±s)表示,组间差异采用单因素方差分析﹙P<0.05﹚。
结 果
⒈ 血气分析
在整个实验过程中,所有新生鼠呼吸平稳,I组与MI组新生鼠皮肤黏膜与C组新生鼠相同,均呈粉红色。实验中轻微刺激I和MI组新生鼠无反应,较重刺激有缩爪反应。麻醉结束后即刻新生鼠左心室血气分析显示无明显的缺氧、CO2潴留等现象发生(见表1)。

表1 麻醉结束后即刻各组新生鼠pH值、PaCO2、PaO2、HCO3-、BE和SaO2的比较(n=5,(x¯±s)Table 1The comparsion of pH,PaCO2、PaO2、HCO3-、BE和SaO2 among the three groups at the end of the anesthesia
⒉ 实时荧光定量PCR
在皮质和海马区,与C组相比,I组和MI组麻醉后2小时Caspase-3mRNA表达均显著性增高(P<0.05);与I组相比,MI组麻醉后2小时caspase-3mRNA表达增高(P<0.05)(图1-A,B)。从融解曲线图也可看出没有出现杂峰。表面实验中未出现污染,引物二聚体或非特异性扩增。(图2-A-B)
⒊ 组织学观察
光镜下观察DAB显色,胞浆内棕黄色染色为Active caspase-3阳性细胞。C组仅有少量 Active caspase-3阳性神经细胞。与C组相比,I组和M组在皮质、海马、丘脑部位 Active caspase-3阳性细胞均明显增高(P<0.05),与I组相比MI组在海马和丘脑部位Active caspase-3阳性细胞表达增高(P<0.05),但是在皮质部位两组差别无统计学意义(P>0.05)。以各组海马区Active caspase-3阳性细胞为例(图2;×400)。各组细胞计数结果(见表2)。
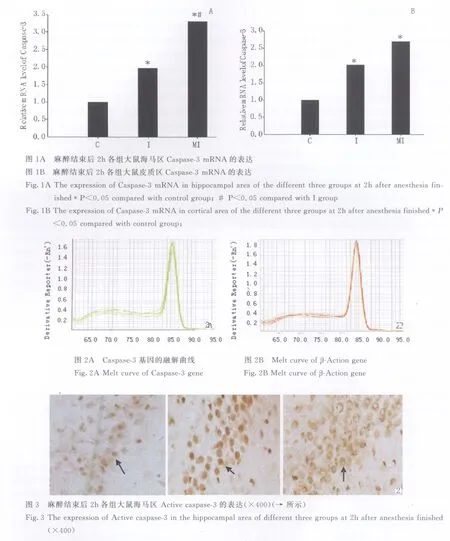

表2 各组Active caspase-3阳性细胞数值比较(n=5,¯x±s)
讨 论
由于世界范围内无痛分娩、胎儿手术,尤其是新生儿、婴幼儿手术的广泛开展,全凭吸入或静吸复合麻醉方式由于起效快、可控性好等优点逐步成为婴幼儿临床麻醉的主要方式。异氟烷作为卤族吸入麻醉药的代表,起效快、对呼吸循环影响轻微、可控性好的优点使其在临床麻醉包括妇产科和小儿麻醉中应用广泛;由于小儿的生理特点,咪达唑仑由于起效快、抗焦虑等作用也经常复合用于婴幼儿术前用药。有研究显示[3]咪达唑仑可以通过苯二氮类受体与GABAA受体及氯离子通道等结合成GABAA-苯二氮类受体-氯通道复合物,调节GABAA的突触前抑制作用,从而使中枢接受的兴奋性递质进一步减少,增强了异氟烷的中枢抑制效果。据文献报道[4]咪达唑仑大鼠常用镇静剂量为腹腔注射1-10mg/kg,大鼠的异氟烷 MAC是1.46%[5],故我们采用的咪达唑仑9mg/kg、异氟烷1.5%相当于临床麻醉或亚麻醉水平。有研究发现出生7d的大鼠中枢神经系统发育与人类足月儿出生后0-6月发育相似[2,6],故选择7日龄大鼠作为研究对象可以较好模拟临床上常用全麻药及常用给药模式对脑发育高峰期婴幼儿及新生儿大脑发育的情况。
随着对凋亡生化改变的认识加深以及对凋亡相关基因及凋亡途径的进一步探索,现在普遍认为Caspase家族与细胞凋亡的发生密切相关。Caspase家族是一类半胱氨酸蛋白酶,具有特异性酶切天冬氨酸氨基的位点。其中Caspase-3是参与细胞凋亡的Caspase级联反应的最终反应子,在蛋白酶级联切割过程中处于核心位置,活化的Caspase-3蛋白被认为是启动凋亡程序的执行者[7]。因此本研究选择Caspase-3作为研究指标,既可以从基因和蛋白水平确定凋亡的存在,也可以明确凋亡的神经细胞的分布情况。
研究采用荧光实时定量PCR方法发现,暴露于异氟烷6h的P7大鼠皮质和海马区caspase-3mRNA表达升高,而暴露于异氟烷联合咪达唑仑下,P7大鼠皮质和海马区caspase-3mRNA表达升高更明显;免疫组织化学法也发现,虽然各组P7大鼠大脑在皮质、海马、丘脑等处有 Active caspase-3表达,但暴露于异氟烷或异氟烷联合咪达唑仑后,在皮质、海马、丘脑等处的Active caspase-3表达明显增强,其中在海马、丘脑部位异氟烷联合咪达唑仑比单纯异氟烷导致的Active caspase-3的表达更明显。这些结果也与其他学者[8-10]的研究相符。推测可能有以下原因:① 异氟烷同时具有NMDA受体拮抗活性和GABAA受体激动活性,拮抗NMDA受体降低了细胞外谷氨酸的浓度,减少了突触形成和细胞间的连接而抑制神经细胞;过度激活GABAA受体则导致中枢抑制作用更强[11];② 咪达唑仑是是苯二氮卓类药物且具有GABAA受体结合位点,与异氟烷合用进一步增强中枢抑制作用[3]。另外,相关研究[12]也发现异氟烷可以增强突触发生期神经细胞的钙振荡,使其轴突生长速度变缓,分支数目及轴突分支总长度减少。推测其可能影响海马神经元之间突触环路的形成或促进突触发生期神经细胞发生凋亡所致。而且有研究[13]发现氯胺酮(一种NMDA受体拮抗剂)触发突触发生期神经细胞凋亡早期伴随着细胞周期蛋白D1(cyclinD1)、周期性依赖蛋白激酶4(cdk4)、Bcl-2相互作用细胞死亡介导因子(Bim)上调,细胞色素C上调以及caspase-9酶激活,之后发生的下游底物如caspase-3的激活引起的凋亡反应;而敲除cyclinD1基因后,明显减少Bim及活化caspase-3蛋白的表达,减轻细胞凋亡;提示氯胺酮可能通过异常进入细胞周期诱使细胞凋亡。异氟烷也具有NMDA受体拮抗活性,是否同样会引起异常进入细胞周期而导致凋亡还有待进一步研究。
综上所述,异氟烷单独或联合咪达唑仑能诱导突触发生期大鼠大脑皮质、海马、丘脑caspase-3表达增加,提示神经细胞凋亡可能增加,而由于种属特异性,在人类发育期使用临床浓度的异氟烷,咪达唑仑是否会导致同样的损害呢?目前学术界仍有争论[14,15]。但动物实验结果对临床用药仍有一定的启示作用,还有待进一步实验。
[1]Franks NP,Lieb WR.Molecular and cellular mechanisms of general anesthesia.Nature.1994,367(6464):607-614
[2]Lunardi N,Ori C,Erisir A,Jevtovic-Todorovic V.General anesthesia causes long-lasting disturbances in the ultrastructural properties of developing synapses in young rats.Neurotox Res.2010,17(2):179-188
[3]王雷,孙飞,李艳,等.咪达唑仑对异氟烷小鼠的镇痛、镇静作用的影响.中国药理学通报.2010,26(11):1528-1529
[4]Kissin I,Brown PT,Bradley EL.Sedative and hypnotic midazolam-morphine interactions in rats.Anesth Analg 1990,71(2):137-143
[5]Tas PW,Eisemann C,Roewer N.The volatile anesthetic isoflurane suppresses spontaneous calcium oscillations in vitro in rat hippocampal neurons by activation of adenosine A1receptors.Neurosci Lett.2003,338(3):229-232
[6]Mellon RD,Simone AF,Rappaport BA.Use of anesthetic agents in neonates and young children.Anesth Analg.2007,104(3):509-520
[7]Troy CM,Salvesen GS.Caspases on the brain.J Neurosci Res.2002,69(2):145-150
[8]Jevtovic-Todorovic V ,Hartman RE,Izumi Y,et al.Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits J Neurosci 2003,23(3):876-882
[9]Loepke AW,Soriano SG.An assessment of the effects of general anesthetics on developing brain structure and neurocognitive function.Anesth Analg.2008;106(6):1681-1707
[10]Wang C,Slikker W.Strategies and experimental models for evaluating anesthetics:effects on the developing nervous system.Anesth Analg.2008,106(6):1643-1658
[11]Soriano SG,Anand KJ.Anesthetics and brain toxicity.Curr Opin Anesthesiol.2005,18(3):293-297
[12]Xiang Q,Tan L,Zhao YL,et al.Isoflurane enhances spontaneous Ca2+osscillation in developing rat hippocampal neurons in vitro.Acta Anesthesiol.Scand.2009,53(6):765-773
[13]Soriano SG,Liu Q,Li J,et al.Ketamine activates cell cycle signaling and apoptosis in the neonatal rat brain.Anesthesiology.2010May;112(5):1155-1163
[14]OIney JW,Young G,Wozniak DF,et al.Anesthesiainduced development neuroappotosis.Does it happen in humans?Anesthesiology,2004,101(2):273-275
[15]Creeley CE,OIney JW.The young:neuroapotosis induced by anesthetics and what to do about it.Anesth Analg.2010,110(2):442-448
Effect of Isoflurane,Individually or Combined with Midazolam,on the Expression of Caspase-3in Neural Cells of 7-day-old Rats
Yan Lin,Gui Lingli*,Zhang Chuanhan,Zou Hengjing,Zhang Yue,Li Dajia,Shi Xiaoyun
(Department of Anesthesiology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China)
ObjectiveTo investigate the effect of isoflurane,individully or combined with midazolam on the expression of Caspase-3in neural cells of 7-day-old rats.MethodsThirty-nine 7-day-old male and female SD rats were randomly divided into 3groups(n=13each).Control group(C):receiving intraperitoneal injection of 0.9%saline for 6hof mock anesthesia;isoflurane group (I):receiving 1.5%isoflurane exposure for 6hof anesthesia;midazolam isoflurane group(MI):receiving injection of 9mg/kg midazolam immediately before 1.5%isoflurane exposure for 6hanesthesia.At the end of anesthesia,3rats of each group were taken to collect 100μl artetial blood from the left cardiac ventricle to measure the values of pH,PaO2,PaCO2,BE,HCO3-and SaO2.2hours after the end of anesthesia,the expression of caspase-3mRNA of the cortex and hippocampal were detected by real--time PCR;and the expression of active caspase-3was detected by immunohistochemistry.Results⑴ The values of pH,PaO2,PaCO2,BE,HCO3-and SaO2of I all groups shared no significant difference at the end of anesthesia.⑵ The expression of caspase-3mRNA was up-regulated in I and MI groups in cortical and hippocampal areas(P<0.05).⑶ Compared with those of the C group,the active caspase-3positive cells were significantly increased in the I group and the MI group in the cortical,hippocampal and thalami areas(P<0.05).The number of cleaved caspase-3 postive cells was significantly increased in MI group as compared with that in I group in hippocampal and thalami areas,except for the cortical area.(P<0.05).ConclusionExposure to isoflurane can elevate the expression of Caspase-3in 7-day-old rat brain,and its combination with midazolam can trigger even higher erpression of Caspase-3.
Isoflurane;Midazolam;Cell Apotosis;Caspase-3
R329
A
10.3870/zgzzhx.2012.01.001
2011-09-10
2011-12-01
高等学校博士学科点专项科研基金(200804871046);华中科技大学同济医院院基金
燕琳,女(1984年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)

