Sal B对肝癌细胞株HepG2的促凋亡作用
李 艳 张端莲 王 兰 蔡丽华 吴慧芬 王燕舞桂志祥 梨 莉 谈新提*
Sal B对肝癌细胞株HepG2的促凋亡作用
李 艳1张端莲1王 兰2蔡丽华3吴慧芬3王燕舞桂志祥1梨 莉1谈新提1*
(1武汉大学医学院组织与胚胎学教研室;2武汉大学医学院免疫学教研室,武汉430071;3鄂州市计划生育服务站,湖北436000)
目的 揭示丹酚酸B(Salvianolic Acid B,Sal B)对肝癌细胞株HepG2的杀伤作用。方法 用不同浓度的丹酚酸B处理HepG2细胞,37℃培养24h。用RT-PCR检测促凋亡基因Bax的转录水平,并用流式细胞术检测细胞凋亡的水平。结果 ①100μmol/L、50μmol/L、25μmol/L等浓度的Sal B处理都能使 HepG2细胞促凋亡基因bax的转录水平升高,其中100μmol/L处理组最为明显。②不同浓度的Sal B处理都能使HepG2细胞发生凋亡,其中100μmol/L处理组最为明显。结论 Sal B有促进HepG2细胞凋亡的作用。
丹酚酸B;HepG2细胞株;Bax;凋亡
肝癌是一种世界上最常见的恶性肿瘤之一。在我国占居民恶性肿瘤死亡的第二位[1]。全世界每年新发肝癌约26万例,占全部恶性肿瘤的4.0%,而42.5%的肝癌分布在中国,中国肝癌死亡率为20.4/10万,占全部恶性肿瘤死亡的18.8%。由于肝癌起病比较隐匿,一经确诊往往已属晚期,故只能进行姑息性切除或放、化疗[2]。疗效也不理想。因此,临床上肝癌病人急需特异性的、有效的新型的抗癌。凋亡(apoptosis)是程序性的细胞死亡。是细胞生理性死亡的普遍形式。机体内总是有大量的细胞发生,同时也有无数的细胞凋亡,这样维持机体内环境的动态平衡。平衡力量的任何一方不足,都可能引起机体发生疾病[3]。肿瘤发生的原因是相当复杂的,其中一个重要原因可能是细胞凋亡的趋势减弱[4]。因些,促进肿瘤细胞凋亡,纠正失衡的机体内环境,是抗肿瘤的一个重要方法。然而,细胞的凋亡受到很多种蛋白质分子调控,这些蛋白质大致可分为促凋亡和凋亡抑制两种蛋白。前者如Bax等。后者如Bcl-2等[5]。凋亡抑制蛋白 Bcl-2是控制线粒体致凋亡因子释放的主要调节因子。促凋亡蛋白则以非活性的形式定位分布于胞质。当细胞受到死亡信号刺激后,在某些蛋白酶的作用下促凋亡蛋白便发生构象变化,从胞质中易位到线粒体外膜上,并与膜上的凋亡抑制蛋白相互作用,使凋亡抑制蛋白丧失对细胞凋亡的抑制活性,引起细胞器功能丧失和各种促凋亡因子(如:细胞色素C)的释放,最终导致细胞凋亡[6]。
丹参(Savia miltiorrhiza)又名赤参,紫丹参,红根等。为双子叶植物唇形科,干燥根及根茎。是我国传统的名贵中草药。在我国有数千年的使用历史了。现在也被美国、日本及一些欧洲国家所接纳[7~9]。丹参有活血调经、祛瘀止痛、凉血消痈、清心除烦、养血安神之功效。近几十年来,研究人员发现丹参对心血管病、慢性肝炎、肝硬化及肿瘤也有治疗作用,且无负作用[1~15]。丹参在我国虽然使用了数千年,但人们对其有药用价值的成分一直不是很清楚。最近50年人们才弄清它含有70多种有效成
分[9、16]。
丹酚酸B(Salvianolic Acid B,Sal B)是丹参有效成份中最丰富、最有生物活性的一个成分[5、17]。大 量 的 研 究 证 实 Sal-B 能 抗 氧 化[18、19]、抗 凝血[20~22]、抗 炎[10、15、23]及 抗 肿 瘤 生 长[10、24~26]。 最 近的研究发现Sal-B能抑制头颈部磷状细胞癌、前列腺癌、乳腺癌、肝癌等肿瘤细胞株的生长[27]。
虽然有学者用人肝癌细胞株HepG2作为实验对象[5],但主要是从细胞生长的角度研究Sal-B的影响。本论文则是从细胞凋亡的角度将Sal-B对HepG2的影响进行了初步的探讨。
材料和方法
1.材料
人肝癌细胞株HepG2购于北京生物科技发展有限公司。Sal-B(纯度﹥99%)购于中国药品生物制品检定所。小牛血清购于Hyclone公司。RPMI1640购于武汉博士德公司。DMSO购于武汉凌飞科技有限公司。Annexin V Apoptosis Detection Kit FITC购于eBioxciene公司。目的基因Bax及内参照β-actin的引物购于上海英骏生物技术有限公司。
2.方法
2.1 细胞培养
用含10% 胎牛血清、100I.U/ml青霉素、100μg/ml链霉素的RPMI1640培养基培养HepG2细胞于37℃、5%CO2、饱和湿度的培养箱中。2-3d传代一次,当细胞到达对数生长期时用于本实验研究。
2.2 Sal B处理细胞
消化处于对数生长期的HepG2细胞,调整细胞浓度为 2.5×104/ml,用 96 孔板接种,每孔200μl;24h 后,实验组换溶于 DMSO(终浓度为0.2%)的 Sal B,药物终浓度分别为100μmol/L、50μmol/L和25μmol/L,另设对照组(只加200μl细胞悬液),每组设5个复孔;继续培养24h后,用于2.3和2.5的实验。
2.3 RT-PCR(Reverse transcription polymerase chain reaction)检测Bax的转录水平
收集Sal B处理过HepG2细胞,用Trizol试剂抽提得到总RNA后,首先用DNAse消化,去除抽提物中残存的DNA。然后以Oligo(dT)20为引物,按Promega公司逆转录试剂盒的说明合成cDNA,再用TaKaRa公司试剂盒扩增目的DNA。基因扩增条件为:95℃预变性5min,95℃10sec,60℃10sec,72℃10sec,35个循环,最后于72℃延伸10min,保存于4℃。实验以β-actin为内参照。目的基因Bax的引物根据GenBank中Bax基因(基因号:NM017059)用DNAMAN4.0程序设计。目的基因Bax及内参照β-actin的引物序列为:Bax:sense:5'-ACCAAGAAGCTGAGC GAGTGTC-3',antisense:5'-GGCAGACCGTGACCATCTTTGT-3',Product:365bp;β-actin:sense:5'-TGTAGACCATGTAGTTGAGGTCA-3',antisense:5'-GGC TGTATTCCCCTCCATCG-3',Product:154bp。
2.4 琼脂糖凝胶电泳
配1×TBE电泳缓冲液300ml,3%琼脂糖(Agarose)凝胶40ml。取出5μl PCR扩增产物,加入5μl(溴酚蓝、二甲苯蓝、蔗糖和EDTA)混合液,制成样品。以样品5μl、Marker 2μl的量上样,电泳100V45min。
2.5 流式细胞术检测HepG2细胞凋亡的水平
收集Sal B处理细胞,用完全培养基重悬细胞,调整细胞浓度到1×106个/ml。取100μl细胞悬液,加入抗体,4℃孵育48h;离心,去上清,加入染色缓冲液洗2次,离心;去上清,加入100μl PBS重悬细胞,加入5μl Annexin V,室温避光孵育15min离心,加入染色缓冲液洗2次,离心;去上清,加入200μl PBS重悬细胞,加入5μl PI,室温避光孵育15min。流式细胞仪(BD FACSCantoTMII,BD Biosciences)分析。
3.统计学处理
实验数据进行t检验,检验水准为0.05。
结 果
1.Sal B促进HepG2细胞Bax基因的转录
为了检测Sal B对HepG2细胞bax基因转录水平的影响,我们用不同浓度(100μmol/L、50μmol/L、25μmol/L)的 Sal B 处理细胞,并在37℃培养24h。RT-PCR结果发现各种浓度的Sal B都能引起HepG2细胞促凋亡基因bax的mRNA水平明显升高,100μmol/L组的升高水平最为明显;而对照组几乎未检测到mRNA(图1)。
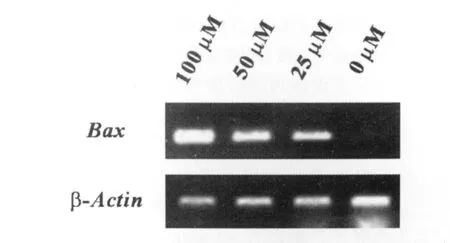
图1 RT-PCR检测Sal B处理/未处理 HepG2细胞Bax基因的转录水平Fig.1 The level of Bax gene transcription of HepG2s treated with different concentration of Sal B or untreated was measured via RT-PCR.
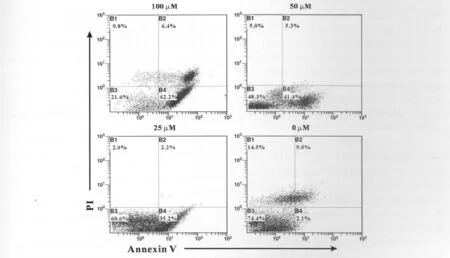
图2 流式细胞术检测Sal B处理/未处理HepG2细胞细胞凋亡的水平Fig.2 The level of apoptosis of HepG2streated with different concentration of Sal B or untreated was measured through flow cytometry.
2.Sal B提高HepG2细胞的凋亡水平
为了检测Sal B对HepG2细胞株凋亡水平的影响,我们用不同浓度的Sal B处理细胞后,再依次经过Annexin V和PI处理细胞,然后用流式细胞仪分析细胞凋亡情况。结果发现,与对照组相比,即使是最低浓度的Sal B处理的细胞,也会发生明显的凋亡(P<0.05);高浓度组最明显(P<0.001);而对照组,细胞凋亡水平很低(图2)。
讨 论
机体组织内环境的稳定依赖于细胞生长和细胞死亡之间的平衡,而人类肿瘤的发生正是这种内环境稳定的失衡[4-1]。这也意味着程序性细胞死亡比例下降会引起肿瘤形成。因此,某些人类肿瘤的标志是对刺激失去凋亡反应的能力[4-3,4]。有鉴于此,增强肿瘤细胞对凋亡刺激反应的能力成为抗肿瘤的一个重要方法。
能引起细胞发生凋亡的刺激有很多[28]。有些刺激来自细胞外,如:死亡受体、化学药物、抗体药物。有些来自细胞内,如:活性氧(reactive oxygen species,ROS),代谢终末产物。凋亡启动的标志是caspases激活。Caspases是一种半胱氨酸蛋白酶家族,在多种细胞死亡中发挥死亡效应分子的作用[29]。Caspases以未激活的酶原形式合成,激活时会发生裂解并二聚化[29]。Caspases的激活有二条途径:死亡受体(外)通路和线粒体(内)通路[30]。在死亡受体通路,死亡受体通过与对应的配体结合导致凋亡启动分子 Caspase-8的激活[31]。Caspase-8一旦激活,要么直接裂解效应Caspases如Caspase-3,或者通过裂解Bid激活线粒体通路。裂解后的Bid(如:tBid)依次转移线粒体膜,并在膜上引起膜间蛋白(如:细胞色素C,Cytocrome C)释放到细胞液 中[32,33]。 在 胞 液 中 细 胞 色 素 C 与 Apaf-1 和Caspase-9形成多聚复合物(凋亡诱导复合物),引起Caspase-3的激活[33]。其中线粒体依赖性细胞凋亡通路是抗癌药物诱导细胞凋亡的核心通路[34]。细胞的凋亡受到很多种蛋白质分子调控,这些蛋白质大致可分为促凋亡和凋亡抑制两种蛋白。前者如Bax、P53、Fas、Fasl等。后者如 Bcl-2、Bcl-xL、NF-κB、MDM-2等[5]。
Bax和Bcl-2是细胞凋亡调控因子,同属于Bcl-2家族,具有21%的同源性,可通过形成同二聚体或异二聚体的方式来改变线粒体的通透性,从而决定细胞是生存还是死亡。不同细胞Bcl-2的定位不同,有些细胞分布于线粒体膜上,有的定位于内质网膜上,还有的位于核膜上,并通过抑制Cytocrome C释放而发挥凋亡抑制作用[35]。Bax为促凋亡蛋白,常位于细胞液中,当凋亡发生时,从胞液迁移到线粒体膜和核膜,拮抗 Bcl-2的凋亡抑制作用[34]。当Bcl-2的相对量占优势时,Bcl-2/Bcl-2的量增多,促进Bcl-2/Bax的形成,从而抑制细胞凋亡;当Bax的相对量占优势时,则Bax/Bax的量增多,促进细胞凋亡。因此,Bcl-2和Bax两者的比例是关系到细胞凋亡或存活的关键因素。
先用不同浓度的Sal B处理HepG2细胞,然后用RT-PCR检测促凋亡基因Bax的转录水平。结果发现各种浓度的Sal B都能引起HepG2细胞促凋亡基因bax的mRNA水平明显升高,100μM组的升高水平最为明显;而对照组几乎未检测到mRNA(图1)。该结果提示与未用Sal B处理组相比较,随着Sal B处理浓度的增加,促凋亡蛋白Bax mRNA表达水平明显增强。但这是否意味着Bax与Bax形成了同二聚体,是否真正启动了细胞凋亡呢。我们进一步的实验给出了回答。我们用流式细胞术检测了不同浓度Sal B处理的HepG2发生凋亡的水平。结果发现随着Sal B处理浓度的增加,凋亡细胞的比率也增加,而未用Sal B处理的细胞,凋亡率很低(图2)。上述这些实验结果说明Sal B对人肝癌细胞株HepG2有促凋亡作用,可能是通过上调促凋亡蛋白Bax的表达,从而使Bcl-2/Bax的比率增高,并使Bax从胞质中易位到线粒体外膜上,与膜上的Bcl-2相互作用,使Bcl-2丧失对细胞凋亡的抑制活性,引起细胞器功能丧失和各种促凋亡因子(如:细胞色素C)的释放,最终导致细胞凋亡[6]。
本文证明了Sal B对人肝癌细胞株HepG2有促进凋亡的作用,并对其作用机制进行了初步探讨,其杀伤肿瘤的确切机制还有待深入的研究。如前所述,Sal B是一种低毒性的天然药物,具有巨大肿瘤治疗药物开发的价值。
[1]邓敬桓,秦雪 .原发性肝癌发生机制的研究进展 .环境与健康杂志,2007,24(11):924-926
[2]Cheung JY,Ong RC,Suen YK,et al.Polyphyllin D is apotent apoptosis inducer in drug-resistant HepG2 cells.Cancer Lett,2005,217(2):203-211
[3]Simone F.Targeting Apoptosis Signaling in Pancreatic Cancer.Cancers,2011,3:241-251
[4]V'yacheslav L,George S,Roman S,et al.Ion Channels in Control of Cancer and Cell Apoptosis.Cell Physiol,2011,301:969-976
[5]Zhao Y,Guo YH,Gu XB.Salvianolic Acid B,a Potential Chemopreventive Agent,for Head and Neck Squamous Cell Cancer.J Oncol,2011,Article ID 534548:1-8
[6]丛义梅,刘 鹏,金大鹏,等 .Bcl-2家族与细胞凋亡的关系 .中华医学研究杂志,2008,8(2):125-127
[7]Wang X,Morris NSL,Lee KH.New developments in the chemistry and biology of the bioactive constituents of Tanshen.Med Res Rev,2007,27(1):133-148
[8]Tsai TH.Analytical approaches for traditional Chinese medicines exhibiting antineoplastic activity.Journal of Chromatography B:Biomedical Sciences and Applications,2001,764(1-2):27-48
[9]Zhou L,Zuo Z,Chow M S S.Danshen:an overview of its chemistry,pharmacology,pharmacokinetics,and clinical use.J Clin Pharmacol,2005,45 (12):1345-1359
[10]Hao Y,Xie T,Korotcov A,et al.Salvianolic acid B
inhibits growth of head and neck squamous cell carcinoma in vitro and in vivo via cyclooxygenase-2and apoptotic pathways.Int J Cancer,2009,124:2200-2209[11]Yin H Q,Choi Y J,Kim Y C,et al.Salvia miltiorrhiza Bunge and its active component cryptotanshinone protect primary cultured rat hepatocytes from acute ethanol-induced cytotoxicity and fatty infiltration.Food Chem Toxicol,2009,47:98-103
[12]Liu JJ,Zhang Y,Lin D J,et al.Tanshinone IIA inhibits leukemia THP-1cell growth by induction of apoptosis.Oncol Rep,2009,21:1075-1081
[13]Liu J,Shen H M,Ong C N.Salvia miltiorrhiza inhibits cell growth and induces apoptosis in human hepatoma HepG(2)cells.Cancer Lett,2000,153:85-93
[14]Lee A R,Wu W L,Chang W L,et al.Isolation and bioactivity of new tanshinones.J Nat Prod,1987,50:157-160
[15]Wang X,Morris N S L,Lee K H.New developments in the chemistry and biology of the bioactive constituents of Tanshen.Med Res Rev,2007,27:133-148
[16]Li Y G,Song L,Liu M,et al.Advancement in analysis of Salviae miltiorrhizae Radix et Rhizoma(Danshen).Journal of Chromatography A,2009,1216(11):1941-1953
[17]Watzke A,O’Malley S J,Bergman R G,et al.Reassignment of the configuration of salvianolic acid B and establishment of its identity with lithospermic acid B.J Nat Prod,2006,69:1231-1233
[18]Liu C S,Hu J F,Zhang W,et al.Comparison of antioxidant activities between salvianolic acid B and Ginkgo biloba extract (EGb 761).Acta harmacol Sin,2006,27:1137-1145
[19]Chen Y H,Du G H,Zhang J T.Salvianolic acid B protects brain against injuries caused by ischemiareperfusion in rats.Acta Pharmacol Sin,2000,21:463-466
[20]Park J W,Lee S H,Yang M K,et al.15,16-dihydrotanshinone I,a major component from Salvia miltiorrhiza Bunge(Dansham),inhibits rabbit platelet aggregation by suppressing intracellular calcium mobilization.Arch Pharm Res,2008,31:47-53
[21]Tang M K,Ren D C,Zhang J T,et al.Effect of salvi
anolic acids from Radix Salviae miltiorrhizae on regional cerebral blood flow and platelet aggregation in rats.Phytomedicine,2002,9:405-409
[22]Du G H,Qiu Y,Zhang J T.Salvianolic acid B protects the memory functions against transient cerebral ischemia in mice.J Asian Nat Prod Res,2000,2:145-152
[23]Chen Y L,Hu C S,Lin F Y,et al.Salvianolic acid B attenuates cyclooxygenase -2expression in vitro in LPS-treated human aortic smooth muscle cells and in vivo in the apolipoprotein-E-deficient mouse aorta.J Cell Biochem,2006,98:618-631
[24]Liu C L,Xie L X,Li M,et al.Salvianolic acid B inhibits hydrogen peroxide-induced endothelial cell apoptosis through regulating PI3K/Akt signaling.PLoS One,2007,2:e1321
[25]Bi X B,Deng Y B,Gan D H,et al.Salvianolic acid B promotes survival of transplanted mesenchymal stem cells in spinal cord-injured rats.Acta Pharmacol Sin,2008,29:169-176
[26]Zhou Z T,Yang Y,Ge J P.The preventive effect of salvianolic acid B on malignant transformation of DMBA-induced oral premalignant lesion in hamsters.Carcinogenesis,2006,27:826-832
[27]Zhao Y,Hao Y B,Ji H G,et al.Combination Effects of Salvianolic Acid B with Low Dose Celecoxib on Inhibition of Head and Neck Squamous Cell Carcinoma Growth in vitro and in vivo.Cancer Prev Res(Phila),2010,3(6):787-796
[28]Lockshin R A,Zakeri Z.Cell death in health and disease.J Cell Mol Med,2007,11:1214-1224
[29]Logue S E,Martin S J.Caspase activation cascades in apoptosis.Biochem Soc Trans,2008,36:1-9
[30]Hengartner M O.The biochemistry of apoptosis.Nature,2000,407:770-776
[31]Ashkenazi A.Targeting the extrinsic apoptosis pathway in cancer.Cytokine Growth Factor Rev,2008,19:325-331
[32]Kroemer G,Galluzzi L,Brenner C.Mitochondrial membrane permeabilization in cell death.Physiol Rev,2007,87:99-163
[33]Adams J M,Cory S.The Bcl-2apoptotic switch in cancer development and therapy.Oncogene,2007,26:1324-1337
[34]Gottlieb R A.Mitochondria:execution central.FEBS Lett,2000,482(1-2):6-12
[35]Scorrano L,Korsmeyer S J.Mechanisms of cytochrome c release by proapoptotic Bcl-2family members.Biochem Biophys Res Commun,2003,304(3):437-444
Sal B Promotes apoptosis of human liver cancer cell line HepG2
Li Yan1,Zhang Duanlian1,Wang Lan2,Cai Lihua3,Wu Huifen3,Wang Yanwu1,Gui Zhixiang1,Li Li1,Tan Xinti1*
(1Department of Histology and Embryology ,Wuhan University;2Department of Immunology,Wuhan University ,Hubei 430071;3Family Planning station of Ezhou City,Hubei 436000,China)
ObjectiveTo reveal the effect of sal B to kill HepG2s.MethodsHepG2swere treated with different concentrations of sal B and were cultured at 37℃for 24hours.Then the transcription level of Bax gene of the cells was detected by reverse transcription polymerase chain reaction.The being the apoptosis level of the cells was analyzed with flow cytometry.ResultsThe transcription level of Bax gene of the cells treated with sal B was markedly improved,being the highest in 100μM sal B treated group.The numbers of apoptotic cells treated with sal B was increased,being the highest 100μM treated group.ConclusionSal B can promote the apoptosis of HepG2s.
Salvianolic acid B;HepG2;Bax;Apoptosis
R339.12+2
A
10.3870/zgzzhx.2012.01.003
2011-10-15
2011-12-01
湖北省卫生厅人才基金资助(JX4B14)
李艳,女(1983年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)

