缺氧环境下MSCs促进血管内皮细胞增殖和血管形成
刘容容 王 晔 李士勇 徐丽君
缺氧环境下MSCs促进血管内皮细胞增殖和血管形成
刘容容 王 晔 李士勇 徐丽君*
(南昌大学第二附属医院神经内科,江西330006)
目的 探讨成人骨髓间充质干细胞(bone marrow mesenchymal stem cells BMSCs)在体外缺氧环境下对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)增殖和血管形成能力的影响及其可能机制。方法 密度梯度离心法收集分离成人骨髓血MSCs并进行体外培养扩增,传代至4代进行实验,流式细胞仪鉴定MSCs表面标志。BMSCs缺氧培养0h(对照组)、12h、24h和48h后,RT-PCR检测SDF-1和VEGF基因表达,ELISA法检测细胞上清液中SDF-1和VEGF蛋白含量。HUVECs传代培养后分成三组进行实验:对照组、BMSCsCMN-HUVECs组,BMSCsCMH-HUVECs组,MTT检测三组细胞增殖能力,体外血管形成实验分析三组细胞在Matrigel上管腔样结构形成情况。结果 (1)BMSCs呈旋涡状长梭形即纤维母细胞样生长;(2)人BMSCs阳性表达CD29、CD44和CD90,而CD34、CD45和CD106为阴性;(3)BMSCs缺氧培养后SDF-1和VEGF在mRNA和蛋白水平表达均较常氧培养显著增高(P均<0.05);(4)BMSCsCMH明显提高HUVECs增殖能力(P<0.05),显著增加HUVECs在Matrigel上形成管腔样结构的能力(P<0.05)。结论 人BMSCs在缺氧环境下通过旁分泌SDF-1和VEGF提高血管内皮细胞增殖和管腔样结构形成能力,促进血管新生。
骨髓间充质干细胞;缺氧;旁分泌;血管新生
骨髓间充质干细胞具有高增殖活性和强大的自我更新能力以及多向分化潜能;还具有自分泌和旁分泌作用,能分泌许多可溶性生长因子和细胞因子[1],已经证明BMSCs修复和分化为多种组织的能力,尤其在血管修复和重建方面成为缺血性疾病细胞治疗研究的热点。大量研究显示BMSCs移植能促进缺血组织的血管新生[2-5],但BMSCs移植后促进血管新生的具体机制目前还不完全清楚。人脐静脉内皮细胞与人动脉内皮细胞的生物学特性相似,在血管功能研究方面得到越来越广泛的应用[6]。因此本实验观察体外BMSCs缺氧培养后对HUVECs增殖和血管形成能力的影响并探讨其可能机制,为临床缺血缺氧性疾病的治疗寻找新方法。
材料和方法
1.材料
1.1 主要试剂及材料
淋巴细胞分离液,MTT粉,ELISA试剂盒(Invitrogen)小鼠抗人单克隆抗体 CD29-FITC、CD45-FITC、CD34-FITC 和 CD106-PE、CD44-PE、CD90-PE(购自BD 公司);DMSO,胎牛血清(Hyclone);DMEM(Gibco);Matrigel(BD公司);DEPC水;Trizol和DNA Marker(购于北京全式金生物技术有限公司);逆转录试剂盒(Takala);Mix(TianGen);PCR引物(上海捷瑞生物工程有限公司合成);琼脂糖;5×TBE;EB。
1.2 主要仪器和设备
缺氧交换器(长沙长锦科技有限公司);酶标仪;琼脂糖凝胶电泳仪;PCR 仪(BIO RAD,My Cycler);低温离心机;微量移液器;倒置相差显微镜;净化工作台,CO2培养箱,FACS-Calibur流式细胞分析仪(Becton Dickinson,CA)。
2.实验方法
2.1 细胞培养
无菌条件下收集成人骨髓血,密度梯度离心法(1500r/min)分离收集BMSCs,10%胎牛血清(fetal bovine serum,FBS)-DMEM 于37℃、饱和湿度的5%CO2培养箱中培养。7天时筛选集落细胞,生长汇合率达到90%时胰酶消化传代培养扩增细胞,第4代用于实验。HUVECs(本院分子中心保存)培养与BMSCs相同。缺氧培养:缺氧前换成无血清DMEM,置于密闭容器中,持续充以含1%O2,5%CO2和94%N2混合气体,气体从容器另一孔排出,约5-10min关闭排气孔,分别于0h(即对照组)、12h、24h和48h取出进行后续实验。
2.2 流式细胞技术鉴定MSCs
胰酶消化收集MSCs,0.1%胎牛血清PBS重悬2次,取待测细胞6×106分为6管,分别加入CD29-FITC、CD45-FITC、CD34-FITC 和 CD106-PE、CD44-PE、CD90-PE抗体,4℃孵育30min,再用0.1%胎牛血清PBS重悬2次,每管加入500μl PBS混匀后上机检测,每个样本获取10000个细胞,Cellquest软件分析检测结果。
2.3 RT-PCR检测SDF-1和 VEGF基因表达
Trizol法提取缺氧培养细胞RNA,紫外分光光度计测样品 A260/280比值,在1.8-2.1之间,说明RNA未降解。取各组RNA模板按逆转录试剂盒说明书逆转录合成cDNA,反应总体积为10μl,反应条件依次为37℃15min,85℃5sec。再以cDNA为模板,采用Primer 5.0软件设计的各自引物(见表1)VEGF(94℃预变性5min;94℃ 30s,55℃ 40s,72℃1min共35个循环;72℃总延伸8min)、SDF-1(94℃预变性5min;94℃30s,57℃40s,72℃1min共35个循环;72℃总延伸8min)和β-actin(94℃预变性5min;94℃30s,56℃40s,72℃1min共35个循环;72℃总延伸8min)进行PCR扩增。PCR扩增反应体系:Mix 25μl,cDNA 2μl,上游引物1μl,下游引物1μl,无核酶水加至50μl。1.5%琼脂糖凝胶电泳,溴化乙锭显色,自动凝胶图像分析系统分析检测PCR产物。
2.4 收 集条 件 培 养 基 (conditioned medium,CM)
BMSCs常氧培养24h收集细胞上清液,500×g离心5min,0.2μm滤器过滤得到常氧环境下BMSCs条件培养基即BMSCsCMN;收集缺氧培养24h细胞上清液得到缺氧环境下BMSCs培养基即BMSCsCMH。
2.5 ELISA检测CM中SDF-1和VEGF含量
将收集上清液后的细胞胰酶消化并进行计数。收集的CM按ELISA试剂盒步骤操作,反应终止后酶标仪检测450nm处吸光度值,检测结果以单位体积细胞数量校正即获得CM中SDF-1和VEGF浓度(ng/106cells),每组8个平行孔。
2.6 MTT检测细胞增殖
将对数生长期 HUVECs以含0.1%FBSDMEM接种于96孔培养板内,接种密度1×104个/孔,24h后将培养基分别更换为200μl的含0.1%FBS-DMEM(对照组)、BMSCsCMN和BMSCsCMH,每组8个平行孔。上述各组细胞进行缺氧培养,分别于12h、24h和48h加入浓度为5mg/m1的 MTT溶液(每孔20μl),37℃避光孵育4h,弃去孔内培养液,每孔加入150?l DMSO,震荡10min,使结晶充分溶解。酶标仪测定波长为490nm时每孔的吸光度(A)值。
2.7 血管新生实验
96孔培养板内均匀铺以 Mtrigel,每孔30μl;置于37℃,5%CO2环境下1h,使 Matrigel凝固。取对数生长期HUVECs,以1×104个/孔接种于铺有Matrigel的96孔板内。分3组进行分析:对照组(10%FBS-DMEM)、BMSCsCMN组 (BMSCsCMN和10%FBS-DMEM 混合液,比例1:1)和BMSCsCMH组(BMSCsCMH和10%FBS-DMEM 混合液,比例1:1),每组8个平行孔。将各组细胞置于37℃,缺氧培养24h,倒置相差显微镜下观察管腔样结构形成情况。
3.统计分析
实验所得数据均以均数±标准差(¯x±s)表示,实验组与对照组之间数值比较采用SPSS13.0软件进行学生t检验,差异性分析采用One-Way ANOVA test,P<0.05统计学有显著差异。

表1 VEGF、SDF-1和β-actin mRNA的引物Table 1 The primers of mRNA of VEGF,SDF-1andβ-actin
结 果
1.BMSCs形态和鉴定
BMSCs培养至第4代后,倒置相差显微镜下呈旋涡状长梭形纤维母细胞样形态生长(见图1)。流式细胞技术分析显示人BMSCs表面标记物CD29、CD44和CD90表达阳性,而CD34、CD45和CD106为阴性。
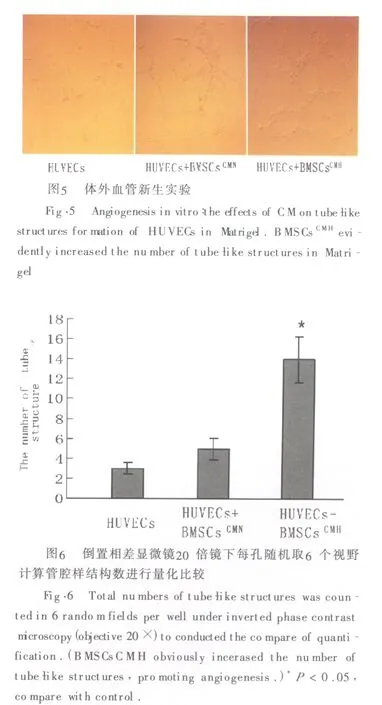
图1 倒置相差显微镜下MSCs呈漩涡状长梭形生长。Fig.1 Under inverted phase-contrast microscopy,BMSCs exhibited fibroblast-like morphology
2.SDF-1和 VEGF mRNA和蛋白表达
与对照组相比,BMSCs缺氧培养12h,24h和48h后,SDF-1和VEGF mRNA表达水平均显著增高(P<0.05,见图2),而各缺氧时间点的SDF-1和VEGF表达无显著差异(P>0.05);BMSCsCMH中SDF-1和VEGF蛋白含量明显高于BMSCsCMN(见图3)。compared with BMSCsCMN*P<0.05
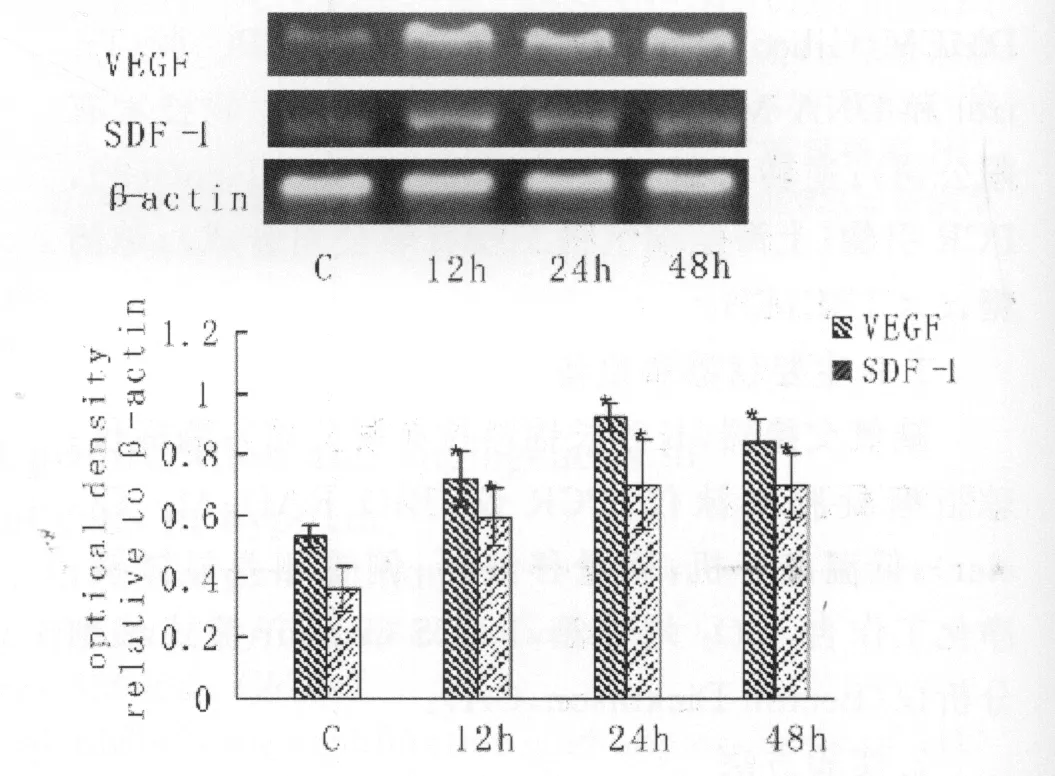
图2 缺氧对SDF-1和VEGF mRNA在BMSCs中表达的影响。Fig.2 The expression of SDF-1and VEGF mRNA in BMSCs at different hypoxia time points.BMSCs were exposed to hypoxia for 12h、24h和48h,both SDF-1and VEGF mRNA levels significantly increased,β-actin as a control for efficiency of the amplification reactions,*P<0.05,compared with contol group.
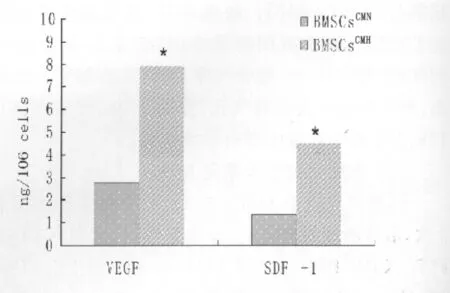
图3 不同CM中SDF-1和VEGF含量。Fig.3 Secretion of SDF-1and VEGF by BMSCs under hypoxic conditions was quantitatively by ELISA.Data displayed SDF-1and VEGF in BMSCsCMHsignificant increased
3.HUVECs增殖能力检测
为研究BMSCs的旁分泌方作用对缺血组织血液再灌注的影响,观察不同CM对HUVECs增殖能力影响,因为VECs的增殖是血管新生基础。利用MTT检测各组HUVECs增殖能力并进行比较。与对照组相比,各个缺氧时间点BMSCsCMH组均明显提高 HUVECs增殖能力(P 均<0.05),同时BMSCsCMH组对HUVECs的促增殖作用也明显强于BMSCsCMN组(P 均<0.05),而对照组和BMSC-sCMN组对HUVECs增殖能力影响无显著差异(P>0.05)见图4。
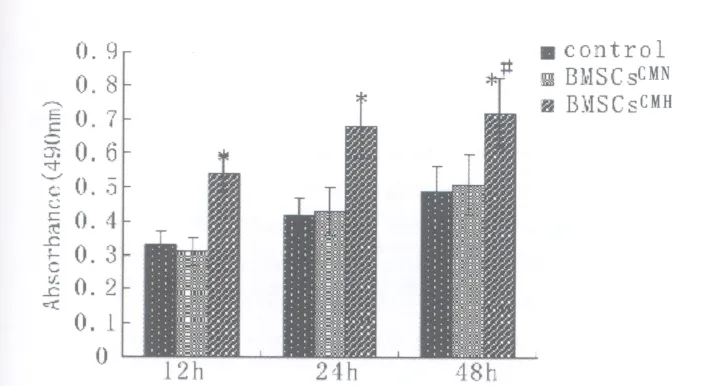
图4 CM对HUVECs增殖能力影响。Fig.4 The effects of CM on proliferation of HUVECs。MTT assay demonstrated BMSCsCMH significantly increased proliferation of HUVECs。*P<0.05,compared with control and BMSCsCMN at the same time;#P<0.05,compared with BMSCsCMH at different time.
4.血管新生实验
检测不同CM对HUVECs在Matrigel上形成官腔样结构能力的影响,以明确BMSCs旁分泌因子SDF-1和VEGF在血管新生中的作用。倒置相差显微镜下观察,BMSCsCMH组官腔样结构显著多于对照组和BMSCsCMN组(见图5)。每孔随机取6个视野于20倍镜下计算每组管腔样结构数目并算均数和标准差进行量化比较,发现与对照组和BMSC-sCMN组相比,BMSCsCMH组显著提高HUVECs官腔样结构形成能力(P<0.05,见图6),而BMSCsCMN组对HUVECs的官腔样结构形成能力与对照组比无明显差异(P >0.05)。
讨 论
血管新生对缺血组织再灌注、营养传递以及氧浓度的维持起重要作用,因此治疗性血管新生在缺血性疾病的治疗和功能恢复方面起关键作用,而MSCs能修复并重建缺血组织血管,是治疗性血管新生的最佳选择。然而有关MSCs在缺氧环境下促进血管新生的具体机制尚不十分清楚。尽管有证据说明MSCs在缺血部位有分化能力,但其治疗效果主要靠旁分泌信号而不是分化能力[7-10],本研究结果证实:体外缺氧诱导的MSCs旁分泌因子SDF-1和VEGF对血管内皮细胞增殖和血管形成能力有明显促进作用。
血管新生的发生发展是个复杂的过程,涉及了多种生长因子、细胞因子和细胞行为。血管新生诱导因子中最为熟悉的是VEGF。VEGF增加血管内皮细胞活性并提高其增殖能力,显著促进缺血组织的血管新生,从而改善局部血供,改善缺血损伤后组织功能恢复。本研究数据显示BMSCs缺氧培养后VEGF在基因和蛋白水平均显著增加,与先前的研究结果一致[10,11],且 MSCs过表达VEGF基因后血管新生显著增加[12]。
虽然VEGF是血管发生发展的关键因子,但VEGF单独不足以完成脉管系统功能和结构的成熟发展。体内VEGF诱导的血管渗透性常常较大且不能与现有的脉管系统进行适当的连接;而SDF-1在缺血引起的血管新生中亦起重要作用[13,14]并承担了血管的成熟和稳定功能。本研究发现BMSCs缺氧培养后SDF-1的蛋白和mRNA亦显著增加且与VEGF同步,说明两者在血管新生中起协同作用,与Kryczek I等[15]的实验结果一致,VEGF和SDF-1结合在血管异生过程中有协同作用,且血管新生过程中涉及的Akt和eNOS激活是由 VEGF和SDF-1共同介导的[16]。
BMSCs缺氧培养后VEGF和SDF-1mRNA和蛋白均表达增加,为进一步明确旁分泌因子对血管内皮细胞功能的影响,利用MTT和血管新生实验分析CM对HUVECs增殖能力和官腔样结构形成能力的影响。结果显示:与对照组和BMSCsCMN组相比,BMSCsCMH组HUVECs增殖能力和Matrigel上管腔样结构形成能力显著增加;而BMSCsCMN组和对照组无明显差异,因此缺氧可诱导MSCs旁分泌因子SDF-1和VEGF促进血管形成,提高缺血组织血液供应。与先前报道一致:MSCs-CM能显著增加VECs增殖活性,促进血管新生[8];MSCs同时转染SDF-1和 VEGF基因后能为体内微环境提供高浓度VEGF和SDF-1蛋白,有更大的能力增加缺血组织的毛细血管密度[5]。
总之,体外缺氧显著上调BMSCs的SDF-1和VEGF基因表达,并促进二者大量分泌至上清液中;MSCs缺氧培养后收集的上清液即BMSCsCMH显著增加VECs增殖能力和官腔样结构形成能力,促进血管新生。因此MSCs在缺氧环境下通过旁分泌SDF-1和VEGF因子促进血管新生,二者在此过程中起协同作用,为临床缺血缺氧性疾病的治疗提供新方法。
[1]Gnecchi M,Zhang Z,Ni A,et al.Paracrine mechanisms in adult stem cell signaling and therapy.Circ Res,2008.103(11):1204-1219
[2]Bussolati B,Tetta C,Camussi G.Contribution of stem cells to kidney repair.Am J Nephrol,2008.28(5):813-822
[3]Oh JY,Kim MK,Shin MS,et al.The anti-inflammatory and anti-angiogenic role of mesenchymal stem cells in corneal wound healing following chemical injury.Stem Cells,2008.26(4):1047-1055
[4]Zhuang Y,Chen X,Xu M,et al.Chemokine stromal cellderived factor 1/CXCL12increases homing of mesenchymal stem cells to injured myocardium and neovascularization following myocardial infarction.Chin Med J(En-gl),2009.122(2):183-187
[5]Tang J,Wang J,Zheng F,et al.Combination of chemokine and angiogenic factor genes and mesenchymal stem cells could enhance angiogenesis and improve cardiac function after acute myocardial infarction in rats.Mol Cell Biochem,2010.339(1-2):107-118
[6]Goon PK,Watson T,Shantsila E,et al.Standardization of circulating endothelial cell enumeration by the use of human umbilical vein endothelial cells.J Thromb Haemost,2007.5(4):870-872
[7]Sato T,Iso Y,Liyama T,et al.Coronary vein infusion of multipotent stromal cells from bone marrow preserves cardiac function in swine ischemic cardiomyopathy via enhanced neovascularization.Lab Invest,2011.91(4):553-564
[8]Lee EY,Xia Y,Kim WS,et al.Hypoxia-enhanced woundhealing function of adipose-derived stem cells:increase in stem cell proliferation and up-regulation of VEGF and bFGF.Wound Repair Regen,2009.17(4):540-547
[9]Hocking AM,Gibran NS.Mesenchymal stem cells:paracrine signaling and differentiation during cutaneous wound repair.Exp Cell Res,2010.316(14):2213-2219
[10]Li Z,Guo J,Chang Q,et al.Paracrine role for mesenchymal stem cells in acute myocardial infarction.Biol Pharm Bull,2009.32(8):1343-1346
[11]Kagiwada H,Yashiki T,Ohshima A,et al.Human mesenchymal stem cells as a stable source of VEGF-producing cells.J Tissue Eng Regen Med,2008.2(4):184-189
[12]Tang JM,Wang JN,Zhang L,et al.VEGF/SDF Promotes Cardiac Stem Cell Mobilization and Myocardial Repair in the Infarcted Heart.Cardiovasc Res,2011,91(3):402-411
[13]Tang J,Wang J,Guo L,et al.Mesenchymal stem cells modified with stromal cell-derived factor 1alpha improve cardiac remodeling via paracrine activation of hepatocyte growth factor in a rat model of myocardial infarction.Mol Cells,2010.29(1):9-19
[14]Loh SA,Chang EI,Galvez MG,et al.SDF-1alpha expression during wound healing in the aged is HIF dependent.Plast Reconstr Surg,2009.123(2Suppl):65S-75S
[15]Kryczek I,Lange A,Mottram P,et al.CXCL12and vascular endothelial growth factor synergistically induce neoangiogenesis in human ovarian cancers.Cancer Res,2005.65(2):465-472
[16]Tang J,Wang J,Yang J,et al.Adenovirus-mediated stromal cell-derived-factor-1alpha gene transfer induces cardiac preservation after infarction via angiogenesis of CD133+ stem cells and anti-apoptosis.Interact Cardiovasc Thorac Surg,2008.7(5):767-770
Mesenchymal stem cells promoted proliferation and angiogenesis of vascular endothelial cells in hypoxia
Liu Rongrong,Wang Ye,Li Shiyong,Xu Lijun*
(Department of Neurology Second Hospital Affiliated to Nanchang University,Jiangxi,330006,China)
ObjectiveTo investigate the effects of BMSCs on proliferation and angiogenesis of HUVECs and its possible mechanism in hypoxia.MethodsBMSCs separated by density gradient centrifugation were cultured,expanded and used at passage 4.Their phenotypic characterizations were indentified by flow cytometry.After BMSCs exposed to hypoxia for 0h (control),12h,24hand 48h,intracellular levels of SDF-1and VEGF mRNA were assayed by RT-PCR,and the secretion of SDF-1and VEGF was quantitatively analyzed by ELISA.HUVECs were cultured,passaged and divided into 3groups:control,BMSC-sCMN-HUVECs,BMSCsCMH-HUVECs.Proliferation of HUVECs were detected by MTT.Tube-like structure formation in Matrigel were analyzed as the assay of angiogenesis in vitro.Results(1)Under inverted phase-contrast microscopy,BMSCs exhibited fibroblast-like morphology;(2)BMSCs expressed CD29,CD44and CD90,but not CD34、CD45and CD106.(3)Both mRNA and protein levels of SDF-1and VEGF increased significantly compared with those of the control group(P<0.05);(4)BMSCsCMHsignificantly increased the proliferation of HUVECs and the number of tube-like structures in Matrigel(P<0.05).ConclusionHuman BMSCs improve proliferation and tube-like structures formation of Vascular endothelial cells and promote angiogenesis in hypoxia,through paracrined SDF-1and VEGF.
Bone Mesenchymal Stem Cells;Hypoxia;Paracrine;Angiogenesis
R329
A
10.3870/zgzzhx.2012.01.018
2011-11-01
2011-11-26
国家自然科学基因(81060100)
刘容容,女(1985年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)

