鼻息肉中NF-κB的活化对IL-8转录的影响及意义
彭 庆 简 雷 方向东 蔡昌学
鼻息肉中NF-κB的活化对IL-8转录的影响及意义
彭 庆 简 雷 方向东 蔡昌学1*
(武汉市商业职工医院耳鼻喉科 湖北430021;1华中科技大学同济医学院病原生物学系 武汉430030)
目的 通过检测鼻息肉组织中核因子кB(NF-кB)的活化及白介素-8(IL-8)的转录水平,探讨鼻息肉组织中NF-кB的活化对IL-8转录的影响及临床意义。方法 分别应用凝胶电泳迁移实验法、蛋白免疫印迹法、免疫组织化学法及逆转录聚合酶链反应法检测47例鼻息肉患者(鼻息肉组)的息肉组织中NF-κB的活性及其p65亚基蛋白水平、IL-8的组织定位及转录水平;以22例鼻中隔手术患者中鼻甲黏膜组织作为阴性对照(对照组);对NF-кB的活性及其p65亚基蛋白水平与IL-8的转录水平进行Pearson’s相关性分析。结果 EMSA测得鼻息肉组患者息肉组织中NF-κB的活性(216.51±17.33)较对照组(63.57±5.26)显著增高(P<0.01);Western Blot测得鼻息肉组 NF-κB亚基p65蛋白的水平(153.72±9.15)较对照组(73.92±6.74)显著增高(P<0.05);半定量RT-PCR测得IL-8mRNA的转录水平(0.95±0.08)也显著高于对照组(0.23±0.03)(P<0.05);Pearson’s相关性分析结果提示:鼻息肉组患者息肉组织中NF-κB的活性及其p65亚基蛋白水平与IL-8的转录水平呈显著正相关性(r值分别为0.78 &0.53,均P<0.01)。结论 IL-8是鼻息肉组织中NF-кB激活后所分泌的重要的炎性细胞因子,NF-кB和IL-8引起的局部微环境的改变可能是鼻息肉发病的重要因素。
鼻息肉;微环境;核因子-кB;IL-8;转录
鼻息肉(Nasal Polyps,NP)是一种病因未明的与多种病理状态相关的鼻腔黏膜的慢性炎症,是临床上常见病和多发病[1]。以前关于NP病因学的研究多集中于变应性因素[2],近来研究证实:NP为局部微环境控制的炎症性肿块,倾向于多因素作用的病因学说[3],其中炎症介质和细胞趋化因子在NP发病机制中的重要作用已得到广泛认可[4]。目前对NP发病机制中炎症介质和细胞趋化因子间的调控/表达关系尚不太清楚,许多研究认为细胞趋化因子的转录/表达一般会受其上游炎症介质NF-κB的调控[5],因此我们收集了2008年2月-2010年9月收住本院的部分行NP切除手术患者的息肉组织及鼻中隔手术患者中鼻甲黏膜组织的标本资料,拟通过检测NP组织及鼻中隔黏膜组织中NF-κB的活化对IL-8转录影响的差异,研究相关炎症介质和细胞趋化因子在NP发病过程中作用的可能机理,为临床探索新的NP治疗方法提供理论和实验依据。
材料和方法
1一般资料
1.1 标本来源、分组及处理
收集2008年2月-2010年9月期间收住本院的部分行NP切除手术患者的息肉组织标本47例,男31例,女16例,年龄19-62岁,均排除心、肺疾病及变应性鼻炎、支气管哮喘等变态反应病史,术前至少2周无上呼吸道感染病史及未应用类固醇激素及抗组胺药物治疗。同时收集我科同一时期因鼻中隔偏曲住院行鼻中隔手术患者中鼻甲黏膜组织标本22例作为阴性对照(对照组),男15例,女7例;年龄18-55岁,所有患者中鼻甲黏膜无明显炎性病变,变应原皮肤点刺试验均为阴性。
组织标本收集后迅速用生理盐水清洗、滤纸吸干水分,将样本切分成4份,其中一份用10%中性甲醛固定12h后行免疫组织化学观察;其余三份立即置于-80℃冰箱中冻存用以择日行凝胶电泳迁移实验(EMSA)、蛋白免疫印迹(Western Blot)及逆转录聚合酶链反应(RT-PCR)检测。
1.2 主要仪器及试剂
EMSA试剂盒(Promega 公司,美国),NF-κB亚基p65抗体(Santa Cruz,美国),ECL 检测试剂盒(Amersham 公司,美国),IL-8、β-actin的PCR引物(上海英骏公司);Trizol、Taq酶、dNTP、逆转录-PCR试剂盒(MBI公司,美国);DAB(AR1022)染色试剂盒(北京中杉金桥生物试剂公司)。DU650型紫外可见光光度计(Beckman公司,美国),恒压恒流DF-D电泳仪(北京东方特力科贸中心),半干式转膜仪170-3940及凝胶成像分析系统(Bio-Rad公司,美国),超薄石蜡切片机(德国Leika公司)。其他试剂为进口分装生物学级或国产分析纯试剂。
2检测方法及指标
2.1 EMSA检测 NF-κB的活性
准确称取-80℃冰箱中冻存的组织标本0.1g与液氮混合后碾碎,加入400μl细胞裂解液Buffer A混匀后置于冰上15min,加入10%NP-40摇床震荡15s,离心(12 000×g)10min,吸弃上清后加入50μl缓冲液,置于冰上20min,摇床震荡15s后于4℃离心(12 000×g)10min,吸取上清测定蛋白浓度达到实验标准后,吸取10μg核蛋白加入至15μl的结合反应Tris-EDTA缓冲液中,冰上反应20 min;将 NF-κB 寡核苷酸探针(具有与 NF-κB转录因子结合位点的双链寡核苷酸,其序列为:5′-TCAGAGGGGACTTTCCGAGAGG-3′;末 端 用 γ32PATP标记)用TE缓冲液稀释后取1μl加入反应液中与核蛋白共孵育30min,加入6%十二烷基磺酸钠在1×TBE缓冲液中恒压110V电泳3h,真空加热干燥后置于-70℃放射自显影48h,采用美国Bio-Rad公司凝胶图像分析仪进行灰度扫描定量分析。分析结果单位以(AU□mm)表示。
2.2 Western Blot检测NF-κB亚基p65蛋白水平
组织细胞核蛋白的提取及蛋白浓度测定同上;上样、转膜、封闭后一抗过夜,膜漂洗后二抗杂交,ECL化学发光法显影;分析仪同EMSA。
2.3 RT-PCR法检测IL-8mRNA的转录水平
Trizol一步法提取组织细胞总RNA后,按照半定量RT-PCR试剂盒步骤说明合成cDNA。内参照β-actin序列为:sense:5'-CCT AAGGCC AAC CGT AAA G -3'和 antisense:5'-TCT TCA TGG TGC TAG GAG CCT-3'(587bp)。IL-8引物序列为:sense5'-ACT GGG TGC AGA GGG TTG TG-3'和antisense5'-TTC TCC CGT GCA ATA TCT AGG A -3'(325bp)。PCR 扩 增 条 件:94 ℃ (1 min)、57℃(1min)、72℃(45s),30个循环,末次延伸为72℃(10min)。PCR产物经琼脂糖凝胶电泳后,采用美国Bio-Rad公司凝胶图像分析仪进行灰度扫描定量分析,以IL-8扩增条带吸收度值(DIL-8)与内参照β-actin扩增条带吸收度值(Dact)的比值(DIL-8/Dact)表示IL-8mRNA 的表达水平,单位以(AU·mm)表示。
信息传递方式的多样性,给民族音乐带来了无限的生机,使幼儿教育有着十分丰富的本土少数民族音乐的教学资源。所以,在幼儿园教学资源库的构建过程中,一定要将开放性原则贯彻到底,多方式、多类型、多渠道地去收集、整理民间音乐,对各种资源进行合理利用,有选择、有计划地将收集到的各种音乐资源纳入幼儿园音乐课程教育中,以此来丰富少数民族地区幼儿园的音乐教育资源,构建充分发扬民间传统音乐的平台,更好地传承民间传统音乐。
2.4 免疫组织化学法检测IL-8组织表达
按照链霉亲合素-生物素化过氧化酶复合物法(Strept Avidin-Biotin Complex,SABC)试剂盒说明书的染色步骤进行免疫组织化学染色:经10%甲醛固定后的组织标本经酒精脱水,石蜡包埋,切片(厚度约5μm)“脱蜡至水”后,微波修复抗原、血清封闭,滴加一抗后湿盒中过夜(4℃);阳性对照采用急性肺损伤组织标本,同样滴加一抗;阴性对照采用正常鼻甲黏膜组织标本石蜡切片,一抗用PBS替代。所有切片湿盒中过夜后PBS洗涤;滴加辣根过氧化物酶标记的二抗后放置20min(37℃),PBS再洗,DAB室温显色,镜下控制显色反应时间,苏木素复染、冲洗,切片脱水、透明、中性树胶封片。光镜下观察组织标本中IL-8表达情况。
阳性结果判断:细胞内呈棕黄色或褐色颗粒样着色为阳性表达;细胞不着色,或呈浅棕色的背景色为阴性表达。每例组织标本中选择最大密度的10个高倍视野光镜下观察照像,然后用JD109图像分析系统进行图像分析,测定阳性细胞数密度和灰度值(AU·mm)。
3 统计学处理
使用SPSS15.0软件对数据进行统计分析。计量资料采用(均数±标准差)来描述;两个样本组间均数差异显著性比较采用t检验;两变量间的相关性分析采用Pearson’s相关检验分析,以P<0.05为差异有统计学意义。
结 果
1.EMSA检测NF-κB活性的结果
和对照组比较,EMSA测得鼻息肉组NF-κB的活性(216.51±17.33)较对照组(63.57±5.26)显著增高(P<0.01)。见表1。

表1 二组标本中NF-κB活性及其p65亚基蛋白水平、IL-8mRNA转录水平的比较(¯x±s)Table 1 Comparison of NF-κB activity,p65protein level and transcription of IL-8mRNA(¯x±s)
2.Western Blot检测 NF-κB p65亚基蛋白水平的结果

图1 二组标本中NF-κB p65亚基蛋白水平比较Fig.1 Comparison of NF-κB p65protein levels in two groups
3.RT-PCR检测IL-8mRNA转录水平的结果
和对照组比较,半定量RT-PCR法测得鼻息肉组IL-8mRNA的转录水平(0.95±0.08)较对照组(0.23±0.03)显著增高(P<0.05)。见表1、图2。
Pearson’s相关性分析结果显示:鼻息肉组患者的息肉组织中NF-κB活性及其p65亚基蛋白水平与息肉组织局部IL-8mRNA的转录水平均呈显著正相关性(r值分别为0.78和0.53,均P<0.01)。
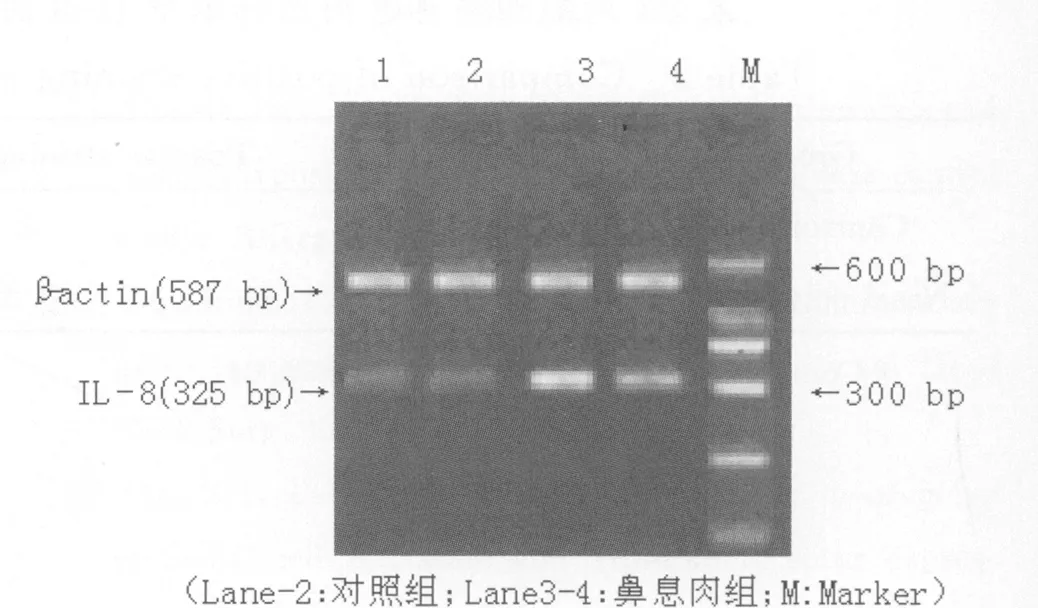
图2 二组标本中IL-8mRNA的转录水平比较Fig.2 Comparison of IL-8mRNA transcriptions in two groups
4.免疫组织化学法检测IL-8组织表达的结果
正常下鼻甲黏膜组织中基本无或少量弱阳性染色;在鼻息肉组息肉组织中可见大量IL-8的阳性染色,阳性染色呈棕黄色颗粒,且主要集中表达于息肉上皮层(见图3)。JD109图像分析软件分析结果显示:和对照组比较,鼻息肉组息肉组织中阳性染色面积百分比(0.87±0.09)和灰度值(176.52±26.41)较对照组(0.12±0.05和95.03±11.58)均显著增高(均P<0.05)。见表2。
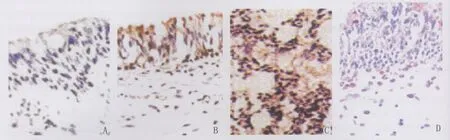
图3 免疫组织化学染色显示IL-8的表达A:下鼻甲黏膜组织中无IL-8的阳性染色(对照组)(SABC×400);B:息肉组织中IL-8的阳性染色(鼻息肉组)(SABC×400);C:急性肺损伤肺组织中IL-8的阳性染色(阳性对照)(SABC×400);D:正常下鼻甲黏膜组织中无IL-8的阳性染色(HE×400)Fig.3 Immunohistochemistry of the locations of IL-8Fig.A:No positive staining of IL-8in Inferior turbinate mucosa(SABC×400);Fig.B:Positive staining of IL-8in Nasal polyps tissue(SABC×400);Fig.C:Positive staining of IL-8in lung tissue of Acute lung injury(SABC×400);Fig.D:No positive staining of IL-8in Normal inferior turbinate mucosa(HE×400)

表2 对照组与鼻息肉组标本中IL-8的阳性染色面积百分比和灰度值比较(¯x±s)Table 2 Comparison of positive staining areas percentage and gray scales of IL-8(¯x±s)
讨 论
NP是一种病因未明的与多种病理状态相关的鼻腔黏膜的慢性炎症,是临床上的常见病和多发病[1]。成年人发病率为 2.11%-4%,复发率高达24-28%[6,7]。NP的病理组织学是以上皮增生、间质水肿、血管增生扩张、腺体增殖亢进为主要特征,同时伴有多种炎性细胞的浸润[8];其中以嗜酸性粒细胞浸润增多为病理特征的NP约占80-90%[4]。以前关于NP病因学的研究多集中于变应性因素[2],近来研究倾向于多因素多步骤作用的病因学说,认为NP是与多种病理状态相关的炎症过程的最终结果,多种病因、多种途径、多种介质及细胞因子参与了此病理过程[3]。
现已证明参与NP病理过程的炎症介质及细胞因子多达数十种,如 NF-κB、组胺(Histamine)、细胞趋化因子(Chemokine)、肿瘤坏死因子(TNF)、集落刺激因子子(ESF)、转化生长因子(TGF)等等,与淋巴细胞、肥大细胞、单核细胞、中性粒细胞、上皮细胞、成纤维细胞及嗜酸性粒细胞等相互作用并改变细胞表面粘附因子的表达;其中炎症介质和细胞趋化因子在NP发病机制中的重要作用已得到广泛认可[4],但目前对于NP发病机制中炎症介质和细胞趋化因子间的调控/表达关系尚不太清楚。
有研究认为IL-8是体内/外粒细胞的重要趋化因子,能延长嗜酸性粒细胞的存活时间,促使其释放嗜酸性过氧化物酶等[4];同时对中性粒细胞具有强烈的趋化作用,能促使中性粒细胞脱颗粒及释放超氧化物,并刺激花生四烯酸代谢产物(leukotriene)生成,从而导致机体局部炎症反应;还可以趋化嗜碱性粒细胞,并刺激其释放组胺[8]。在NP的发病过程中,IL-8可以促进中性粒细胞的组织浸润和新生血管的生成,该现象是NP的重要特征之一;而且IL-8在动员嗜酸性细胞由周围血管迁移至局部组织的进程中发挥了关键作用[4]。嗜酸性细胞在激活状态下积聚且导致鼻粘膜病理改变是NP形成的基本病理生理过程。有学者应用免疫组化和放射免疫技术探测了NP中IL-8的水平和分布,结果显示:在所有NP组织内的炎性细胞和上皮细胞中均可检测到IL-8的表达,且IL-8表达水平与炎性细胞水平呈显著正相关,同时,IL-8作为嗜酸性粒细胞的趋化因子,也与NP组织内嗜酸性粒细胞的水平呈剂量依赖性。这一结果提示:IL-8在NP的发病过程中发挥着重要作用;而且息肉组织内局部产生的IL-8又可以直接作用于鼻粘膜,加重了鼻粘膜的损伤,促进了 NP的发展[9]。
而由p50/p65构成的异源二聚体NF-κB是调节细胞基因转录的关键因子之一,NF-κB活化后,p65亚基能够转位进入细胞核,调控多种致炎因子的表达,具有广泛的生物活性,在机体的免疫应答、炎症反应及细胞生长等方面发挥重要作用;它不但在T淋巴细胞和B淋巴细胞的发育、免疫细胞的活化、应激性反应的发生等多种细胞活动中起关键作用,同时对参与放大与延续炎症反应的多种酶的基因表达也具有重要的调控作用,NF-κB的激活、p65亚基转位入核及调节炎症因子的转录是启动和维持炎症信号级联放大效应的关键环节[10]。许多研究认为细胞趋化因子的转录/表达一般会受其上游炎症介质 NF-κB 的调控[5],Takeno等[11]应用荧光免疫组化及RT-PCR技术对NP发病机制中NF-κB和IL-8间的调控/表达关系进行了定性研究,研究发现:NP上皮细胞中NF-κB的激活与IL-8的表达水平显著相关,且后者能够强烈趋化嗜酸性粒细胞。因而我们分别应用凝胶电泳迁移实验法及蛋白免疫印迹法测定NF-κB的活性及p65亚基的水平来反映NF-κB的激活程度;同时应用免疫组织化学法及逆转录聚合酶链反应法检测了IL-8的组织定位及转录水平。Takeno等[11]的研究结果与我们的试验结果相符;而且Shin等[12]用ELISA法检测了NP组织匀浆中IL-8水平,发现NP组织匀浆中IL-8水平明显高于正常组。Sachse等[13]研究发现:变应性和非变应性NP患者IL-8表达水平较正常组显著增高,因此认为以NF-κB调控下的IL-8长期高表达状态为代表的感染理论,相比以IL-4为代表的变态反应理论更有可能成为NP发病的原因。
总之,NP的发生、发展是一个复杂的多因素过程,其中炎症介质和细胞趋化因子在NP发病机制中的重要作用已得到广泛认可:炎症介质和细胞趋化因子一方面能调节NP组织微环境中的中性粒细胞及一些组织细胞如上皮细胞、成纤维细胞的功能;另一方面可以趋化、激活NP组织微环境中的嗜酸/碱性粒细胞,促进其自身分泌;同时可抑制嗜酸性粒细胞的凋亡,延长嗜酸性粒细胞的生存时间。它们在NP发病机制中构成了一个立体的网络,相互影响并相互制约,目前对它们之间的调控/表达关系尚不太清楚,本研究结果提示:IL-8是NP组织中NF-κB激活后所分泌的重要的炎性细胞因子,NF-κB调控下的IL-8长期高表达状态引起的局部微环境的改变可能是NP发病的重要因素。同时它们之间调控所涉及的信号转导机制等还有待进一步的研究。
[1]Klossek JM,Neukirch F,Pribil C,et al.Prevalence of nasal polyposis in France:a cross-sectional,case-control study.Allergy,2005,60(2):233-237
[2]Figueiredo CR,Silva ID,Weckx LL.Inflammatory genes in nasal polyposis.Curr Opin Otolaryngol Head Neck Surg,2008,16(1):18-21
[3]Shin SH,Lee YH.Airborne fungi induce nasal polyp epithelial cell activation and Toll-like receptor expression.Int Arch Allergy Immunol,2010,153(1):46-52
[4]Shin SH,Lee YH,Jeon CH.Protease-dependent activation of nasal polyp epithelial cells by airborne fungi leads to migration of eosinophils and neutrophils.Acta Otolaryngol,2006,126(12):1286-1294
[5]Rudack C,Steinhoff M,Mooren F,et al.PAR-2activation regulates IL-8and GRO-alpha synthesis by NF-kappaB,but not RANTES,IL-6,eotaxin or TARC expression in nasal epithelium.Clin Exp Allergy,2007,37(7):1009-1022
[6]Bachert C,Watelet JB,Gevaert P,et al.Pharmacological management of nasal polyposis.Drugs,2005,65(11):1537-1552
[7]Albu S,Tomescu E,Mexca Z,et al.Recurrence rates in endonasal surgery for polyposis.Acta Otorhinolaryn-gol Belg,2004,58(1):79-86
[8]Lin CF,Tsai CH,Cheng CH,et al.Expression of Toll-like receptors in cultured nasal epithelial cells.Acta Otolaryngol,2007,127(4):395-402
[9]Ohkuni T,Kojima T,Ogasawara N,etal.Poly(I:C)reduces expression of JAM-A and induces secretion of IL-8and TNF-αvia distinct NF-κB pathways in human nasal epithelial cells.Toxicol Appl Pharmacol,2011,250(1):29-38
[10]Mantovani A,Allavena P,Sica A,et al.Cancer related inflammation.Nature,2008,454(7203):436-444
[11]Takeno S,Hirakawa K,Ueda T,et al.Nuclear factor-κB activation in the nasal polyp epithelium:relationship to local cytokine gene expression.Laryngoscope,2002,112(1):53-58
[12]Shin SH,Ye MK.Effects of topical amphotericin B on expression of cytokines in nasal polyps.Acta Otolaryngol,2004,134(10):1174-1177
[13]Sachse F,von Eiff C,Becker K,et al.Proinflammatory impact of Staphylococcus epidermidis on the nasal epithelium quantified by IL-8and GRO-alpha responses in primary human nasal epithelial cells.Int Arch Allergy Immunol,2008,145(1):24-32
Effects of NF-кB activation on the transcription of IL-8 in human nasal polyps
Peng Qing,Jian Lei,Fang Xiangdong,Cai Changxue1*
(Department of Otolaryngology,Wuhan Commercial Staff Hospital,Hubei 430021;1Department of Pathogen Biology,Basic Medical School of Tongji medical college,Huazhong University of Science and Technology,Wuhan 430030,China)
ObjectiveTo investigate the effects of NF-кB activation on transcription of IL-8in the tissues of nasal polyps.MethodsThe specimens from 47nasal polyps(nasal polyp group)and 22nasal septum mucous membranes(control group)were studied by electro-phoretic mobility shift assay(EMSA)for the activation of NF-кB,by Western Blot for the protein level of NF-кB p65subunit,by reverse-transcription polymerase chain reaction(RT-PCR)for the transcriptions of IL-8mRNA and by immunohistochemistry for the location of IL-8.The correlations among the activation of NF-кB,the protein level of NF-кB p65 subunit and the transcriptions of IL-8mRNA were evaluated by Pearson correlation analysis.ResultsThe activation of NF-кB and the protein level of NF-кB p65subunit were significantly increased in the tissues of nasal polyps compared those of the coutrols(P<0.01 & P<0.05).The transcription of IL-8mRNA was significantly increased in nasal polyps than that in the control group(P<0.05).The Pearson correlation analysis demonstrated that there were positive relationship between the activations of NF-кB and the transcription of IL-8(r=0.78)and between the protein levels of NF-кB p65subunit and the transcriptions of IL-8(r=0.53,all P<0.01).ConclusionThese results suggest that IL-8regulated by NF-кB may be a key cytokine in nasal polyps.The changes in the microenvironment caused by NF-кB and IL-8may play an important role in the mechanisms for the pathogenesis of nasal polyps.
Nasal polyps;Microenvironment;NF-кB;IL-8;Transcription
R329
A
10.3870/zgzzhx.2012.01.014
2011-10-10
2011-12-01
彭庆,女(1969年),汉族,主治医师
*通讯作者(To whom correspondence should be addressed)

