全反式维甲酸体外诱导P19细胞向心肌方向分化
张金平 王慧娟 赵 昱 王立轩 张亚楠 李 航 张 雷
全反式维甲酸体外诱导P19细胞向心肌方向分化
张金平 王慧娟 赵 昱 王立轩 张亚楠 李 航 张 雷*
(河北医科大学组织胚胎学教研室,石家庄050017)
目的 探讨不同浓度全反式维甲酸(all-trans retinoic acid,atRA)诱导P19细胞向心肌分化的效力。方法 细胞分成P19细胞组,2nm/L atRA诱导组,5nm/L atRA诱导组,8nm/L atRA诱导组。各组细胞经过诱导、聚集培养、聚集体贴壁培养10天后,RT-PCR 检测 GATA-4,α-肌球蛋白重链(α-myosin heavychain,α-MHC)的 mRNA 表达,免疫荧光双标检测α-sarcomeric actin和cTnT蛋白共表达,Western blot检测cTnT的蛋白表达。结果 atRA可诱导聚集P19细胞表达GATA-4、a-MHC mRNA;α-sarcomeric actin和cTnT的表达和共表达增加;5nm/L atRA 组,8nm/L atRA 组 GATA-4、a-MHC mRNA的表达量显著高于P19细胞组;5nm/L atRA组,8nm/L atRA组两种蛋白的表达和共表达量显著高于P19细胞组,以5nm/L atRA组最高,显著高于其它组。结论 atRA可诱导聚集P19细胞向心肌分化,其中5nm/L atRA组效果最好。
全反式维甲酸;P19细胞;心肌细胞
P19 胚 胎 癌 细 胞 (P19embryonal carcinoma cells,EC)是从C3H/He雄性小鼠畸胎瘤中分离得到一种能够在体外培养的多能干细胞,P19细胞体外经多次传代仍保持胚胎干细胞的特性。P19EC细胞经诱导可分化为包括心肌在内的多种细胞,是研究心肌细胞发育的良好体外模型[1]。
在P19细胞向心肌分化的研究中,最常用的方法就是利用二甲基亚砜(dimethyl sulfoxide,DMSO)和5-氮杂胞苷(5-azacytidine,5-aza)对 P19细胞进行诱导联合聚集培养[2],但DMSO和5-aza对细胞都具有一定的毒性,在一定程度上限制了药物诱导在细胞移植中的治疗。且其诱导胚胎干细胞心肌分化过程中伴随细胞凋亡发生[3]。因此有必要探索合适的诱导剂和诱导体系。atRA属于一种具有多种生物学效应的亲脂性维生素A的衍生物,其在个体发育、细胞分化和维持体内平衡中发挥广泛的效应,它可以调节许多细胞的增生、分化和凋亡[4]。因此本实验拟用atRA诱导P19细胞向心肌分化,探讨其诱导P19细胞向心肌分化的效力,为心肌组织工程研究和干细胞移植治疗心肌梗死提供理论基础。
材料和方法
1.材料
P19细胞系(ATCC,CRT 1825)购自中国协和医科大学细胞中心。atRA,DMSO、溴化乙啶、DEPC(Sigma公司)。一步法 RT-PCR试剂盒、TRIzol、引物(北京赛百盛公司),100bp DNA ladder(北京天根试剂公司)。α-MEM培养基干粉、G418(invitrogen公司)。胎牛血清(杭州四季青生物工程材料有限公司)。鼠抗α-sarcomeric actin单克隆抗体、生物素标记的羊抗鼠二抗IgG、avidin-Cy3标记三抗和FITC标记羊抗鼠二抗(武汉博士德生物公司),免疫荧光用鼠抗cTnT单克隆抗体(美国NeoMarkers公司),Western blot用鼠抗cTnT单克隆抗体(美国Santa Cruz公司)。
2.方法
2.1 atRA 的配置
避光、棕色灯光下,RA用DMSO溶解,调节储存液的浓度为1μm/L,小份分装,-20℃保存。
2.2 实验分组
实验分为P19细胞组(p19G),2nm/L atRA 诱导组(2nmG),5nm/L atRA 诱导组(5nmG),8nm/L atRA 诱导组(8nmG)。
2.3 细胞培养,聚集和诱导
P19细胞用α-MEM生长培养基(配制:α-MEM培养液含100ml/L胎牛血清、青霉素1万U/L、链霉素 100mg/L,pH 7.2-7.4),于 50ml/L CO2,37℃条件下培养,2d传代。取对数生长期的细胞、传代,调节细胞密度为106个/ml,分别用含2nm/L atRA,5nm/L atRA 和8nm/L atRA 的培养基(每毫升生长培养基分别加入2μL,5μL,8μL atRA 储存液),接种于铺有0.5%琼脂的培养皿中聚集培养4d。P19细胞组直接细胞聚集培养4d,不加诱导剂。将形成细胞聚集体接种于放有盖玻片的6孔培养板中,用不含atRA的生长培养基继续培养10d。
2.4 免疫荧光双标检测 α-sarcomeric actin和cTnT的共表达
聚集体贴壁培养10d的细胞玻片,4%多聚甲醛固定,3%甲醇-H2O2室温孵育10min,室温1%Triton透化处理30min。以10% 正常山羊血清封闭,37℃ 30min。滴加鼠α-sarcomeric actin抗体(1∶100稀释)4℃冰箱过夜。滴加生物素标记的二抗IgG工作液孵育,37℃,45min。滴加avidin-Cy3标记三抗(1∶50稀释,红色荧光)37℃30min。滴加鼠cTnT抗体(1∶100稀释)4℃冰箱过夜。滴加TITC标记的二抗孵育(1∶50稀释,绿色荧光),37℃45min。甘油封片,避光4℃保存。PBS代替一抗做阴性对照。Leica TCS-SP2激光共聚焦扫描显微镜观察并照相。每组取5张切片,每张切片取10个高倍视野,采用图像分析软件Image-pro Plus 6.0分析积分光密度值(IOD),以平均值做为最终结果。
2.5 Western blot检测cTnT的表达
聚集体贴壁培养10天的细胞,提取细胞总蛋白,考马斯亮蓝试剂盒定量。以50μg/孔的上样量进行5%浓缩胶及10%分离胶的SDSPAGE凝胶电泳后电转移至PVDF膜;转膜后,5%脱脂奶粉室温封闭1h,然后用相应抗体杂交,滴加ECL发光试剂,在暗室中压片,显影,定影。BIO-1D软件对电泳条带进行定量分析。读取积分光密度值(IOD),以内参条带的IOD值作校正,进行统计分析。
2.6 RT-PCR 检测
聚集体贴壁培养10d的细胞,Trizol一步法提取细胞总RNA,采用一步法RT-PCR,先在逆转录酶下(AMV)合成cDNA,随即进行PCR扩增。GATA-4 引 物:sense 5`-TAGCAGGCAGAAAGCAAGG -3`antisense 5`-AGCACGAGGCAGACAA -3`,扩 增 产 物 长 度:392bp。;α-MHC 引 物:sense 5` -CCTGGGCAAGTCTAACAA -3`-antisense 5`-ACAAAGTGAGGGTGGGTG-3`,扩增产物长度:345bp。;β-actin引物:Sense:5`-CACGATGGAGGGGCCGGACTCATC -3` Antisense:5’-TAAAGACCTCTATGCCAACACAGT-3’扩增产物长度:240bp。逆转录和扩增体系:总RNA2μl,10× 缓 冲 液 2μl,25U/μL AMV 0.2μl,10mmol/LdNTPs 1μl,10pmol/L正义引物1μl,10pmol/L反义引 物 1μl,5U/μL U-Taq 多 聚 酶 1μl,40U/μL Rnasin 0.25μl,DEPC 水至20μl。逆转录反应条件:45℃30min。PCR扩增条件:94℃5min;94℃30s,53℃(GATA4)/54℃(α-MHC)/57℃(β-actin),45s,72℃ 90s,32个循环;72℃ 7min。PCR 产物1%琼脂糖凝胶电泳。以β-actin作为内参照校正,用BIO-1D软件对电泳条带进行定量分析。
3.统计学处理
所有数据均用(¯x±s)表示,采用SPSS 13.0统计软件进行统计,组内比较采用单因素方差分析,当方差分析有显著性差异时进一步用q检验做两两比较。
结 果
1.细胞培养
P19细胞在传代次日,细胞贴壁良好,达到40%-50%的汇合。传代隔日,细胞长满瓶底的80%-90%,细胞多突起,相互连接(图1)。细胞经聚集培养形成聚集体,聚集2d时,聚集体较小,4d时,聚集体积增大,中心细胞密集体积小。各处理组之间聚集体的形成时间和大小类似。图2为5nm/L atRA组形成的细胞聚集体。聚集体贴壁培养后,聚集体周边形成生长晕,细胞从晕中爬出并单层生长,细胞体积增大、变长,呈梭形,伸出突起(图3A,3B)。
图1 传代第二天的P19细胞 标尺=25μmFig.1 P19cells,two days after passage.Bar=25μm
2.GATA-4和α-MHC mRNA 表达
P19细胞组没有两种基因的表达,2nm/L atRA组,5nm/L atRA 组,8nm/L atRA 组均有两种基因的表达(图4),统计结果显示,GATA-4mRNA的相对表达量:P19细胞组(0.000±0.000),2nm/L atRA 组 (0.192±0.095),5nm/L atRA 组(0.330±0.145),8nm/L atRA 组 (0.186±0.114),5nm/L atRA 组最高,8nm/L atRA 组次之,5nm/L atRA 组,8nm/L atRA 组与P19细胞组相比有显著差异(P<0.01,P<0.05),其他各组之间没有显著差异;α-MHC mRNA相对表达量:P19细胞组(0.000±0.000),2nm/L atRA组(0.116±0.060),5nm/L atRA组 (0.173±0.031),8nm/L atRA 组 (0.217±0.122),α-MHC基因在8nm/L atRA 组表达量最高,5nm/L atRA组次之,5nm/L atRA 组、8nm/L atRA 组与P19细胞组比有显著差异(P<0.05,P<0.01),其他各组之间没有显著差异。
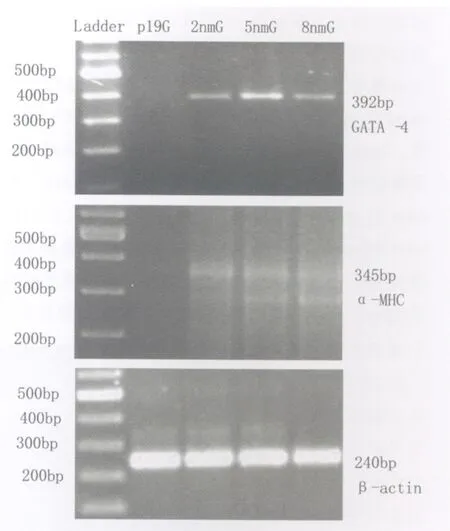
图4 RT-PCR检测 GATA-4和α-MHC mRNA 表达Fig.4 The expresssion of GATA-4andα-MHC mRNA was decteded with RT-PCR.
3.α-sarcomeric actin和cTnT的蛋白表达和共表达检测
免疫荧光双标检测可见:α-sarcomeric actin(红色)和cTnT(绿色)两种蛋白都表达于胞浆,两种蛋白共表达处荧光融合呈现黄色荧光。P19细胞组和阴性对照组荧光强度弱,且统计结果分析没有显著差异,合并为对照组(CG)。2nm/L atRA 组,5nm/L atRA 组,8nm/L atRA 组荧光强度增强,且有明显的细胞轮廓,胞浆中有黄色束丝样结构,尤以5nm/L atRA组最为明显(图5)。采用图像分析软件Image-pro Plus6.0 分析荧光区域IOD 值。αsarcomeric actin蛋白表达IOD值:对照组(1628.77± 700.95), 2nm/L atRA 组 (16274.04 ±6957.80),5nm/L atRA组(181664.52±82172.55),8nm/L atRA组(40089.87±11224.73);cTnT蛋白表达IOD值:对照组(1716.93±1147.25),2nm/L atRA 组 (17784.95±7923.81),5nm/L atRA 组(85046.89 ± 28567.96), 8nm/L atRA 组(35897.06±13952.38)。共表达IOD 值:对照组(1028.32±562.49),2nm/L atRA 组(15368.52±4362.52), 5nm/L atRA 组 (81657.06 ±31103.14), 8nm/L atRA 组 (31642.43 ±15017.05)
两种蛋白表达量和共表达量由高到低依次为5nm/L atRA 组、8nm/L atRA 、2nm/L atRA、对照组。5nm/L atRA 组,8nm/L atRA 组显著高于对照组(P<0.01);5nm/L atRA 组、8nm/L atRA 和2nm/L atRA 组之 间均有 显著差异 (P<0.01)。5nm/L atRA 组与8nm/L atRA组之间也有显著差异(P<0.01)。8nm/L atRA 和2nm/L atRA 组以及2nm/L atRA组和对照组之间没有显著差异。Western blot结果显示cTnT蛋白表达相对量:2nm/L atRA 组(0.110±0.033),5nm/L atRA 组(0.502 ±0.129),8nm/L atRA 组 (0.192±0.130),P19细胞组(0.022±0.028)。5nm/L atRA组最高,8nm/L atRA次之;5nm/L atRA 组与其他组之间有显著差异(P<0.01),其他各组之间没有显著差异(图6)。
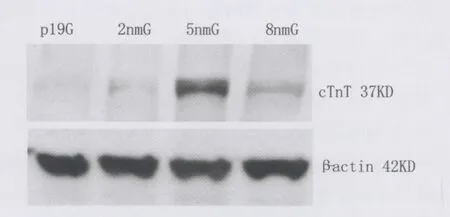
图6 Western blot检测cTnT蛋白表达Fig.6 The expresssion of cTnT protein was detected with Western blot.

图2 5nm/L atRA组形成的细胞聚集体 A.聚集2d,B.聚集4d 标尺=50μm图3 5nm/L atRA组细胞聚集体贴壁10d后形成的单层生长细胞 A标尺=100μm,B标尺=50μm图5 免疫荧光双标检测α-sarcomeric actin和cTnT两种蛋白的共表达.A 对照组,B 2nm/L atRA 组,C 5nm/L atRA 组,D 8nm/L atRA 组,标尺=20μmFig.2 The formed cell aggregations of 5nm/L atRA group.A.aggregated for two days.B.aggregated for four days.Bar=50μmFig.3 The peripheral monolayer cells around the aggregations after adhere culture for 10days.A Bar=100μm,B Bar=50μmFig.5 The co-expression ofα-sarcomeric actin and cTnT was detected with double immunofluorescent staining.ACG,B 2nm G,C 5nm G,D 8nm G Bar=20μm
讨 论
atRA是维生素A的活性代谢产物,维甲酸(retinoic acid,RA)信号途径在胚胎发生过程和成熟细胞表型的维持方面起到重要作用,P19细胞是探索维甲酸化学作用原理的合适体外模型[5]。研究表明,在高浓度的 RA(0.1-1μm/L )的作用下,P19细胞向神经细胞及神经胶质细胞分化,而在低浓度的RA(1-10nm/L)诱导下 P19细胞向肌细胞方向分化[6],但是关于RA诱导P19细胞心肌分化的合适体系国内外文献并没有报道。因此本实验采用2nm/L atRA 组,5nm/L atRA 组,8nm/L atRA组三个浓度进行诱导,并做单纯P19细胞培养组做对照。
GATA-4是与心脏发育密切相关的锌指转录因子,也是心脏前体细胞的最早标志物之一,GATA-4的基因表达可在一定程度上反映胚胎干细胞向心肌细胞分化的情况,是监测心肌细胞分化的可靠指标[7]。α-MHC是心肌特异基因,编码重要的心肌结构蛋白,是心肌细胞的重要标志物[8]。本实验结果表明atRA诱导结合聚集培养使P19细胞表达GATA-4和α-MHC基因,而P19细胞单纯聚集培养没有两种基因的表达。5nm/L atRA组,8nm/L atRA组两种基因的表达显著高于P19细胞组。说明5nm/L atRA 诱导组和8nm/L atRA 诱导组诱导效率较好。
α-sarcomeric actin特异表达在横纹肌,属细胞骨架蛋白,是一种分布于肌节Z线处的肌动蛋白。cTnT是心肌肌钙蛋白中具有较高特异性的亚型,只在心肌细胞表达,是鉴定心肌源性细胞的特异性标志物[9]。本实验中免疫荧光双标检测发现:经at-RA诱导后部分细胞出现两种蛋白的表达和共表达。实验中发现5nm/L atRA组两种蛋白表达和共表达量最高,诱导效果最好,8nm/L atRA组诱导效率仅次于5nm/L atRA 组。Western blot检测cTnT蛋白相对表达结果趋势同免疫荧光结果。本实验免疫荧光双标检测中对照组和Western blot结果中P19细胞组都有两种蛋白的微量表达,而RTPCR检测并没有GATA-4和α-MHC的mRNA表达,推测该结果可能与抗体的非特异显色有关或者P19细胞单纯聚集培养也有少量细胞向心肌分化有关[1]。综合以上结果表明atRA可以诱导聚集培养的P19细胞分化为心肌样细胞,在所设浓度中5nm/L atRA组诱导效果最好。
atRA经典的作用途径是通过核受体杂合(RAR/RXR)、DNA结合以及维甲酸受体反应元件启动来调控靶基因的表达从而发挥其生物学作用[4,5]。由于不同的诱导条件可能会启动不同的调控基因,因此导致可细胞的不同方向分化。有研究表明atRA可以调控同源框基因的表达参与细胞分化。本实验没有检测心肌相关同源框基因Nkx2.5的表达。因此此过程中是否涉及到同源框基因的参与以及参与机制尚需进一步证明。atRA是维生素A的活性代谢产物,毒性作用小,但是存在诱导分化效率低的缺点,本实验atRA诱导没有观察到出现搏动的心肌细胞,可能与atRA诱导分化效率较低相关。为细胞移植治疗考虑,诱导细胞在细胞移植之前详细特征和诱导剂对受体心脏的影响可能更有助于对其治疗效力的理解和评价。现有资料表明:atRA可减少机体内氧化应激水平,从而最终减少心肌凋亡和减轻心肌组织氧化损伤,对早期左心室重构起积极作用[10]。因此维甲酸虽然心肌诱导效率较低,但鉴于其于心脏的多方面积极作用,很可能成为细胞移植治疗心脏疾患的候选诱导剂,但是其诱导产生的心肌细胞的详细生理特征还需进一步研究。
[1]van der Heyden MA,Defize LH.Twenty one years of P19cells:what an embryonal carcinoma cell line taught us about cardiomyocyte differentiation.Cardiovasc Res,2003,58(2):292-302
[2]Jasmin,Spray DC,Campos de Carvalho AC,et al.Chemical induction of cardiac differentiation in p19embryonal carcinoma stem cells.Stem Cells Dev,2010,19(3):403-412
[3]王秀丽,王常勇,虞星炬,等 .二甲基亚砜诱导胚胎干细胞分化伴随凋亡发生 .解剖学杂志,2005,28(6):609-614
[4]Wolf G.Retinoic acid as cause of cell proliferation or cell growt hinhibition depending on activation of one of two different nuclear receptors.Nutr Rev,2008,66(1):55-59
[5]Chen Y,Reese DH.The retinol signaling pathway in mouse pluripotent P19cells.J Cell Biochem,2011,112(10):2865-2872.
[6]Habara-Ohkubo A.Differentiation of beating cardiac muscle cells from a derivative of P19embryonal carcino-ma cells.Cell Struct Funct,1996,21(2):101-110
[7]Fang Xiang,Ding Jiandong.Transcription FactorsNkx2.5and GATA-4in Heart Development.Medical Recapitulate,2009,15(22):3366-3369
[8]Gulick J,Subramaniam A,Neumann J,et al.Isolation and characterization of the mouse cardiac myosin heavy chain genes.J Biol Chem,1991,266(14):9180-9185
[9]Zhang X,Zhang CS,Liu YC,et al.Isolation,culture and characterization of cardiac progenitor cells derived from human embryonic heart tubes.Cells Tissues Organs.2009,190(4):194-208
[10]Oliveira LC,Azevedo PS,Minicucci ME,et al.Retinoic acid prevents ventricular remodelling induced by tobacco smoke exposure in rats.Acta Cardiol,2011,66(1):3-7
Differentiation of cardiomyocytes from P19cells induced byall-trans retinoic acid in vitro
Zhang Jinping,Wang Huijuan,Zhao Yu,Wang Lixuan,Zhang Yanan,Li Hang,Zhang Lei*
(Department of Histology and Embryology ,Hebei Medical University,Shijiazhuang050017,China)
ObjectiveTo investigate the efficiency of P19cell differentiation into cardiomyocytes induced by different concentrations of all-trans retinoic acid(atRA).MethodsP19cells were divided into 4 groups:P19cell group,2nm/L atRA group,5nm/L atRA group and 8nm/L atRA group.The cells were cultured and induced by different concentrations of atRA respectively,then aggregation cultured,and the formed aggregates were adherently cultured for 10days.The expressions of GATA-4,a-myosin heavychain (a-MHC)mRNA were detected with RT-PCR.Double immunofluorescent staining was used to detect the co-expression ofα-sarcomeric actin and cTnT protein and Western Blot was used to detect the expression of cTnT protein.ResultsP19cells be differentiated towards cardiomyocytes,expressing GATA-4and a--MHC mRNA and co-expressingα-sarcomeric actin and cTnT protein,induced by both atRA treatment and aggregation culture.The expression of GATA-4and a-MHC mRNA in 5nm/L atRA group 8nm/L atRA groups were significantly higher than that in the P19cell group.Compared with that of the P19cell group,the expression and co-expression of the two proteins were significantly increased in 5nm/L atRA and 8nm/L atRA groups.The highest protein expression was in the 5nm/L atRA group,which was significantly higher than in the other groups.ConclusionP19cells can be differentiated towards cardiomyocytes induced by atRA treatment together with aggregation culture.Among all the groups,the best induction concentration of atRA is 5nm/L.
All-trans retinoic acid(atRA);P19cell;Cardiomyocyte
R654
A
10.3870/zgzzhx.2012.01.009
2011-08-15
2011-11-30
河北省科技支撑项目(07275555,11276162);河北省卫生厅科技研究计划(20110277)
张金平,女(1974年),汉族,副教授。
*通讯作者(To whom correspondence should be addressed)

