不同种类大豆中大豆异黄酮含量及抗氧化性比较
刘 琴, 朱媛媛, 白兴梁
(1.南京财经大学食品科学与工程学院,江苏南京 210046;2.江苏省粮油品质控制及深加工技术重点实验室,江苏南京 210046)
不同种类大豆中大豆异黄酮含量及抗氧化性比较
刘 琴1,2, 朱媛媛1, 白兴梁1
(1.南京财经大学食品科学与工程学院,江苏南京 210046;2.江苏省粮油品质控制及深加工技术重点实验室,江苏南京 210046)
利用液质联用及串联质谱法对黑豆、黄豆及青豆等8个大豆样品进行了大豆异黄酮分析,结果表明:染料木甙(G)及丙二酰基染料木甙(MG)在8个大豆样品中均为主要的大豆异黄酮组分,两者之和平均占到了大豆异黄酮总含量的50%以上;其次为大豆甙(D)和丙二酰基大豆甙(MD),两者之和平均占大豆异黄酮总含量的38%左右;黄豆黄甙(GL)和丙二酰基黄豆黄甙(MGL)则在所有样品中含量均很低,两者之和平均只占总含量的6.8%.这8个样品中,对大粒种样品,黄豆中的大豆异黄酮含量高于黑豆及青豆,而小粒种大豆的异黄酮含量要明显高于大粒种.DPPH和FRAP抗氧化性分析结果则表明,黑豆的抗氧化性高于黄豆及青豆,而小粒种豆的抗氧化性高于大粒种豆.
大豆;异黄酮;液质联用;抗氧化性
我国大豆资源丰富,种类繁多,按照颜色主要分为黄豆、黑豆及青豆,按照季节主要分为春大豆、夏大豆及冬大豆,按照大豆颗粒重量可以分为大粒种、中粒种及小粒种.资料显示,我国共有2 800余种大豆分布于27个不同地区.大豆中除含有丰富的蛋白质等营养物质外,其中独特的大豆异黄酮的抗氧化[1-2]、抗胆固醇[3]、抗高血脂[4-5]等多种生物活性,具有预防慢性非传染性疾病如心血管病[6]、糖尿病[7-8]及癌症[9]等的功能,同时还有雌激素活性,可用于防治骨质疏松、缓解更年期综合症[10],因此大豆除了作为油料作物外,也是中国乃至亚洲国家广受欢迎的传统食材.不同种类大豆中异黄酮的含量也显著不同[11-12].为培育出高大豆异黄酮含量的品种,我国也对不同地区和不同基因品种大豆异黄酮含量做了大量的分析,如袁凤杰等[13]对我国不同地区的大豆核心种质异黄酮含量进行了分析,而张应等[14]报道了重庆地区96份野生大豆和102份地方品种的大豆样品蛋白质含量、脂肪含量及大豆异黄酮含量;杨雪峰等[15]对黑龙江省的150份野生大豆中的蛋白质、脂肪含量与异黄酮含量的相关性进行了研究.尽管研究中所选取的大豆品种样本很多,然而对消费者来说,在购买大豆食材的时候一般只能从大豆的外观、大小、产地来判断,很难获得大豆品种的信息.本研究从大豆种类的大类选取样本,比较分析了黄豆、黑豆、青豆不同种类及不同籽粒大小、不同种皮种仁颜色的大豆中大豆异黄酮含量,以及这些大豆的抗氧化性,拟为消费者根据需要选择大豆食材提供参考.
1 材料与方法
1.1 材料
大豆原料:丹波黑豆、青仁乌豆、黄仁乌豆、单青豆、双青豆、小粒种黑豆、小粒种黄豆、大粒种黄豆于2011年5月购自山东省鱼台县益群农副产品贸易有限公司,其中小黄豆、小黑豆为小粒种,其余为大粒种.
Trolox(水溶性维生素 E)、1,1-二苯基-2-苦肼基(DPPH 自由基)、2,4,6-三(2’-吡啶基)-1,3,5-三嗪(TPTZ)、染料木甙、甲醇(色谱纯)购于Sigma-Aldrich公司;染料木素、大豆甙元、黄豆黄素、大豆甙、黄豆黄甙购于阿拉丁试剂公司;其他试剂均为分析纯.
1.2 仪器
Mill-Q Academic超纯水系统,美国Mill Pore公司;FW-100型高速万能粉碎机,天津市华鑫仪器厂;Anke GL-2013型低温高速冷冻离心机,上海安亭科学仪器厂;TGL-16A型高速台式离心机,江苏金坛市环宇科学仪器厂;1100 HPLC/MS(SL)型带自动进样器的高效液相色谱与质谱联用仪,美国Agilent公司;Zorbax SB-C18型反相色谱柱(4.6 mm ×250 mm,5 μm),美国 Agilent公司.
1.3 方法
1.3.1 样品处理
将不同品种大豆预粉碎,再以石油醚(30~60℃)为溶剂用索氏提油装置经48 h抽提脱油,在室温下晾干除去溶剂后再次粉碎,并过40目筛,得到不同品种大豆的豆粕.
大豆含油率的测定采用 GB5512—1985中索氏抽提法,大豆蛋白质的测定采用 GB5511—1985中凯氏定氮法[16-17].
1.3.2 大豆异黄酮的提取
准确称取1 g不同品种大豆的豆粕,按照料液比1∶30,温度70℃,乙醇体积分数70%,提取时间3 h,进行大豆异黄酮的热回流提取.将提取液离心后取上层清液,用0.45 μm微孔滤膜过滤,储存在-20℃留待分析.每个样品进行3次平行提取,之后的分析取3个平行提取液测定的平均值.
1.3.3 大豆异黄酮组分鉴定
大豆异黄酮提取物中组分的鉴定是根据液相洗脱过程中流出峰的紫外特征吸收,对应的质谱峰及各组分二级质谱所得碎片峰进行鉴定的.具体液质联用及串联质谱实验方法如下.
将10 μL的提取液由自动进样器进样,经HPLC分离后导入质谱分析仪进行分析,以含0.1%HAc的水为流动相A,含0.1%HAc的甲醇为流动相B,控制流速为0.5 mL/min,柱温为35℃,采用Zorbax SB-C18反相色谱柱(4.6 mm ×250 mm,5 μm),按照如下梯度洗脱:0~5 min,20% ~25%B;5~25 min,25% ~30%B;25~30 min,30%B;30~40 min,30% ~35%B;40~45 min,35% ~40%B;45~65 min,40% ~60%B;65 ~70 min,60% ~80%B;70~75 min,80%B;75~80 min,80% ~20%B;80~85 min,20%B.采用 DAD检测器,检测波长为190~400 nm.
质谱条件:雾化气N22.07×105Pa(30 psi);干燥气N26.89×104Pa(10 psi);毛细管温度为350℃,在正离子模式下控制毛细管电压为3.5 kV.扫描范围:m/z 100~2000.二级质谱:控制碰撞电压使母离子的信号强度占峰度最高的子离子强度的20%.
1.3.4 大豆异黄酮的定量分析
由于乙酰基类的大豆异黄酮含量较低,本实验中只对染料木素、大豆甙元、黄豆黄素、染料木甙、大豆甙及黄豆黄甙、丙二酰基染料木甙、丙二酰基大豆甙及丙二酰基黄豆黄甙9个组分进行定量分析.具体方法为,选取染料木素、大豆甙元、黄豆黄素、染料木甙、大豆甙及黄豆黄甙为标准品,以260 nm为检测波长,以峰面积为纵坐标(Y),标准品质量浓度(mg/mL)为横坐标(X),分别得到标准曲线方程如式(1)至式(6).
染料木素
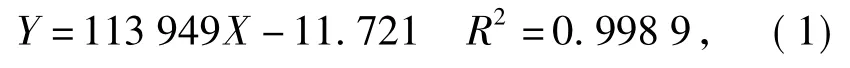
大豆甙元

黄豆黄素

染料木甙

大豆甙

黄豆黄甙

根据标准曲线,分别得到8个样品中的6个大豆异黄酮组分含量,结果表示为mg/100 g豆粕干重.由于丙二酰基的大豆异黄酮标品难于购得,用其相应甙的标准曲线进行定量,如丙二酰基染料木甙的含量表示为mg(G当量)/100 g豆粕干重.
1.3.5 抗氧化性测定方法
抗氧化性的测定方法参考Thaiponga等[18]所用DPPH法和FRAP法.
1.3.5.1 DPPH测定方法
取不同品种大豆异黄酮提取液0.3 mL,加入6 mL 0.1 mmol/L的DPPH溶液,并用无水甲醇定容至10 mL.于25℃水浴反应60 min,于516 nm波长处测定其吸光度,计算不同样品大豆异黄酮提取液对DPPH自由基清除率ΔA%(ΔA%=(At-A0)/A0.At和A0分别为在60 min和起始时的吸光度值).用水溶性VE(Trolox)做标准品,结果用Trolox当量表示(mmol/g),即每克豆粕对DPPH自由基清除能力相当于Trolox的物质的量(mmol).
1.3.5.2 FRAP测定方法
铁离子还原抗氧化能力实验(ferric reducing antioxidant potential assay,FRAP)取 10 mmol/L TPTZ溶液2.5 mL,0.3 mol/L醋酸钠缓冲液(pH=3.6)25 mL,20 mmol/L的FeCl3溶液2.5 mL混合均匀后置于35℃水浴中孵化30 min后得到TPTZ工作液.取不同品种大豆异黄酮提取液0.1 mL,加入TPTZ工作液0.9 mL,再用醋酸钠缓冲溶液定容至10 mL.于35℃水浴中反应30 min,597 nm波长处测定吸光度.以硫酸亚铁溶液作标准曲线,抗氧化能力表示为硫酸亚铁当量(mmol/g),即每克豆粕FRAP抗氧化能力相当于FeSO4的物质的量(mmol).
2 结果与分析
2.1 大豆原料的油脂、水分、蛋白质含量、百粒重及颜色信息
基于品种的差异,8个样品的含油量为9.90%~18.77%,含油量差距较大,小黄豆含油量最高,为18.77%,其次为黄仁乌豆及青仁乌豆分别为18.51%与18.21%,小黑豆含油量最低,为9.90%,见表1.蛋白质的质量分数为37.50% ~40.55%,最高的为小黄豆.根据每100粒种粒的重量,小黄豆和小黑豆均属于小粒种,其余的为大粒种.
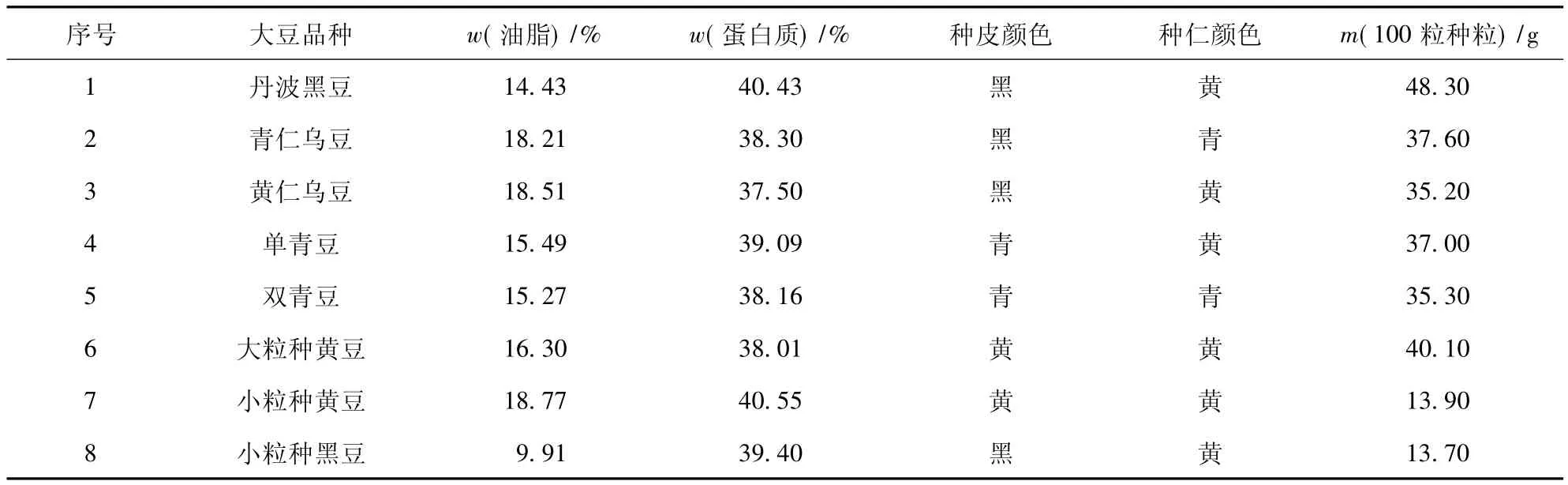
表1 不同大豆样品的含油量、蛋白质含量、颜色及百粒重Tab.1 Content of oil,protein,color and kernel weight of soybean samples
2.2 大豆异黄酮组成及含量分析
2.2.1 大豆异黄酮组分的鉴定
液质联用分析结果表明,不同大豆样品的异黄酮提取物的HPLC色谱图相似.图1为其中的青仁乌豆提取物在260 nm波长处的液相色谱图,表2给出了在色谱图中所出现的大豆异黄酮组分所对应峰的保留时间、离子模式下的质谱峰、二级质谱所对应的碎片峰及它们所对应的化合物.从图1中可以看出,主要的大豆异黄酮组分为2,5,9和12,分别对应于异黄酮为大豆甙、染料木甙、丙二酰基染料木甙及丙二酰基大豆甙,而黄豆黄甙及丙二酰基黄豆黄甙(峰3和10)均较少,同时3个大豆异黄酮甙元(13,14,15)的含量均较低,这与李丹等人的研究相符[19].
2.2.2 不同品种大豆异黄酮含量分析
根据6个标准品的标准曲线,我们对8个大豆样品中除乙酰基类的9个大豆异黄酮组分进行了定量分析,结果见表3.表4给出了不同大豆异黄酮组分的百分含量.从表3和表4可见,染料木甙(G)和丙二酰基染料木甙(MG)为主要的大豆异黄酮组分,含量分别为81.63~133.52 mg/100 g和85.28~134.41 mg/100 g,分别占大豆异黄酮总量的23.09% ~29.08%和23.29% ~30.13%;其次为丙二酰基大豆甙(MD)(含量为71.05~133.37 mg/100 g),占大豆异黄酮总含量的19.9% ~24%;大豆甙(D)的含量则显著低于丙二酰大豆甙(MD),含量为38.36~100.08 mg/100 g,占大豆异黄酮总量的11.56% ~19.97%;丙二酰基黄豆黄甙(MGL)和黄豆黄甙(GL)的含量则较低,分别为10.94~27.10 mg/100 g和5.60~20.36 mg/100 g,仅占总含量的2.80% ~4.74%和1.78% ~3.72%.与文献报道一致,3种大豆异黄酮的甙元染料木素(Ge)、大豆甙元(De)和黄豆黄素(Gle)的含量非常低,三者的总和只占到大豆异黄酮总含量的约3%.图2为不同类型大豆异黄酮占异黄酮总量的百分比,由图2可以看出,在这8个大豆品种中,染料木甙和丙二酰基染料木甙占总含量的一半以上,为51.97%,而大豆甙及丙二酰基大豆甙占38.43%,黄豆黄甙和丙二酰基黄豆黄甙只占6.80%,而3种甙元的总和只占异黄酮总含量的2.80%.

图1 青仁乌豆大豆异黄酮提取液在260 nm处的HPLC色谱图Fig.1 HPLC chromatogram of isoflavone extract from black soybean with qing endorsperm recorded at 260 nm

表2 青仁乌豆豆粕醇/水提取液中主要组分的保留时间、对应的质谱峰、二级质谱碎片峰、分子量及对应的化合物Tab.2 Retention time,m/Z,MS/MS value and corresponding species of the peaks determined by HPLC/MS and MS/MS of the extract from black bean with qing endosperm
不同大豆品种的大豆异黄酮总含量的比较结果发现,丹波黑豆、青仁乌豆、黄仁乌豆及双青豆、单青豆的大豆异黄酮的总含量较低,含量为313.40~368.99 mg/100 g,最低的为丹波黑豆.而两种黄豆和小黑豆则显著高于它们,含量为505.76~546.60 mg/100 g,含量最高的为小黑豆.从结果中还可以看出,小粒种大豆的大豆异黄酮高于大粒种(小黄豆高于大黄豆;小黑豆高于大黑豆),这与Kim[11]和Lee[12]的报道一致.同时黄豆高于相同粒种的青豆和黑豆,该结果与宋冰[20]的研究结果相同.已有报道中对不同种皮,种仁颜色样品中的大豆异黄酮含量比较不多,这一结论还需要通过对更多的品种分析来确定.

表3 不同品种大豆中异黄酮含量Tab.3 Content of isoflavone in different varieties of soybean mg/100 g 豆粕干重a,b

表4 不同品种大豆中不同异黄酮组分的含量Tab.4 Percentage of different isoflavones species in different varieties of soybean%
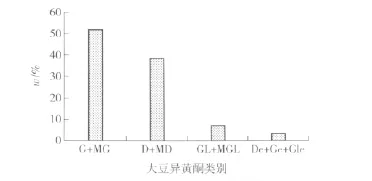
图2 不同类别大豆异黄酮占异黄酮总含量平均百分比Fig.2 Average percentage of different isoflavone by total isofiavones
2.3 不同大豆品种的抗氧化活性研究
为了进一步评价不同种类大豆的功能性,对不同大豆样品的大豆异黄酮提取液分别用DPPH法和FRAP法进行了抗氧化性分析,结果列于表5.由表5可以看出,小黑豆提取液清除DPPH自由基的能力最强,为19.73 μmol Trolox/g,其次为丹波黑豆(16.27 μmol Trolox/g),除此之外,青仁乌豆和黄仁乌豆也具有较高的清除DPPH自由基的能力,分别为 12.07,12.06 μmol Trolox/g,相比之下,大黄豆和双青豆、单青豆的DPPH值则较低,为3.39~4.43 μmol Trolox/g.小黄豆的DPPH值显著升高,与乌豆相接近,为13.64 μmol Trolox/g.FRAP的测定结果与DPPH值相似,除了小黑豆的FRAP值略低于丹波黑豆的值.
对大豆异黄酮总含量与DPPH及FRAP值进行了相关性分析,结果见表6.从表6可以看出,8个大豆的异黄酮提取物中的大豆异黄酮总含量与DPPH清除能力的相关系数与 FRAP值的相关系数,即相关性并不显著.考虑到这些大豆品种中的抗氧化性物质类别有差异,黑豆品种中除了大豆异黄酮,还有抗氧化性很强的花青素,把8个品种分成两组来进行相关性评价,一组为黑豆类,包括丹波黑豆、小黑豆、青仁乌豆和黄仁乌豆,另一组为双青豆、单青豆、小黄豆和大黄豆.结果表明,黄豆和青豆组的大豆异黄酮总含量与DPPH自由基清除能力及FRAP值的相关性均显著提高,R2值分别为0.724和0.699.黑豆组的大豆异黄酮总含量与DPPH值的相关系数为0.811,而与FRAP值的相关系数尽管有所提高,但数值较小,为0.497.

表5 不同品种大豆的大豆异黄酮提取液的抗氧化活性比较Tab.5 Antioxidant activity of different varieties of soybean

表6 不同品种大豆中异黄酮总含量与DPPH值与FRAP值的相关性分析Tab.6 Correlation analysis between isoflavone and antioxidant activity of different varieties of soybean
3 结论
对市场上常见的8种大豆的大豆异黄酮及抗氧化性分析发现,染料木甙、丙二酰基染料木甙、大豆甙、丙二酰基大豆甙为大豆中的4个主要大豆异黄酮组分,其中染料木甙类异黄酮的含量最高,占总含量50%以上,其次为大豆甙类,而黄豆黄甙类含量最低,平均只占到总含量的6.8%左右.在所分析的8个样品中,大黄豆、小黄豆及小黑豆中大豆异黄酮的总含量显著高于其他品种,作为小粒种的小黄豆及小黑豆的大豆异黄酮总含量则显著高于大粒种(小黄豆高于大黄豆,小黑豆高于大粒种的青仁乌豆、丹波黑豆、黄仁乌豆),而同样是大粒种的黄豆则高于所有的大粒种的黑豆品种中的大豆异黄酮总含量.不同品种大豆的异黄酮提取液成分的抗氧化性分析结果表明:小黑豆和丹波黑豆提取液的抗氧化能力最强,8个大豆品种的异黄酮总含量与DPPH值和FRAP值相关性并不显著,然而当分为黑豆组及非黑豆组时,这两组的大豆异黄酮含量与DPPH和FRAP值均有显著相关性,这主要是因为黑豆中花青素对抗氧化性的贡献较大造成的.
在8个品种大豆中,小黑豆的大豆异黄酮总含量及抗氧化性均最高.它的蛋白含量为39.4%,位居8个品种的第三,而含油量仅为9.91%,显著低于其他大豆品种.相比较其他品种的大豆,小黑豆可能具有更高的功能保健价值.
[1]Hagen M K,Ludke A,Araujo A S,et al.Antioxidant characterization of soy derived products in vitro and the effect of a soy diet on peripheral markers of oxidative stress in a heart disease model[J].Canadian Journal of Physiology and Pharmacology,2012,90(8):1095-103.
[2]Shim J Y,Kim Y J,Lee H S.Effects of soybean isoflavone extract on the plasma lipid profiles and antioxidant enzyme activity in streptozotocin-induced diabetic rats[J].Nutrition Research and Practice,2008,2(4):218-26.
[3]Wong J M,Kendall C W,de Souza R,et al.The effect on the blood lipid profile of soy foods combined with a prebiotic:a randomized controlled trial[J].Metabolism,2010,59(9):1331-1340.
[4]Wong J M,Kendall C W,Marchie A,et al.Equol status and blood lipid profile in hyperlipidemia after consumption of diets containing soy foods[J].The American Journal of Clinical Nutrition,2012,95(3):564-571.
[5]李贤标,季莉莉,李勇,等.大豆异黄酮对动脉粥样硬化去卵巢大鼠ATP结合盒A1基因表达的影响[J].中华预防医学杂志,2009,43(10):895-899.
[6]Miguez A C,Francisco J C,Barberato S H,et al.The functional effect of soybean extract and isolated isoflavone on myocardial infarction and ventricular dysfunction:The soybean extract on myocardial infarction[J].Journal of Nutrition and Biochemistry.2012,23(12):1740-1748.
[7]Lu M P,Wang R,Song X,et al.Dietary soy isoflavones increase insulin secretion and prevent the development of diabetic cataracts in streptozotocin-induced diabetic rats[J].Nutrition Research,2008,28(7):464-471.
[8]Bhathena S J,Velasquez M T.Beneficial role of dietary phytoestrogens in obesity and diabetes[J].American Journal of Clinical Nutrition,2002,76(6):1191-1201.
[9]Andres S,Abraham K,Appel K E,et al.Risks and benefits of dietary isoflavones for cancer[J].Critical Reviews in Toxicology,2011,41(6):463-506.
[10]Atmaca A,Kleerekoper M,Bayraktar M,et al.Soy isoflavones in the management of postmenopausal osteoporosis[J].Menopause,2008,15:748-757.
[11]Kim E H,Ro H M,Kim S L,et al.Analysis of Isoflavone,Phenolic,Soyasapogenol,and Tocopherol Compounds in Soybean[Glycine max(L.)Merrill]Germplasms of Different Seed Weights and Origins[J].Journal of Agriculture and Food Chemistry,2012,60(23):6045-6055.
[12]Lee S J,Kim J J,Moon H I,et al.Analysis of isoflavones and phenolic compounds in Korean soybean[Glycine max(L.)Merrill]seeds of different seed weights[J].Journal of Agriculture and Food Chemistry,2008,56(8):2751-2758.
[13]袁凤杰,姜莹,董德坤,等.中国大豆核心种质异黄酮含量分析[J].中国粮油学报,2011,26(2):5-8.
[14]张应,李向华,肖鑫辉,等.重庆不同类型大豆异黄酮含量与品质性状的测定与分析[J].大豆科学,2011,30(1):67-72.
[15]杨雪峰,李文滨,齐宁,等野生大豆蛋白质、脂肪含量与异黄酮含量的相关性研究[J].大豆科学,2011,30:161-463.
[16]国家标准局.GB 5512—1985 粮食、油料检验粗脂肪测定法[S].北京:中国标准出版社,1985.
[17]国家标准局.GB 5511—1985 粮食、油料检验粗蛋白测定法[S].北京:中国标准出版社,1985.
[18]Thaiponga K,Boonprakoba U.Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of Food Composition and Analysis,2006,19(6/7):669-675.
[19]李丹,牟莉,李晓磊,等.高效液相色谱电喷雾质谱联机检测黑豆异黄酮[J].食品科学,2007,28(9):438-441.
[20]宋冰,李鹏月,王丕武,等.大豆异黄酮的品种间差异分析[J].大豆科学,2008,27(4):675-678.
(责任编辑:叶红波)
Comparison Study on Isoflavone Content and Antioxidant Activity of Different Varieties of Soybean
LIU Qin1,2, ZHU Yuan-yuan1, BAI Xing-liang1
(1.School of Food Science and Engineering,Nanjing University of Finance and Economics,Nanjing 210046,China;2.Jiangsu Key Laboratory for Grain and Oil Quality Control and Further Technology,Nanjing 210046,China)
The isoflavone content of 8 different soybean samples was analyzed by HPLC/MS in this paper.The results showed that genistin(G)and malonygenistin(MG)are two major isoflavone species in all samples,and the content accounted more than 50%of total isoflavone content.The total content of Daizine(D)and malonygenistin(MD)ranked next to them,accounting about 38%of total isoflavone.Glycitin(GL)and malonyglycitin(MGL)had very low content in all samples,accounting about 6.8%of total isoflavone content.The big size soybean,such as yellow soybean,had higher total isoflavone content than both black soybeans and qing soybeans,while small size soybeans had higher total isoflavone content than big size soybeans.DPPH and FRAP results showed that black soybeans had higher antioxidant capabilities than yellow and qing soybean.And small size soybeans had higher antioxidant capabilities than big size soybeans.
soybean;isoflavone;HPLC/MS;antioxidant capability
TS214
A
1671-1513(2012)06-0045-07
2012-08-15
江苏省高校自然科学研究重大项目(11KJA550001).
刘 琴,女,教授,博士,主要从事食品化学方面的研究.

